基于网络药理学分析牛黄治疗缺血性脑卒中的作用机制*
2021-06-15陈海李红燕王建谢倩付尹
陈海,李红燕,王建,谢倩,付尹
(成都中医药大学药学院教育部重点实验室中药标准化实验室,四川省中药资源系统研究与开发利用重点实验室,省部共建国家重点实验室培育基地,成都 611137)
脑卒中(中医名中风)是由于脑部供血不足或出血而引起的一种临床常见病、多发病,具有高发病率、高死亡率、高致残率、高复发率的特点[1],且具有逐步年轻化的趋势,是我国成年人致死、致残的首位病因[1]。脑卒中可分为缺血性卒中和出血性卒中,其中,缺血性卒中为脑卒中的主要类型,约占全部脑卒中70%[2]。牛黄为牛科动物牛(BostaurusdomesticusGmelin)的干燥胆囊或胆管结石,首载于《神农本草经》,主惊厥,寒热,热盛狂痓。《本草纲目》中记载:痘疮紫色,发狂谵语者可用。2015年版《中华人民共和国药典》中记载其功效为清心、豁痰、开窍、凉肝、息风、解毒,可用于治疗热病神昏,中风痰迷,惊厥抽搐,癫发狂。可见牛黄自古以来就用于中风、癫狂、惊厥等各种病证的治疗,然其作用分子机制不明。利用“一种药物、一个靶标、一种疾病”的传统药理学的模式很难快速发现新的作用靶点。因此,本研究借助网络药理学方法对牛黄治疗缺血性脑卒中的潜在靶点进行分析,以期发现新的靶点,为下一步实验研究提供一定的理论基础。
1 材料与方法
1.1材料 数据来源于TCMSP数据库(http://lsp.nwu.edu.cn/tcmsp.php)、PubChem Compound-NCBI数据库(https://www.ncbi.nlm.nih.gov/pccompound)、swiss target prediction数据库(https://labworm.com/tool/swisstargetprediction)、uniprot数据库(https://www.uniprot.org/)、Gene Cards数据库(https://auth.lifemapsc.com/)、DisGeNET基因-疾病关联数据库(http://www.disgenet.org/search)、cytoscape3.7.1可视化软件、omicshare资源共享平台(http://www.omicshare.com/)、KEGG数据库(https://www.kegg.jp/)、DAVID数据库(https://david.ncifcrf.gov/)、String数据库(https://string-db.org/)。
1.2方法
1.2.1牛黄化学成分数据库的构建 根据2015版《中华人民共和国药典》和在TCMSP数据库[检索条件:口服生物利用度(oral bioavailability,OB)≥30%且类药性(drug-likeness,DL)≥0.18]中检索结果,牛黄的有效成分确定为胆酸、胆红素、去氧胆酸、胆固醇、猪去氧胆酸、牛磺酸、去氧胆酸甲酯和戊酸盐。
1.2.2牛黄活性成分作用靶点的预测和筛选 PubChem Compound-NCBI数据库中检索牛黄各有效成分的Canonical SMILES;根据Canonical SMILES式在swiss target prediction数据库中查找牛黄各有效成分的作用靶点,绘制成分-靶点互作图;在STRING数据库中找出各个靶点之间的联系,绘制蛋白-蛋白相互作用(protein-protein interaction,PPI)图。
1.2.3缺血性脑卒中靶点筛选 在DisGeNET基因-疾病关联数据库(检索条件:score-gda>0.01)和Gene Cards数据库(检索条件:relevance score≥10)中查找缺血性脑卒中(C0948008)的靶点。
1.2.4成分-疾病共同作用的靶点筛选 汇总牛黄各成分与缺血性脑卒中共同作用的靶点,在uniprot数据库中确定共同靶点所对应的靶基因。
1.2.5功能富集与通路富集 将牛黄的作用靶点导入DAVID数据库,Select Identifier设置为OFFICIAL GENE SYMBOL,List Type设置为Gene List,限定物种为人,对牛黄作用靶点进行GO功能富集分析;在KEGG数据库中利用KEGG Mapper进行KEGG通路富集分析。
2 结果
2.1牛黄活性成分的作用靶点 将牛黄的主要活性成分依次在swiss target prediction数据库中检索其作用靶点,为提高检索精确度,选取每种成分Top15的作用靶点,结果见表1。

表1 牛黄活性成分作用靶点列表
将牛黄的活性成分与作用靶点,在cytoscape3.7.1中进行可视化操作,其结果见图1。
2.2PPI网络的构建 将牛黄的蛋白靶点导入STRING数据库,限定物种为人,获取PPI图,见图2。其中,圆点代表该基因编码的所有蛋白质;连线表示蛋白质之间的相互作用。蛋白的连线越密集、颜色越丰富,提示其在PPI该网络中的作用越重要。从该网络图可以看出:CYP19A1、AR、CASP3、CYP51A1、ESR1、ESR2等蛋白的连线密集,说明其在PPI网络图中所起的作用较大。

图2 牛黄活性成分作用的靶点互作图(PPI图)
2.3活性成分-疾病共同作用的靶点 除去牛黄活性成分间重复作用的靶点,整理后得到牛黄的作用靶点60个;检索Gene Cards数据库和DisGeNET基因--疾病关联数据库,分别得到127个和201个靶点,除去重复作用的靶点,整理后共得到缺血性脑卒中靶点260个。牛黄和缺血性脑卒中两者共同作用的靶点8个,在uniprot数据库中确定共同靶点所对应的基因,分别为:HMGCR、PPARA、CYP2C19、ESR1、ESR2、MMP1、MAPT、CASP3。
2.4GO功能富集 GO功能富集可分为分子功能(molecular function)、生物过程(biological process)和细胞组成(cellular component)三个部分。其中分子功能涉及到催化活性、分子功能调节等过程;生物过程涉及到细胞过程、生物调节、对刺激的反应、代谢过程以及生物调节等过程;细胞过程涉及到细胞器、细胞膜等(图3)。GO功能富集的柱状图(图4)和气泡图(图5)可以看出,TOP5的富集结果分别是甾体激素的代谢过程、甾体激素的生物合成过程、内部刺激的反应、对含氧化合物的反应以及激素的代谢过程。
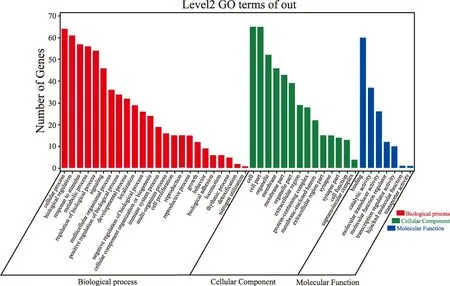
图3 牛黄作用靶点GO功能富集图
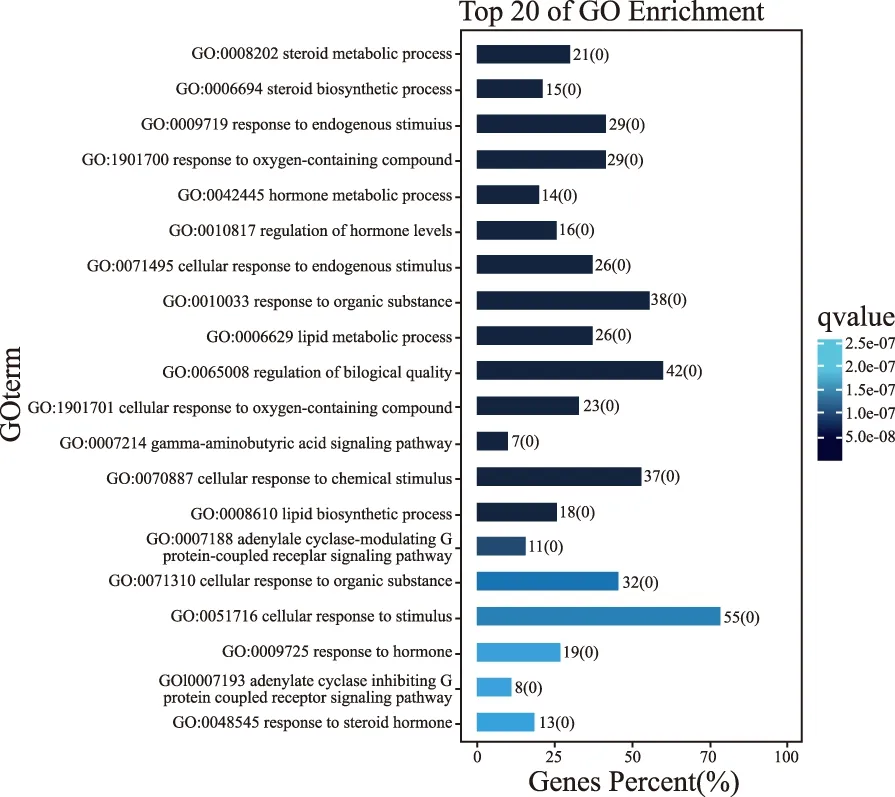
图4 GO功能富集柱状图
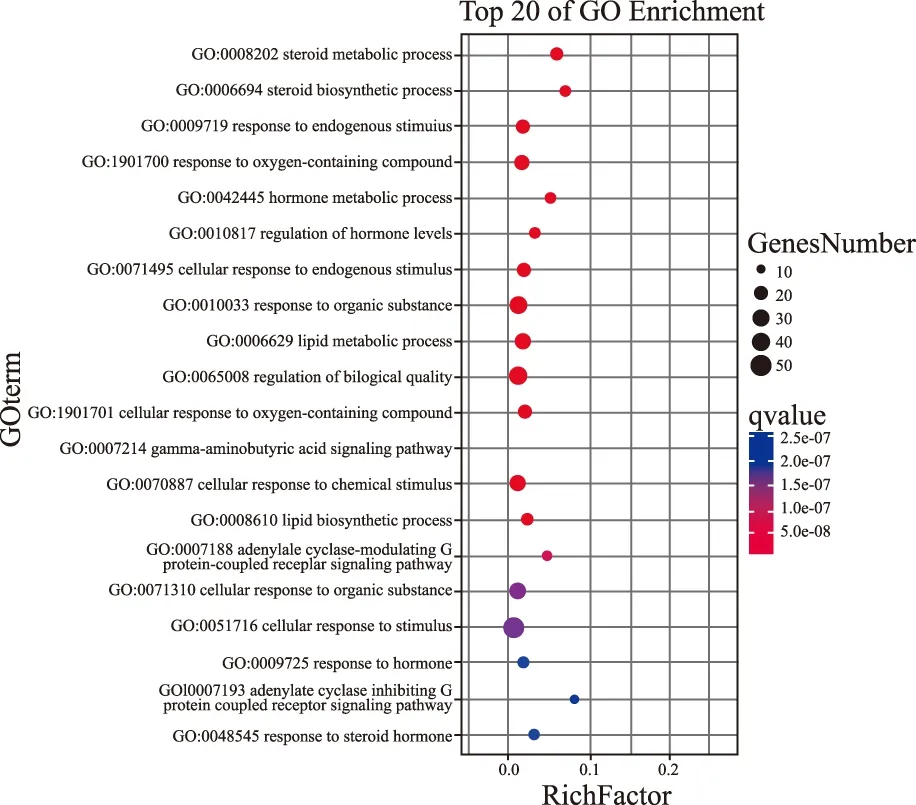
图5 GO功能富集气泡图
2.5KEGG通路富集 将牛黄作用的靶基因进行KEGG通路富集,得到的TOP 5的KEGG通路见表2。

表2 TOP5的KEGG通路富集结果
3 讨论
缺血性脑卒中后脑损伤的机制异常复杂,病理过程涉及炎症反应、氧化应激、兴奋性氨基酸毒性、凋亡等方面[3]。牛黄作为豁痰开窍的良药,临床常用于治疗中风(缺血性脑卒中),然而其分子机制不明。
传统药物靶点的研究是以个别分子为研究对象,采用多种手段研究其生物学性质。这种孤立靶点的研究很难对靶点的功能进行系统全面的认识。而网络药理学以系统性和完整性为特征,可以更快、更准确、更全面地预测药物的作用靶点。本文运用网络药理学的方法发现牛黄和缺血性脑卒中共同作用的靶点有8个,其中CASP3、ESR1、ESR2、CYP2C19、HMGCR等5个在PPI网络图中处于核心位置,提示以上5个靶点是治疗缺血性脑卒中的关键靶点。
Caspase蛋白家族在细胞凋亡过程中发挥着关键作用,其激活与过表达可直接导致细胞凋亡。Caspase3处于凋亡级联反应的下游,是细胞凋亡的关键执行者,当细胞接受凋亡刺激时,它被系列反应激活,进而诱导细胞发生凋亡[4-5]。研究表明体外培育牛黄可通过抑制Caspase3的激活、减少细胞凋亡而治疗由DSS诱导的慢性溃疡性结肠炎[6]。而Caspase3在启动和执行由脑缺血导致的神经细胞的损伤和凋亡方面也发挥重要作用,它可放大蛋白酶级联反应,诱导细胞凋亡[7]。ESR1和ESR2分别编码雌激素受体的两个亚型ERα和ERβ,它们与雌激素结合后发挥生物学效应。研究发现体外培育牛黄可减少肝脏内ERα的表达,从而减轻雌激素诱导的肝内胆汁淤积大鼠肝组织病理损伤[8]。
雌激素与受体结合后对去卵巢局灶性脑缺血模型大鼠具有神经保护作用,而ESR1参与神经保护和认知修复过程[9]。胆固醇是合成甾体激素的原料,也是细胞膜的关键组成部分。许多生物学功能如细胞信号转导、吞噬、细胞膜代谢等均需要胆固醇参与。羟甲基戊二酰辅酶A还原酶(HMGCR)则参与胆固醇的合成,且是胆固醇合成途径的限速酶[10]。
GO功能富集分析和KEGG通路富集的结果显示牛黄治疗缺血性脑卒中与甾体激素的生物合成、代谢通路、神经活性配体——受体相互作用有关。研究表明[11-12]牛黄可通过抑制内质网应激、拮抗兴奋性氨基酸的神经毒性、调节Ca2+稳态、减少一氧化氮(NO)和自由基产生、抗脂质过氧化等途径改善大鼠脑缺血-再灌注损伤。胆红素作为牛黄有效成分之一,能够提高缺血缺氧性脑损伤大鼠的认知功能,抑制海马组织细胞凋亡[13],且可通过降低脑组织Caspase3的表达水平,阻止神经细胞凋亡程序,从而发挥神经保护作用[14]。
甾体激素(包括雌激素、孕激素、雄激素和肾上腺皮质激素)也被证明对缺血性脑卒中具有改善作用。
雌激素可通过MAPK途径减少线粒体Ca2+的内流、保护线粒体免受损伤,进而保护神经元[15];还可以增加脑内内皮型一氧化氮合酶(eNOS)表达,提高NO利用率以促血管舒张、增加脑血流量,保护缺血性脑损伤[16]。孕激素可通过影响PKCβⅡ和NF-κB p65及IP3的表达实现其神经保护作用[17]。关于雄激素对缺血性脑卒中的影响,目前尚存在一定的争议。龙艳芳等[18]研究表明生理水平的雄激素可通过减少细胞色素C(cyt-c)的表达,从而保护缺血-再灌注引起的脑损伤。王国英[19]则发现丙酸睾酮会加重脑缺血-再灌注所致的神经功能缺损和细胞凋亡,其机制与促进Bax表达和减少Bcl-2表达有关。
甾体激素的生物合成与牛黄的作用靶点CYP11、CYP17、CYP19等有关。合成甾体激素的原料——胆固醇在CYP11A的催化下转变成为孕烯醇酮;孕烯醇酮在17A-羟化酶(CYP17A)作用下生成17A-羟孕烯醇酮;17-A羟孕烯醇酮在17,20碳链裂解酶、17-HSD、3-HSD作用下转变成雄激素;雄激素在芳香化酶(CYP19)的催化下转化为雌二醇和雌酮[20]。
以上结果提示牛黄、缺血性脑卒中与甾体激素三者之间关系密切,这与GO功能富集分析和KEGG通路富集的结果是一致的。
综上所述,利用网络药理学的方法发现牛黄可能通过靶向HMGCR、CYP2C19、ESR1、ESR2、CASP3、CYP11、CYP17、CYP19等8个关键蛋白及甾体激素的生物合成、代谢通路以及神经活性配体-受体而起作用,为研究缺血性脑卒中的治疗提供新的治疗靶点。然而,网络药理学的结论只是在大数据的基础上所做的推测,且结论也受所选数据库的限制,因此本研究的结论还需要进一步验证。
