新型氮杂环卡宾铂(Ⅱ)配合物的抗肿瘤活性研究
2021-06-15梁冰冰唐成飞何娟姚华刚
梁冰冰,唐成飞,何娟,姚华刚
(广东药科大学中山校区医药化工学院,中山 528400)
以顺铂为基础的铂类抗肿瘤药物在临床上取得巨大的成功,目前铂类药物仍然是癌症治疗的首选药物[1-4]。与分子靶向药物比较,顺铂具有疗效显著、治疗费用少、抗瘤谱广等优势,适合癌症患者使用。但铂类药物毒副作用(肾毒性、耳毒性及神经毒性等),水不稳定及耐药性问题在一定程度上限制其临床使用[5],促使人们寻找能替代顺铂的更高效、广谱、无毒的新型金属抗癌药物,如铂氮杂环卡宾配合物。1991年,ARDUENGO 等[6]首次分离得到游离氮杂环卡宾(N-heterocyclic carbene,NHC),NHC是一种中性双电子供体,因此易与缺电子试剂发生反应生成新的物质。NHC 在与金属结合时,其所形成的 C-M 键强于 P-M 键,这种金属氮杂环卡宾配合物除了应用于化学反应的催化外,近年来,过渡金属(银、金、铑和铂等)NHC配合物在抗肿瘤活性研究中也显示出良好的抗肿瘤活性[7-8]。本研究主要对已经设计合成的两种金属铂配合物4和5(以下简称配合物4和配合物5),通过进行细胞毒性、细胞摄取、定位细胞死亡方式等,然后进一步探讨它们的抗肿瘤活性和机制。
1 材料与方法
1.1仪器与试药
1.1.1仪器 紫外-可见分光光度计(美国Varian公司 ,型号:Cary 300 );荧光分光光度计(日本岛津公司,型号: RF-301PC);多功能酶标仪(瑞士 Tecan 公司 ,型号:Infinite M200 Pro)。
1.1.2试药 噻唑蓝 (MTT,批号:C10769615)、Hoechst染料、Annexin V-FITC试剂盒、Caspase-Glo®试剂盒、双抗(青霉素-链霉素)(批号:2199839)均购于Sigma Aldrich公司;BCA试剂盒( Novagen Inc,USA ); 电致化学发光(ECL)试剂盒(Amersham Inc,USA);聚偏氟乙烯(polyvinylidene fluoride,PVDF)膜(Millipore,USA );达尔伯克改良伊格尔培养基(Dulbecco's modified Eagle's medium,DMEM)(高糖型),批号:8129333)、RPMI1640 培养基(批号:8129119)、澳洲胎牛血清(批号:2292602)均购于Hyclone Laboratoreis Inc.公司;正辛醇(批号:20190625)、无水乙醇(批号:20190701)均购于Alfa Aesar公司。
1.2配合物的合成 配合物的合成方法见文献[9-10]。结构见图1。

图1 铂类金属配合物4和配合物5的化学结构
1.3细胞系及培养情况 人类宫颈癌细胞(HeLa)、人类非小细胞肺癌细胞(A549)、耐顺铂非小细胞肺癌细胞(A549R)、人乳腺癌细胞(MCF-7)和人类正常肝细胞(LO2)均来自中山大学实验动物中心。 A549和A549R 细胞用含10%胎牛血清RPMI 1640培养基培养,其他细胞用含10%胎牛血清的DMEM培养基培养,其中每毫升含青霉素100 U和链霉素100 μg。细胞置于细胞组织培养瓶中进行培养,置于37 ℃ 恒温箱,箱内输入气体为 5%二氧化碳(CO2)和 95%空气。耐顺铂细胞A549R使用添加顺铂 RPMI 164 培养,从而维持细胞对顺铂的耐药性。细胞实验中所有细胞均加二甲亚砜(DMSO) (1%,V/V)作为对照组。
1.4亲水亲脂系数实验 配合物的亲水亲脂系数(lgPO/W)经正辛醇/水经典摇瓶法测定[11]。
1.4.1预饱和 取等体积的正辛醇和超纯水混合,溶液放在摇床上以200×g摇动震荡,预饱和48 h,静置分层,分别获得预饱和的水相和正辛醇相,标记存放。
1.4.2铂类金属配合物样品溶解分配 称取少量样品置于15 mL离心管中,分别加入预饱和的水相和正辛醇相各5 mL,将溶液置于水平摇床,以200×g摇动震荡48 h 。静置分层,分别得到配合物两相溶液,以15 000 r·min-1离心5 min,滤过,去除未溶解的样品沉淀。
1.4.3紫外吸收光谱测定 以甲醇为稀释剂,等浓度稀释两相,分别测定吸光度(A值)。测定时,参比池中要相应加入等体积不含药物的预饱和水相或正辛醇相。尽量保证正辛醇和水相的甲醇稀释体积相同,当药物在某相中分配过少(配合物多为水相),可考虑增加所取体积进行测试,但要将吸光度(A)值除以相应扩增比例。
1.4.4亲水亲脂系数的计算 lgPO/W=lg(AO/AW) ,式中AO与AW分别为配合物特定波长下正辛醇及水相中的A值。
1.5细胞摄取实验 将HeLa细胞悬液加入到含有DMEM培养基的 100 mm Corning培养皿中,轻轻摇匀,放入培养箱中,待细胞长至约 70%时,将铂配合物4或配合物5样品加入到培养皿中,浓度10 μmol·L-1,孵育 12 h,同时以没有加入药物处理的细胞作为对照组。 孵育结束后,将各个培养皿中HeLa细胞分别用磷酸盐缓冲液(PBS)1~2 mL洗涤3次,加入 胰酶2 mL进行消化2 min,然后加入不含血清的DMEM 培养基4 mL吹打均匀,离心4 min,弃去上清液,重复洗涤2或3次;加入PBS 2 mL,吹打均匀,使其充分形成单细胞悬液,分别用于提取核、线粒体、总细胞[8]。
1.6蛋白免疫印迹分析 将HeLa细胞接种于 Corning 的 100 mm 的细胞培养皿中,培养 24 h后,分别加入配合物2.5,7.5 μmol·L-1,孵育 12 h,弃去皿中培养基,用细胞刮收集所有细胞,用预冷的 PBS 洗涤2次,加入 RIPA 细胞裂解液在冰上裂解细胞,离心,收集上清液。用BCA试剂盒测定总蛋白浓度。用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)分离目标蛋白,然后转移到PVDF 膜上。将膜浸泡于封闭液中,室温振摇2 h。然后与相应的一抗( β-actin,γH2AX )孵育于4 ℃,振摇过夜。用含辣根过氧化物酶 (HRP) 标记的二抗于室温孵育1 h 。最后是用增强的ECL试剂盒进行信号检测[12]。
1.7细胞电镜拍摄实验 将HeLa细胞接种于Corning 的 100 mm 培养皿中,培养24 h 后,加入不同浓度的配合物,于培养箱中避光孵育 12 h,然后不经漂洗直接用细胞刮收集贴壁和悬浮细胞,离心,收集细胞要肉眼可见细胞沉淀至粒径2~5 mm,轻轻加入电镜固定液1 mL,缓缓移入4 ℃冰箱暂存,4 ℃冰袋运输,在保存和运输过程中固定液切勿冷冻结冰。
1.8Caspase-3/7酶活性检测 Caspase-3/7酶活性通过Caspase-Glo®试剂盒,根据试剂盒说明书测定。
目前,工业装配外骨骼主要类型有3种:第1种是以瑞士NOONEE公司[5]研发的Chairless chair为代表的椅子型工业外骨骼,它主要用于生产装配车间,为工人提供长时间静态支撑;第2种是以法国RB3D公司[6]研发的HERCULE V3为代表的力量辅助型外骨骼,它主要用于力量辅助、重物搬运和工具操控;第3种是以美国洛克希德马丁公司[7]推出的FORTIS为代表的工具支撑型外骨骼,它应用范围广,可以辅助支撑多种类型工具。
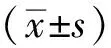
2 结果
2.1配合物的亲脂亲水能力 配合物4和配合物5的lgPo/w分别为(0.99±0.03)和(1.73±0.08),均为正值,说明二者都是亲脂性,并且配合物5脂溶性大于配合物4。
2.2配合物的体外细胞毒性 结果见表1。对于 HeLa 细胞来说,配合物 4的半数抑制浓度(IC50)值为(4.4±0.2)μmol·L-1,约是顺铂IC50值的4.0倍,两组比较差异有统计学意义(P<0.05)。配合物 4 对 A549R 细胞毒性约为顺铂对耐药性细胞的毒性的 5.5倍,差异有统计学意义(P<0.05)。
表1 配合物对不同细胞株的 IC50值
Tab.1 IC50 values of tested compounds towards different cell lines

表1 配合物对不同细胞株的 IC50值
药物HelaA549A549R顺铂17.3±1.022.7±1.056.2±3.2配合物44.4±0.2①②2.5±0.510.2±2.7①配合物58.2±0.2①3.8±0.212.2±2.6①药物LO2MCF-7顺铂20.1±2.329.7±1.2配合物44.2±2.112.4±2.3配合物56.6±0.614.2±2.1
①与顺铂比较,t=15.58~30.34,P<0.05;②与配合物5比较,t=22.03,P<0.05。
①Compared with cisplatin,t=15.58-30.34,P<0.05;②Compared with complex 5,t=22.03,P<0.05.
2.3ICP-MS细胞摄取实验 ICP-MS 结果表明,加药 12 h 后处理肿瘤细胞的各细胞器,并且检测其中铂含量。结果表明,配合物4和配合物5在总细胞中铂含量都明显高于顺铂;经过配合物4和配合物5处理后,细胞内铂主要分布在细胞核中,其中配合物5的总细胞摄取量高于配合物4,更高于顺铂的总摄取。
2.4配合物导致DNA损伤的研究 免疫印迹分析结果(图3 )表明,配合物 4 在 425 nm 光照条件下能使 HeLa 细胞γH2AX 蛋白的磷酸化水平升高,并且对配合物具有浓度依赖性,配合物 4 能有效诱导 DNA 损伤。
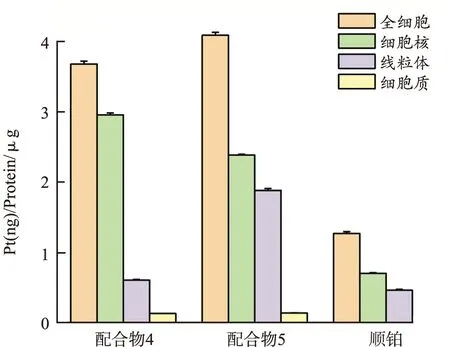
图2 配合物的ICP-MS摄取实验结果

图3 配合物4对HeLa细胞γH2AX蛋白表达水平的影响
2.5配合物的细胞电镜拍摄 扫描电镜拍摄结果可以看出,与对照组细胞比较,配合物4处理的细胞空泡化现象比较明显,放大倍数后观察到细胞核膜破裂不完整、染色质的染色体因发生浓缩而变深,以及凋亡小体的形成。见图4。

图4 电镜下观察配合物4对HeLa细胞的影响
3 讨论
KIEIN等[13]合成Mono-Pt 配合物具有显著的抗肿瘤活性,同时研究表明其配合物能够通过自噬方式引起细胞死亡。为了研究已设计合成的金属铂配合物(Ⅱ)的生物活性,笔者进行相关实验进行说明。本研究中配合物的亲脂亲水系数,结果表明,配合物4和配合物5均是亲脂性的,说明配合物能够通过主动运输的方式进入细胞。并且配合物5的脂溶性大于配合物4,说明配合物5比配合物4更容易进入细胞,从而发挥作用。
为了研究配合物对肿瘤细胞的杀伤作用,利用MTT检测的方法进行,实验结果表明配合物 4是这几种金属化合物中抗肿瘤活性最好的,其IC50值低于顺铂,且差异有统计学意义(P<0.05)。同时配合物4对A549R细胞的毒性约为顺铂的5.5倍,说明配合物 4 能够有效地克服顺铂的耐药性。与配合物5比较,配合物 4 具有较高的细胞毒性(P<0.05),说明将具有共轭面积更大的苯并喹啉配体与甲基苯硫醚配体配位,能够有效协同增加铂配合物的抗肿瘤活性。与配合物5比较,配合物4较好的抗肿瘤活性与其较高的脂溶性及高细胞摄取效率有关。
由于合成的配合物能够有效杀死肿瘤细胞,但其在进入细胞后的分布也是需要关注的问题。ICP-MS 实验结果表明,加入配合物 12h 后对细胞进行处理,检测各细胞器中铂含量,结果配合物4和配合物5进入细胞都主要聚集在细胞核中,其中配合物5 的总细胞摄取量明显高于顺铂;同时也高于配合物4的总细胞摄取量,这与配合物的脂溶性结果是一致的,表1的结果显示配合物5 的脂溶性比配合物4 的好。与此同时,ICP-MS结果还可以看出配合物4的细胞器分布中,细胞核的铂含量分布明显高于线粒体等细胞器,表现出较好的细胞毒性和分布选择性,因此配合物4更具有进一步的研究价值。
已有研究表明,该类金属铂配合物进入细胞后主要集中在细胞核中,破坏肿瘤细胞核内结构,如核内DNA,发挥杀死肿瘤细胞的作用[14]。γH2AX 蛋白是细胞核内DNA相关特征性的抗体蛋白,配合物4能有效诱导核DNA的损伤,且浓度越高损伤越大,从而可以推断在高浓度的配合物的作用下,肿瘤细胞能够被有效的通过核损伤被杀死,达到有效抗肿瘤作用。通过扫描电镜拍摄结果可以看出,配合物4处理后肿瘤细胞出现比较明显的空泡化现象以及凋亡小体的形成,空泡化和凋亡小体是细胞晚期凋亡的主要特征。说明该配合物进入细胞后引起细胞的凋亡,通过这种凋亡的方式杀伤肿瘤细胞。
细胞凋亡的主要标志性的原因过程目前多认为是含半胱氨酸的天冬氨酸蛋白水解酶 ( caspase ) 的被活化[15]。用Caspase-Glo试剂盒分析测定 caspase-3/7 的活性是否因为配合物的作用发生改变。实验结果表明,配合物4和配合物5能够激活肿瘤细胞的caspase-3/7 的活性,且具有浓度依赖性。这表明配合物引起细胞凋亡依赖于Caspase-3/7酶的激活。
综上所述,本研究对设计合成的两种新的金属铂(Ⅱ)配合物4和配合物5进行生物试验,细胞摄取定位实验研究表明,两种配合物进入细胞后均定位在细胞核中,并且这些配合物在正常条件下表现相比顺铂具有较强的细胞毒性(P<0.05),而且配合物 4 比配合物 5 表现得更明显(P<0.05)。同时机制研究表明配合物 4在肿瘤细胞中显著诱导 DNA 的损伤,caspase-3/7 活性实验结果表明配合物在高浓度时对肿瘤细胞的影响是造成细胞的凋亡(P<0.05)。本研究结果对于卡宾配合物的抗肿瘤研究具有一定的参考价值,为类似新药的设计合成提供了一定的研究基础。
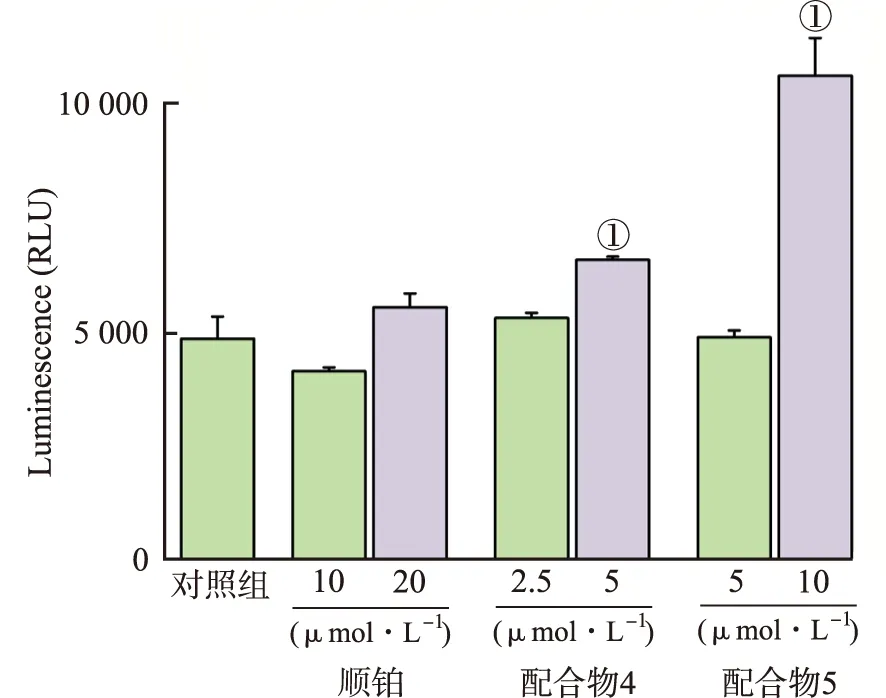
①与对照组比较,t=7.22~12.80,P<0.05。
