“素养为本,情境引线”的探究式教学
——以《醛》的教学为例
2021-06-12张刚
张 刚
《普通高中化学课程标准(2017 年版)》中指出,要全面发展学生的化学学科核心素养,重视开展“素养为本”的教学,即倡导真实问题情境的创设,开展以化学实验为主的多种探究活动,重视教学内容的结构化设计,激发学生学习化学的兴趣,促进学生学习方式的转变,培养他们的创新精神和实践能力[1]。课标对化学教学提出了更高的要求,教师要结合教学内容精心设计教学环节,开展基于核心素养培养的教学活动。学生在习得知识、掌握技能的同时,形成和发展核心素养。笔者以人教版选修5 第三章第三节《醛》为例,通过创设情境、探究活动开展以学科核心素养为导向的课堂教学,以适应新课标的要求。具体教学设计如下:
一、教学设计思路
教学设计的整体思路如图1

二、教学过程
1.环节一 创设情境,引入乙醛
同样是喝酒,为什么有些人一喝酒脸就红得像“关公”,而有些人却越喝越白似“曹操”?
人的酒量大小与酒精在人体内的代谢有关。乙醇进入人体后,先经乙醇脱氢酶催化变成乙醛,接着乙醛又在乙醛脱氢酶的作用下变成乙酸,最后转化为CO2和H2O。如果这两种酶在人体内的含量都很大的话,酒精的代谢速度就很快。但如果这两种酶的含量比较少,尤其是缺少乙醛脱氢酶的话,乙醛就会在体内大量积累,引起面部血管舒张而脸红,同时作用于人的神经系统甚至出现醉酒现象。
过渡:喝酒脸红的主要原因就是乙醛,它就是我们接下来要介绍的主角。
设计意图:从生活走进化学,亲切、自然,利用对生活现象的解释,吸引学生的好奇心,激发学习热情。通过对人体内乙醇的代谢过程,引导学生从化学视角看待实际问题。并让学生学会关注自己的健康。
2.环节二 认识乙醛的物理性质
那么,乙醛是怎样的一种物质呢? 下面我们来具体地认识一下。展示乙醛溶液,观察颜色、状态,并嗅一下气味。
物理性质:无色、刺激性气味、液体,密度比水小,沸点20.8℃,易挥发,能跟水、乙醇等互溶。
设计意图:通过展示乙醛溶液,学生可以直观感受并自主建构其物理性质,在此基础上教师再做总结陈述。使学生掌握物质物理性质的学习方法,即一般从颜色、气味、状态、熔沸点、溶解性等角度分析。体现了“模型认知”核心素养。
3.环节三 乙醛的结构分析
展示乙醛的立体模型和核磁共振氢谱,让学生根据原子的成键特点以及有机物的分类知识写出乙醛的结构式,并指出其官能团。
设计意图:通过立体模型的展示,学生可以直观地了解乙醛的结构,将抽象的有机物结构具体化。学生通过回顾已学知识来完成结构式的书写,温故知新。展示核磁共振氢谱让学生从氢原子的化学环境角度进一步了解乙醛的结构。由物理性质到物质结构,由表及里,由浅入深逐步认识乙醛。
4.环节四 预测乙醛的化学性质
请你从醛基的结构推测乙醛分子中化学键可能的断裂方式,从而预测乙醛可能发生哪些反应?
学生预测:①醛基中C=O 双键可能像C=C 双键一样能发生加成反应。
②醛基中C=O 双键对C—H 键有活化作用,使C—H 键极性变强,可断裂插入氧原子变为C-OH,被氧化,表现还原性。
设计意图:分析乙醛的结构特点,用已有的价健和官能团的相关知识预测其可能的化学性质。培养学生的分析、判断能力,并将“结构决定性质”这个“模型认知”潜移默化,使学生掌握学习有机物的一般方法。
5.环节五 对乙醛化学性质的探究
(1)对预测①进行模型探究
利用乙醛分子和氢气分子的球棍模型分组拼插,探究乙醛的加成反应。引导学生参照碳碳双键的加成原理写出乙醛与氢气加成的化学方程式。并播放乙醛与氢气反应的模拟动画。
书写CH3CHO 与H2的加成反应:
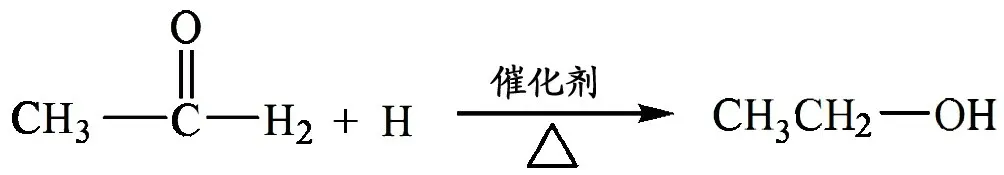
根据有机物的氧化、还原反应的定义判断,乙醛的催化加氢也是什么反应? 体现了乙醛的什么性质?
回忆、思考:乙醛的催化加氢也是还原反应,说明乙醛有氧化性。

设计意图:由醛基的不饱和性类比C=C 双键引出加成反应,进而联想到还原反应,培养学生严谨的逻辑思维。认识事物之间存在联系,且一定条件下可以互相转化,体现了“变化观念”核心素养。
(2)对预测②进行实验探究
你的预测②是否正确? 能通过实验进行验证吗? 如能,请设计实验方案。学生首先想到向乙醛溶液中滴加酸性高锰酸钾溶液。
实验探究1:取适量乙醛溶液于试管中,加入几滴KMnO4酸性溶液,观察实验现象。
实验现象:KMnO4酸性溶液褪色。
结论:乙醛能被KMnO4酸性溶液氧化,说明乙醛有还原性。
设计意图:对猜想进行试验探究,验证猜想是否正确,体验科学探究的一般过程,即“假设→设计方案→实验→观察现象→思考讨论→得出结论”,培养学生的科学探究精神,发展核心素养。KMnO4酸性溶液是学生最容易想到的氧化剂,对乙醛被氧化更容易理解。
乙醛有还原性,还原性强弱如何? 能不能被弱氧化剂氧化呢?
实验探究2:[与新制银氨溶液反应]在洁净的试管里加入1mL2%的AgNO3溶液,然后边振荡试管边逐滴加入2%的稀氨水,至最初产生的沉淀恰好溶解为止,制得银氨溶液。再滴入3 滴乙醛,振荡后把试管放在热水浴中温热。观察并记录实验现象[2]。
注意事项:①试管内壁要洁净。②不能用酒精灯直接加热,要用水浴加热。③加热时不能振荡或摇动试管。④配制银氨溶液时,氨水不能过量(防止生成易爆物)。
设计意图:以弱氧化剂银氨溶液来探究乙醛的还原性强弱,掌握醛基的特征反应。分组实验充分体现学生的主体地位,培养学生的实验操作、观察及分析能力。在实验探究前要强调注意事项,加强实验正确操作培训,以提高实验技能。
实验现象:试管壁上出现闪亮的银镜。
讨论分析,得出结论:Ag+被还原成Ag,乙醛被氧化,表现强还原性。
反应方程式:Ag+被还原成Ag,同时乙醛得到氧被氧化为乙酸,银氨络离子释放出NH3,生成的乙酸在碱性环境中转化为乙酸铵,而NH3极易溶于水难以放出气体。整个反应可巧记为:乙醛和银氨,生成乙酸铵,还有水、银、氨,系数一、二、三。

设计意图:引导学生根据观察到的实验现象来判断反应的产物并分析断键原理,从而了解醛基的特性,并明确官能团对有机物化学性质的决定作用。培养学生的观察、分析及推理能力,体现“证据推理”核心素养;训练学生用化学符号表征反应的能力,并将产物口诀化,便于记忆,突破书写难点。
应用:(1)检验醛基。(2)工业上制镜或保温瓶胆。
设计意图:强化“性质决定用途”的观念,介绍银镜反应的实际应用,使学生明白化学可以服务于生活,学有所用。
实验探究3:[与新制 Cu(OH)2反应]在试管里加入10%的NaOH 的溶液2mL,滴入2%的CuSO4溶液4~6 滴,振荡后加入乙醛溶液0.5mL 加热到沸腾,观察现象[2]。
通过阅读,你觉得实验应注意哪些事项:
①氢氧化铜悬浊液必须新制。
②反应发生的条件:碱性环境、直接加热至沸腾。
设计意图:以弱氧化剂新制氢氧化铜悬浊液来验证乙醛的强还原性,进一步了解醛基的特征反应,进一步体验实验探究的基本过程,进一步掌握化学实验的基本方法和技能,发展学生解决综合实际问题的能力。同时,与生物课上菲林试剂用于葡萄糖的检验联系起来,实现学科间的融合,引导学生从化学的角度来学习和理解生物知识,发展学生的科学素养。
实验现象:试管内有红色沉淀产生。
讨论分析,得出结论:氢氧化铜跟乙醛反应变成氧化亚铜,铜的化合价降低,Cu 元素被还原,说明乙醛可被氢氧化铜氧化,表现还原性。反应可表示为:

设计意图:引导学生通过对实验现象的分析推测乙醛的还原性,培养学生基于证据的逻辑推理能力;回顾氧化还原反应的相关知识,从化合价变化角度分析判断乙醛被氧化,实现知识迁移,并进一步巩固学生采用化学符号表征具体反应的能力。
应用:检验醛基,医院里用于尿糖的检验。
小结:引导学生小结乙醛的化学性质。乙醛可以被Ag(NH3)2OH、Cu(OH)2等弱氧化剂氧化,说明乙醛有强还原性。
归纳总结乙醛的性质:乙醛既有氧化性又有还原性,但氧化性较弱而还原性较强。

通过本节课的学习,你能解释酒精在人体内代谢时都发生什么反应吗?
设计意图:让学生自行归纳、总结,形成对所学知识的自我建构。明确醇、醛、羧酸之间是如何转化的。呼应引入环节,引导学生学以致用,体现了从生活到化学,再从化学回归生活的思想。
三、教学反思
本设计从熟悉的生活情境入手,更易激发学生的学习兴趣,调动学生的主观能动性。沿着“创设情境→分析结构→预测性质→实验探究→观察现象→分析推理→得出结论”这条主线进行探究式教学,环环相扣、层层递进,激发学生的探究欲望,力求使所有的学生有效地全程参与各个环节。挖掘学生思考问题、解决问题的思维和潜能。逐步完成学生对乙醛知识的自主建构,掌握乙醛的加成反应及氧化反应的原理,形成对“物质结构、性质、用途”三者关系的规律性认知。在此过程中,学生的自主学习能力、观察能力、和逻辑推理能力都得到了提升,培养了学生的科学探究精神,真正发展了学生的化学学科核心素养。
