低级别胎儿型肺腺癌1例并文献复习
2021-06-12袁光达李明朱栋麟谢宏亚魏腾腾张传煜杨勇
袁光达* 李明* 朱栋麟 谢宏亚 魏腾腾 张传煜 杨勇
胎儿型肺腺癌(fetal adenocarcinoma of the lung,FLAC)是一种临床上极其罕见的肺恶性肿瘤,仅占肺原发肿瘤的0.1%~0.5%[1]。因其肿瘤性腺体在组织学上与胚胎10~16周肺气道上皮相似而称之为FLAC。该类肿瘤较普通的肺腺癌预后较好,通常可分为低级别(L-FLAC)和高级别(H-FLAC)两个类型。其中L-FLAC预后好,5年生存率可超过80%,H-FLAC的预后较差,报道时通常已为进展期,需要术后辅助化疗[2]。在组织学分型上,其最早被划分为肺母细胞瘤范畴。2011年,由国际肺癌研究协会(International Association for the Study of Lung Cancer,IALSC)、美国胸科学会(American Thoracic Society,ATS)和欧洲呼吸学会(European Respiratory Society,ERS)建立的国际肺腺癌多学科分类首次将FLAC归类为浸润性肺腺癌的一种罕见变体[3]。最新的2015年世界卫生组织(World Health Organization,WHO)肺癌分类中将其作为肺腺癌的一种独立亚型列出[4]。
现报告1例我院近期收治并规律随访的典型L-FLAC患者并进行文献复习。该类型好发于年轻女性,临床上无特异性表现,发病原因尚不明确,是一种非常少见的低度恶性肿瘤,目前国内外文献大多报道的为H-FLAC,而L-FLAC鲜有报道。
临床资料
患者,女,38岁,2天前因“左侧胸部不适”行胸部电子计算机断层扫描(computed tomography,CT),提示左肺上叶一类圆形混杂密度软组织肿块,大小约 23.2 mm ×20.4 mm ×18.4 mm,平均CT值约16 HU。边界清晰,内部未见明显液化坏死区及气液平面,无支气管闭塞。增强CT扫描提示肿块呈不均质强化,平均CT值约31 HU。全身PET-CT检查未及全身转移征象。
2018年4月26日于全身麻醉胸腔镜下行左上肺叶切除加淋巴结清扫术(图1)。手术后送病理检查可及:左上肺叶18.5 cm ×7.5 cm ×3.0 cm,剖面见灰白肿块,直径23 mm。病理诊断:左上肺浸润性腺癌,结合形态及免疫组化结果符合FLAC;脉管未见癌栓;胸膜脏层未见癌累及(图2)。免疫组织化学结果(图3):TTF-1(+),NapsinA(灶+),CK7(–),P40(–),CK5/6(–),Ki67(+80%),VENTANA:ALK-D5F3(部分+),ALK-pos(+),ALKneg(–),PAX8(–),SATB2(–),b-catenin(灶区浆及核+),syn(灶+),cgA(–),CD56(散+),AFP(散+),SALL4(散+),GPC-3(–),ER(–),PR(–)。左上肺手术切缘周围肺组织未见癌累及;支气管切缘未见癌累及;淋巴结未见癌转移:第5、6组(0/1),第7组(0/1),第9组(0/1),第10组(0/6),第11组(0/3),第12组(0/5),肺门周围(0/1)。患者术后无辅助治疗,术后病理分期pT1cN0M0。1年后复查胸部,腹、盆腔,头颅CT平扫未及病情进展,无复发、转移(图4)。

图1 术中所见肿瘤位于左上肺,最大直径约23 mm
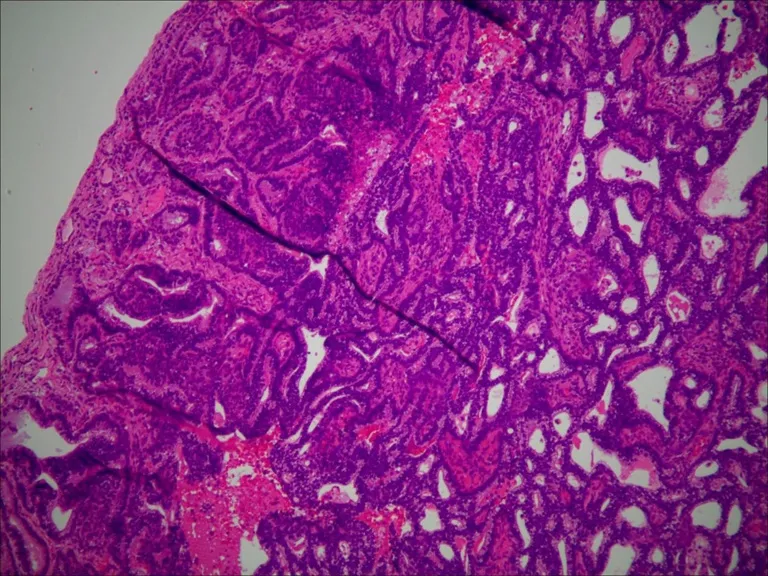
图2 病理可见肿瘤组织排列呈胎儿肺小管样结构,可见肿瘤细胞柱状排列,核上或核下空泡可见,部分腺腔内可见桑葚体。脉管未见癌栓,胸膜脏层未见癌累及(HE,×100)
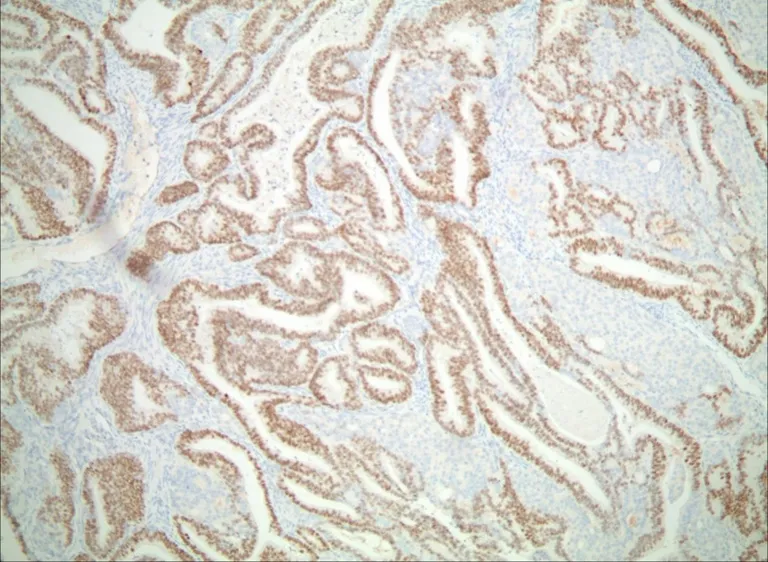
图3 免疫组织化学结果(EnVision,×200)

图4 术后1年复查胸部CT平扫
讨 论
临床上FLAC极为少见,恶性程度不高。最早称为肺内胚瘤,又称伴有嗜银细胞并缺乏肉瘤样形态的肺母细胞瘤。发病率占原发性肺部肿瘤的不到0.5%,病死率有报道称低于15%[5]。发病年龄高峰在30~50岁,性别差异无统计学意义,偶见于儿童,好发于右肺上叶[6]。本病无特异性临床表现,临床上以咳嗽、胸痛及呼吸困难多见。影像学上亦无明显特异性,常见膨胀性肿块,其内存在液化坏死区,很少累及周围肺实质,无明显空气支气管征[7]。相较于H-FLAC多见于有吸烟史的老年男性患者,L-FLAC则倾向于发生在年轻非吸烟女性中,发现时通常为Ⅰ~Ⅱ期。而H-FLAC通常在报道时已为晚期疾病,预后较差,需要术后辅助治疗。
“桑葚体”是L-FLAC病理上的特征性表现,即在腺体基底部或腔面发现由鳞状细胞样细胞形成的实性球体,肿瘤的间质成分少,可侵犯临近的肺实质,在肺实质内形成小结,与周围组织分解较清楚[8]。显微镜下仅见恶性上皮成分,缺乏明显肉瘤成分。癌细胞通过表达如GATA-6等免疫组织化学标志物,形成超微及组织学构造,如同初生胎儿肺泡表面上皮[9]。免疫组织化学上,β-catenin基因突变及相关蛋白质的异常性表达,对诊断有一定价值。Zhang等[10]通过对8例FLAC对比分析发现,L-FLAC主要是细胞核和细胞质定位的β-catenin表达。相反,H-FLAC往往不存在桑葚体(Nakatani 等[11]认为这是桑葚体的双相模式,可能与上皮-间质转化有关),β-catenin表达以膜定位为主。另外,H-FLAC中p53蛋白过度表达,而L-FLAC中则表现为p53(–)。这提示L-FLAC和H-FLAC可能具有独特的临床病理,免疫表型和分子特征。两者可能为两种独立的组织学亚型,H-FLAC似乎更接近常规肺腺癌。
FLAC的分子机制尚不完全明确,FLAC中KRAS、EGFR和PIK3CA的突变率均非常低。Zhang 等[10]在中国人群中通过突变分析,发现H-FLAC以EGFR L858R突变为主,L-FLAC以EGFR T790M突变为主,两者存在明显差异。Fu等[12]通过二代测序发现在一例H-FLAC中同时带有两个突变基因,除β-catenin外,BRCA2和TSC2可能在Wnt信号通路的上调中起重要作用。
手术治疗依旧是FLAC,特别是L-FLAC的标准治疗方式,通常以根治性肺叶切除加淋巴结清扫为主[13]。亚肺叶切除和靶向治疗在FLAC的安全性和有效性上尚缺乏足够证据,免疫治疗途径则尚未见报道,这可能和缺乏有效的分子靶点有关。根据Ricaurte等[8]的报道,辅助放疗及化疗对FLAC的作用有限,通常用于H-FLAC以及较为晚期患者的治疗。Lkhoyaali等[14]曾报道新辅助化疗(丝裂霉素、异环磷酰胺和顺铂)在1例cT4N0M0期FLAC患者术前的应用,提示对于晚期难以手术的FLAC,亦可考虑新辅助化疗后再行手术治疗。淋巴结阳性,初次诊断时有转移以及术后肿瘤复发均为预后不良的影响因素[8],另外Suzuki等[15]认为H-FLAC成分是肺腺癌的重要预后指标,往往提示预后较差,且比以微乳头成分为主的腺癌预后差。这说明L-FLAC和H-FLAC在预后上存在较大区别,两者与目前分期所匹配的常规肺腺癌均存在一定差异。
结合本病例及文献复习,本研究发现:①对于实体性肺癌,术前需要行PET-CT检查,必要时可予经皮肺穿刺活检,进一步明确肿瘤性质,有助于手术等治疗策略的制定和进行,对于术中淋巴结的处理也有预判;②尽管文献报道FLAC恶性程度不高,但L-FLAC和H-FLAC之间在分子机制、临床表现、治疗及预后上均存在较大差异,因此术前仍需要对患者进行充分全面的评估,术后仍需要定期随访复查,有条件的情况下可考虑行基因检测;③L-FLAC和H-FLAC的组织学分型,TNM分期应当加以区分,尽管世界范围内,各个中心均缺乏足够的样本数量,但关于两者发生发展的分子机制和治疗方案仍亟需进一步的研究加以明确。
