凡纳滨对虾水煮加热过程颜色与虾青素及体外抗氧化活性的相关性
2021-06-12张旭飞罗晓琳吉宏武刘书成任惠峰毛伟杰
张旭飞,罗晓琳,吉宏武,2,刘书成,2,任惠峰,毛伟杰,2
(1.广东海洋大学食品科技学院// 广东省水产品加工与安全重点实验室// 广东省海洋生物制品工程实验室// 广东省海洋食品工程技术研究中心// 水产品深加工广东普通高等学校重点实验室,广东 湛江,524088;2.海洋食品精深加工关键技术省部共建协同创新中心,大连工业大学,辽宁 大连,116034;3.东京海洋大学,日本 东京)
凡纳滨对虾(Litopenaeus vannamei),又称南美白对虾,是世界上养殖规模最大、经济价值较高的对虾品种[1]。颜色是评价对虾品质的重要指标[2-3]。虾青素是影响对虾颜色变化的主要色素,随着加热温度升高虾青素被释放导致对虾体表颜色逐渐变红[4-5]。目前凡纳滨对虾品质研究中均通过色差仪来测定颜色[7-8],但由于对虾的形状不规则、加热时颜色变化不均匀,具有一定的局限性,尤其不适合连续化生产时颜色变化的测定。计算机视觉系统(CVS)是一种客观、快速、非接触、无损伤的连续检测方法,可以实现分析食物整个表面的每个像素并量化表面特征和缺陷[9],如番茄[10]、烤鸡[11]、鲇鱼[12]等,但利用CVS 对对虾色泽测定的研究报道较少。Hosseinpour 等[13]利用CVS 分析干燥过程中的对虾颜色变化,但其方法较为繁琐,将图像进行分割,然后获取其RGB 值,最后转换成CIE 系统的L*、a*、b*值。目前利用CVS 对对虾加热过程中色泽进行连续性的测定尚未有研究报道。
虾青素具有很强的抗氧化能力,但是在光或热的作用下,其结构很容易被破坏[6]。从虾壳中提取的虾青素,其DPPH 或ABTS 自由基清除能力是抗坏血酸的72 倍或220 倍[14]。目前从对虾废弃物中提取的虾青素研究报道较多,但对虾肉中虾青素及其抗氧化活性在加热过程中变化情况的研究报道较少。在连续加热过程中对虾颜色变化与虾青素含量及其抗氧化活性之间是否存在相关关系尚待深入研究。本研究利用CVS 首次对水煮加热过程中对虾的颜色进行连续化测定,确定CVS 参数,通过与色差仪测定的色值之间的相关性分析,探讨其应用可能性,以期为对虾加工提供连续化测定方法;分析水煮加热过程中对虾颜色与虾青素含量及其体外抗氧化活性之间的相关关系,为对虾产品的开发及品质控制提供理论依据。
1 材料与方法
1.1 材料
凡纳滨对虾,购于湛江欢乐海洋水产品批发市场(体长14~ 16 cm,体质量20~ 23 g)。虾青素标准品(纯度≥98%),购于上海源叶生物科技有限公司;无水乙醇、硫酸亚铁、双氧水、水杨酸、过二硫酸钾均为分析纯,购于汕头西陇科学股份有限公司;氢氧化钠(分析纯),购于广东光华科技股份有限公司;甲醇、乙腈、二氯甲烷均为HPLC 色谱级,购于赛默飞世尔科技;DPPH(纯度≥98%)和ABTS(纯度≥98%),均购于阿拉丁生物科技有限公司。
1.2 仪器与设备
Agilent 半制备1200 高效液相色谱仪,美国Agilent 公司;Multiskan FC 酶标仪,美国Thermo公司;旋蒸仪(N-1100D-WB),上海爱朗仪器有限公司;氮吹仪(MGS-2200H),东京理化器械株式会社;Opsens 数显光纤温度探针,中国深圳欧普申光电科技有限公司;数显高速分散均质机(T25);色差仪(尼卡美能达CR-20),日本柯尼达美能达股份有限公司;摄影棚(DEEP40cm 型),上海诺美摄影器材有限公司;三脚架(轻装时代Q999H 横臂三脚架),广州轻装摄影器材有限公司;数码相机(Canon PowerShot G12),日本佳能股份有限公司;287 标准色卡(RAL-D9),德国劳尔公共有限责任公司。
1.3 方法
1.3.1计算机视觉系统与色差仪评价颜色相关性
1.3.1.1标准色卡预处理 将标准色卡根据色差仪测量面积要求进行适当裁剪,编号。
1.3.1.2色差仪测定色卡颜色 色差仪开机预热后进行校正,将色卡按编号顺序置于色差仪中测量三次并记录相应L*、a*和b*值。
1.3.1.3CVS 测定色卡颜色 CVS 的建立:主要由照明系统、图像采集系统及图像处理系统组成[15]。采用两盏平行灯(长40 cm、每盏灯均匀分布着120颗LED 灯珠)照明,灯板可以在棚体框架上移动以灵活布光,色温5 700 K,显色指数(Ra)大于92%,两盏灯都位于样品上方40 cm 处并与样品呈45°,作为标准照明系统。数码相机垂直放置在距背景板30 cm 处,相机镜头与光源轴线之间的角度约为45°以捕获颜色的漫反射(造成颜色的漫反射主要发生在入射光45°),作为标准拍摄条件。
图像在白色背景下拍摄,相机设置如下:手动模式,ISO 400,镜头光圈f 4.0,快门速度 1/160,分辨率为2 816×1 880 像素,无变焦,无闪光,JPEG格式存储。相机通过IFC-400PCU 界面连接线连接到带有Adobe Photoshop 2018 的计算机USB 端口,直接从计算机中获取图像。
用Adobe Photoshop 2018 软件打开待处理图片,用菜单栏中的椭圆选框工具选定需要分析的区域,在图像中选择Lab 颜色模式,然后在图像里的“直方图”中查看选中区域的并实时记录L值、a值、b值,重复测量3 次取平均值[16]。
CVS 测定色卡L、a、b值:照明系统预热30 min后,将色卡按编号顺序置于摄影棚中心,照相机垂直放置于摄影棚上开口,在标准的拍摄条件下和特定照相机参数下拍摄色卡图像,以JPEG 形式储存后备用。使用Adobe Photoshop 2018 软件椭圆工具选中色差仪所测量的面积,使用Lab 模式提取图像L、a、b值,每个色卡测量3 次。
1.3.2加热过程中凡纳滨对虾颜色变化研究
1.3.2.1材料预处理 在加热试验前从-80 ℃超低温冰箱中取出样品,于冰水中解冻至虾中心温度达到0 ℃,即解冻完成。用滤纸擦干虾表面水分,将温度探针插入样本虾的第二腹节中心,以一只虾为单位装入带密封口的聚乙烯透明塑料袋。
1.3.2.2加热方法 将样品分别置于40、50、60、70、80、90 ℃恒温水浴锅中隔袋水煮加热,于样品中心温度到达水浴温度第0、3、6、9、12 min 分别取出3 个样品并置于封口袋中冰水冷却至0 ℃,用滤纸擦干虾表面水分备用。此样品用于分析对虾CVS 测定与色差仪测定的相关性。
将样品置于90 ℃恒温水浴锅中隔袋水煮加热30、60、90、120、180、300、360、540、720 s,分别取出3 个样品并置于封口袋中冰水冷却至0 ℃、用滤纸擦干虾表面水分备用。
1.3.2.3颜色测定 色差仪测定样品L*、a*、b*值:色差仪开机预热后进行校正,测量凡纳滨对虾样品去壳后的第二肌节L*、a*、b*值。
CVS 测定样品L、a、b值:照明系统预热30 min后,将色差仪测定后的样品置于摄影棚中心,在标准的拍摄条件下和特定照相机参数下拍摄样品图像,以JPEG 形式储存图像,使用Adobe Photoshop 2018 软件椭圆工具选中色差仪所测量的面积,使用Lab 模式提取图像L、a、b值。
1.3.3水煮加热过程中凡纳滨对虾虾青素含量的测定 虾青素的提取:参考Hu 等[17]的做法,略有改动。将2 g 样品放入50 mL 离心管中,按质量(g)体积(mL)比1∶7 添加乙醇,5 000 r/min 均质,匀浆1 min,混合均匀,并用40 ℃水浴摇床浸提2 h,4 ℃下8 000 r/min 转速离心5min,收集上清液,将沉淀按上述步骤重复萃取3 次直至样品无色,合并上清液。为保证虾青素不被破坏,提取过程全程温度控制在4 ℃左右。将上清液混合均匀后放在棕色玻璃瓶中密封保存,旋转蒸干样液,用10 mL 无水乙醇复溶。取5 mL 粗提液于试管中,加入1 mL的0.02 mol/L 的NaOH 乙醇溶液,混匀,氮气吹扫至总体积为5 mL,置于4 ℃避光静置12 h,得到虾青素提取物。过孔径0.22 μm 滤膜过滤后进行高效液相色谱(HPLC)分析。
虾青素标准曲线的测定:准确称取虾青素标准品(≥98%)2.5 mg,用无水乙醇溶解定容至25 mL,配制虾青素浓度为2、4、6、8、10、12 μg/mL,在474 nm 处测定其光密度值。以虾青素浓度为横坐标,峰面积为纵坐标,绘制标准曲线为y=50.713x+10.23,R²=0.999 9。
HPLC 条件:色谱柱为反相C18 柱(Agilent Technologies,ZORBAX,4.6 mm × 250 mm,5 μm),流动相是乙腈/ 甲醇/ 二氯甲烷(体积比80∶15∶5),使用前流动相超声脱气30 min;流速1 mL/min;检测波长474 nm;柱温为25 ℃;进样量为20 μL。
1.3.4体外抗氧化活性的测定 DPPH 自由基清除能力的测定:参考刘涵等[18]的方法,并略有改动。准确称取DPPH 标准品,用无水乙醇配制浓度为0.2 mmol/L 的DPPH 乙醇溶液。测定时,在96 孔板中加入DPPH 乙醇溶液100 μL,然后再加入样品溶液100 μL,置于室温黑暗处30 min,测定517 nm 处的光密度Di。同时,测定100 μL 样品溶液+100μL乙醇溶液在517 nm 波长处的光密度Dj。再测定100 μL DPPH 溶液+100 μL 乙醇溶液在517 nm 处的光密度D0。DPPH 自由基清除率按下面公式计算:DPPH 自由基清除率(%)=[1 -(Di-Dj)/D0]。
ABTS 自由基清除能力的测定:参考Pu 等[19]方法,并略有改动。配制ABTS 储备液:将5 mL 7 mmol/L ABTS 和88 μL 140 mmol/L 过硫酸钾混合,室温、避光条件下静置12 h,使用前用无水乙醇稀释,使其在30 ℃、734 nm处的光密度为0.70±0.02。测定时,在96 孔板中加入ABTS 工作液100 μL,然后再加入样品溶液100 μL,振荡混匀,10 min 后测定其在734 nm 波长处的光密度Dt,空白光密度D0为100 μL ABTS 工作液+100 μL 无水乙醇,测定100 μL 样品溶液+100 μL 无水乙醇吸光度光密度Dr。ABTS 自由基清除率按下面公式计算:
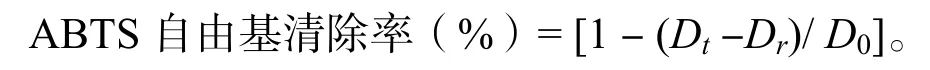
羟自由基清除能力的测定:在96 孔板中加入50 μL 样品,再加入50 μL 6 mol/L FeSO4溶液,100 μL 6 mol/L H2O2溶液,充分振荡10 min。继续加50 μL 6 mol/L 水杨酸乙醇溶液,室温、避光放置30 min,510 nm 处测定光密度Dj;用水代替水杨酸,同样的方法进行测定光密度Dj;D0为空白对照。羟自由基清除率按下面公式计算:
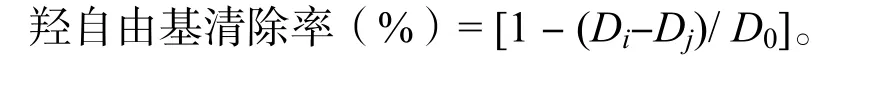
1.4 数据处理
3 个样品为一组,每个样品重复测量3 次。数据用“平均值±标准差”表示,使用JMP 进行显著性分析,P< 0.05 表示差异显著;利用excel 表中的correl 函数计算相关系数r,r越接近1,表示相关程度越强。绘图使用Origin 2018。
2 结果与分析
2.1 CVS 与色差仪测量标准色卡颜色相关性
使用CVS 和色差仪分别对287 色色卡测得L、a、b与L*、a*、b*,对数据进行线性回归分析,结果如图1 所示。建立回归模型:

由此可以看出,CVS 与色差仪在测量均匀颜色样品方面具有显著线性相关规律(P< 0.05),且相关性较高,说明可以用CVS 代替色差仪测定物质的颜色。并成功建立CVS 系统及其参数,即在40 cm的摄影棚中采用两盏平行灯(长40 cm、每盏灯均匀分布着120 颗LED 灯珠)照明,灯板可以在棚体框架上移动以灵活布光,色温5 700 K,显色指数(Ra)大于92%,两盏灯都位于样品上方的40 cm处并与样品45°的角度,作为标准照明系统。数码相机垂直放置在距离背景板30 cm 处,相机镜头与光源轴线之间的角度约为45°,拍摄背景为白色,相机设置为手动模式,ISO:400,镜头光圈f 为4.0,快门速度为1/160,分辨率为2 816 × 1 880像素,无变焦,无闪光。可采用同样的条件去测定色泽均匀的物质。
凡纳滨对虾在加热时颜色变化并不均匀,同时CVS 是否可以检测颜色的不断变化,需对加热过程中的凡纳滨对虾颜色变化进行研究。
2.2 CVS 与色差仪测量对虾颜色相关性
使用CVS 对水煮加热过程中凡纳滨对虾测定得L、a、b,使用色差仪对90 组加热过程中的凡纳滨对虾测定得L*、a*、b*,用数据L、a、b与L*、a*、b*进行相关性分析。结果如图2 所示,建立回归模型:
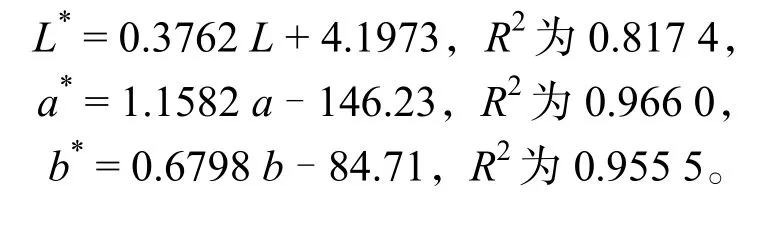
结果表明对于凡纳滨对虾样品颜色测量,CVS测定值L、a、b与色差仪测定值L*、a*、b*之间的线性关系显著相关(P< 0.05),可使用CVS 代替色差仪测定样品的色差。L值的相关性略低于a,b值,可能是因为在加热过程中虾肉蛋白变性及体内水分的溶出,在测定时出现反光现象。通过色差仪和CVS 的测定的色值相关关系可知,CVS 可以用于颜色的连续化测定。但是由于在实际生产过程中,对虾颜色是在升温过程中发生显著变化的,所以有必要进一步研究升温过程中颜色及虾青素的变化。
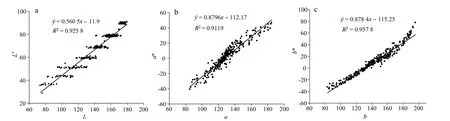
图1 CVS 与色差仪测定标准色卡L*、a*、b*值的回归模型,Fig.1 Regression model of L*,a*,and b* values of standard color card measured by CVS and colorimeter,
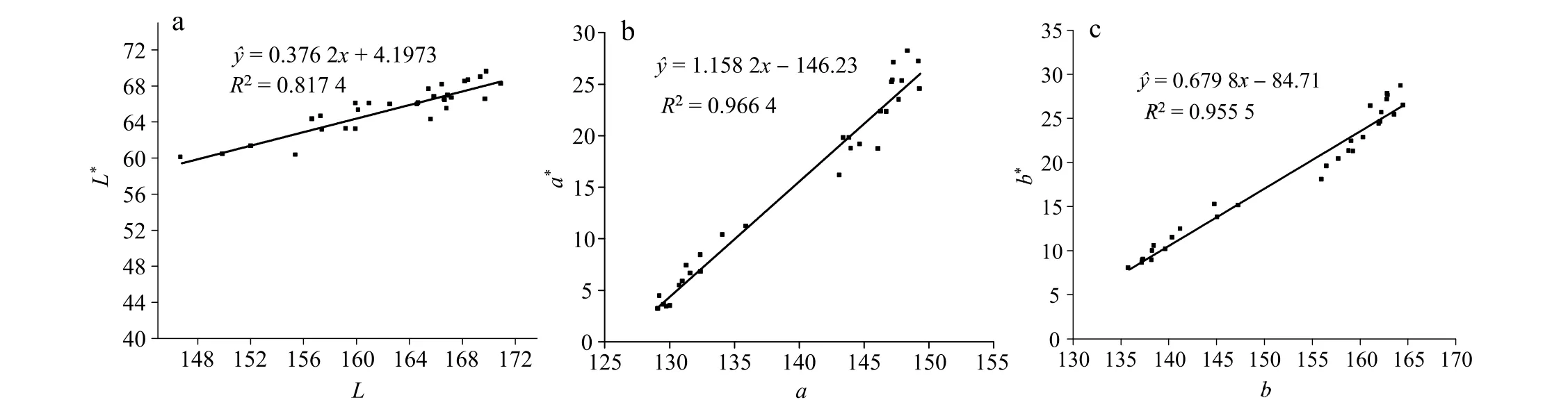
图2 CVS 与色差仪测定加热过程中对虾的L*、a*、b*值的回归模型Fig.2 Regression model of L*,a*,and b* values of shrimp during heating by CVS and colorimeter
2.3 水煮加热过程中凡纳滨对虾颜色的变化
由图3 可知,90 ℃水浴加热 720 s,在300 s前,L、a、b值均随加热时间的增加而增加,呈上升趋势。0 s 时为生鲜虾,中心温度为4 ℃,L、a、b值为初始值,当加热时间为30 s 和60 s 时,虾的中心温度达到13.9 ℃和37.5 ℃;当加热时间为90 s 时,虾的中心温度为49.7 ℃,超过虾青蛋白起始变性温度45 ℃,此时虾青蛋白已经开始变性。当加热时间为300 s 时,虾中心温度已经达到84.5 ℃,随着加热时间的延长,凡纳滨对虾的中心温度逐渐增加从而导致虾青蛋白逐渐受热变性。随着温度升高,变性程度加剧,释放出的虾青素增多,使对虾发生红变、黄变现象,且变化程度逐渐增强。当加热时间大于300 s,随着加热时间的延长,虾中心温度升温速率逐渐减缓,加热360 s 时,中心温度从74.1 ℃升到87 ℃,540 s 后逐渐趋于平稳,此时虾青蛋白已完全变性。随着加热时间的延长,a、b值均无显著变化(P> 0.05);L值随着加热时间的增加呈下降趋势,但总体变化趋势不大。这是因为凡纳滨对虾随着加热时间增加虾青素发生降解,同时也与细胞内外水分迁移以及肌肉蛋白质发生收缩、变性有关[20]。董志俭等[21]也发现在360 s 前随着煮制时间的延长,凡纳滨对虾的L*、a*、b*值均呈上升趋势;在360 s 后L*、a*、b*值逐渐趋于平稳,变化趋势不大。

图3 升温加热对凡纳滨对虾颜色的影响Fig.3 Effect of heating on the color of Litopenaeus vannamei
2.4 水煮加热过程中对凡纳滨对虾虾青素的变化
如图4 所示,随着加热时间的延长,虾青素的含量先逐渐增大然后减少,在300 s 时,虾青素含量达到最高,为19.87 μg/g,之后虾青素含量降低。加热后虾青素含量升高主要是因为虾青素在对虾体内是与蛋白质结合存在,加热后蛋白质变性,释放出更多的虾青素;而后降低可能是由于在加热过程中虾青素发生氧化降解以及随着水分流失等原因[22]。蔡燕萍等[23]发现煮制过程中对虾虾青素含量随加热时间的呈现先上升后下降趋势,与本研究一致。结合图3,在300 s 之前,虾青素含量与L、a、b值都随着加热时间的延长呈上升趋势,这是由于虾青素的释放引起的;在300 s 时,L、a、b值与虾青素含量均达到最大值;而在300 s 之后,a值、L值呈下降趋势,虾青素也呈下降趋势,说明对虾色泽的变化与虾青素含量是相关的,与Niamnuy等[24]得到的结论一致。
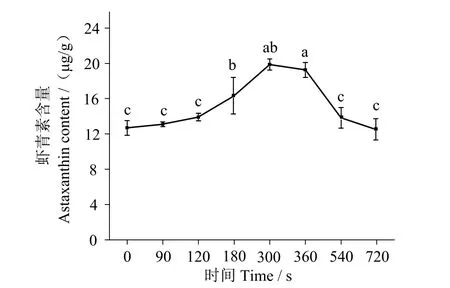
图4 水煮加热过程中凡纳滨对虾虾青素含量的影响Fig.4 Change of the astaxanthin content of Litopenaeus vannamei during boiling
2.5 水煮加热过程中凡纳滨对虾体外抗氧化活性的变化
由图5 可知,凡纳滨对虾中虾青素对DPPH 自由基、羟基自由基和ABTS 自由基有较高的清除能力,随着加热时间的延长,虾青素对DPPH 自由基的清除能力逐渐增强,对羟基自由基和ABTS 自由基的清除能力先增大后趋于平稳。鲜虾中虾青素对DPPH 自由基的清除率为47.84%,加热到720 s 时,DPPH 自由基的清除率升高到70.41%,虾青素含量在加热300 s 后降低,但其DPPH 自由基清除能力却增强,这可能是因为加热破坏了虾青素的结构,使其结构发生异构化,虾青素受热后其反式结构转化成了顺式结构。杨澍等[6]研究发现,凡纳滨对虾经水煮 15 min 后,全反式虾青素含量下降了51.84%,而13-顺-虾青素增加了17.59%,并产生了9-顺-虾青素,表明对虾经加热后全反式虾青素会转化成顺式异构体。有文献报道虾青素的顺式异构体的抗氧化活性均高于全反式[25]。当加热时间为300 s时,虾青素几乎可以完全清除羟基自由基和ABTS自由基,与张丽瑶等[26]的实验结果相似。
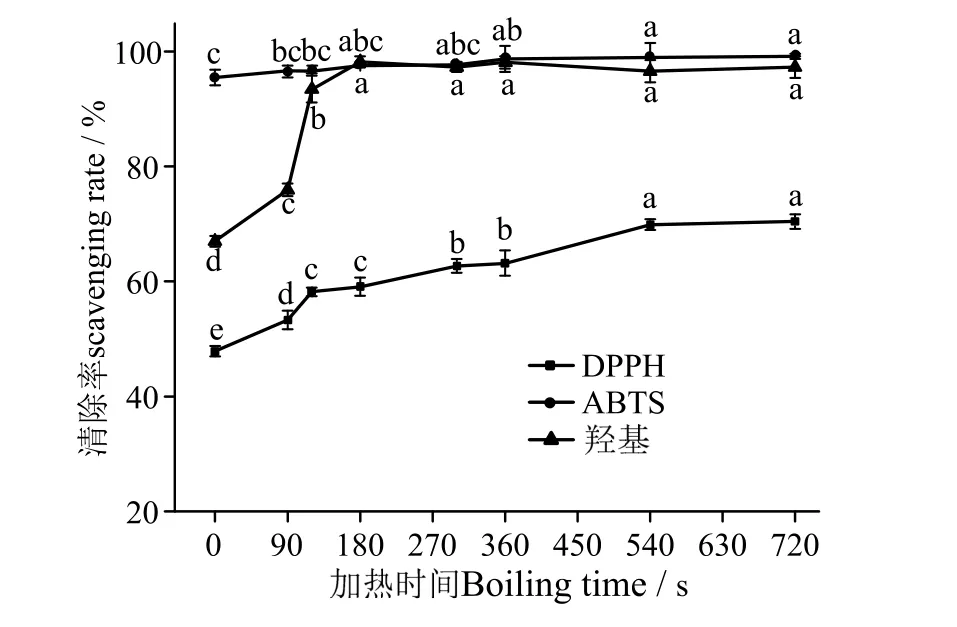
图5 水煮加热过程中凡纳滨对虾体外抗氧化活性的变化Fig.5 Change the vitro antioxidant activity of Litopenaeus vannamei during boiling
2.6 水煮加热过程中凡纳滨对虾颜色、虾青素及体外抗氧化活性相关性
根据国际食品法典标准中要求,对虾的熟制是将产品中心温度加热到 65~ 70 ℃[27],本研究中凡纳滨对虾水煮加热300 s 时,中心温度可达到84 ℃,已符合工厂生产的实际要求。对300 s 内其L、a、b值和虾青素含量及自由基清除率做相关分析,结果见表1。在加热过程中L、a、b值变化与虾青素含量、DPPH 自由基清除率、羟基自由基清除率、ABTS 自由基清除率均极显著相关(P<0.01),并呈正相关关系,均随着L、a、b值的增大而增大。L、a、b值均与DPPH 自由基清除率达到了极高相关性(r> 0.9),与羟基自由基清除率、虾青素含量分别达到高度相关(r> 0.7);L值、b值与ABTS 自由基清除率达到极高相关(r> 0.9);L值、a值与羟基自由基清除率的相关性较低。
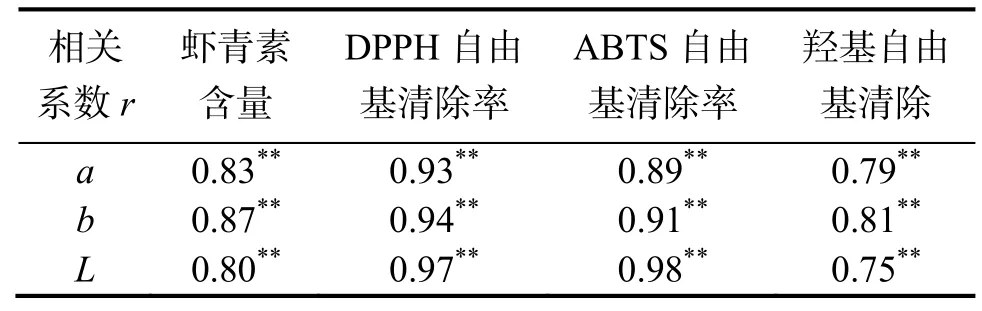
表1 颜色值、虾青素及抗氧化性的相关系数Table 1 Correlation coefficient between color value and astaxanthin and antioxidant properties
虾青素隶属于萜烯类不饱和化合物,其结构中包含共轭双键的长链具有一定的显色规律,随着双键数量的增多,其吸收光谱的波长向着可见光区不断移动,长链的两端存在羟基和羰基官能团,具有更高的电子效应,可以吸引自由基或向自由基提供电子,具有强大的抗氧化能力[28]。加热后由于含有共轭双键的长链被破坏,而引起光密度变化,被用作各种类胡萝卜素捕获自由基的方法[29]。表1 中颜色变化L、a、b值与虾青素变化的相关性均达0.8以上,说明对虾加热变色与虾青素的含量相关,同时对虾中还有其他色素类物质可能也会对颜色产生影响[30]。本研究发现虾肉中虾青素含量较少,但加热后仍保留较强的抗氧化活性,可通过加热时间和加热过程中对虾颜色的变化判断其抗氧化作用。
3 结论
本研究结果表明CVS 与色差仪测定的虾肉色值呈线性相关,说明使用CVS 对虾颜色进行连续化测定是可行的,本研究建立的CVS 法更为简单和方便,可以直接通过photoshop 软件进行颜色值转换,操作简单更易普及,为对虾品质的无损检测、连续化检测方法的开发提供了理论依据;在300 s前L、a、b值均随加热时间的增加而增加,呈上升趋势;虾青素在加热时间为300 s 时含量最高;随着加热时间的延长,DPPH 自由基的清除能力越好,羟基自由基清除率和ABTS 自由基清除率呈先增大后趋于平稳的趋势;在300 s 内,颜色值与虾青素、自由基清除率显著相关,均呈上升趋势,说明加热初期可以通过颜色判断凡纳滨对虾虾青素及抗氧化活性变化。
