水解单宁对副溶血弧菌感染凡纳滨对虾血液及血细胞免疫指标的影响
2021-06-12朱旭枫邓秋霞李广丽朱春华
朱旭枫,邓秋霞,郭 慧,李广丽,2,3,朱春华,2,3,4
(1.广东海洋大学水产学院// 2.广东省名特优鱼类生殖调控与繁育工程技术研究中心// 3.广东省海水养殖生物育种工程实验室//4.广东省水产经济动物病原生物学及流行病学重点实验室,广东 湛江 524088)
凡纳滨对虾(Litopenaeus vannamei)具有生长速度快、抗病力强、出肉率高、肉质可口和蛋白含量高等特点[1],是我国重要养殖虾种,2019 年其养殖产量占全国对虾养殖产量的85%[2]。由于消费者需求日益扩大,凡纳滨对虾养殖模式从粗放型转向集约型,但高密度的养殖模式导致弧菌病频发,造成巨大的经济损失,限制了凡纳滨对虾养殖的发展[3-4]。副溶血弧菌(Vibrio parahaemolyticus)是弧菌科的革兰阴性菌,常寄生于鱼、虾、蟹、贝类和海藻等海产品,是造成对虾早期死亡综合征、对虾急性肝胰腺坏死综合征的病原体[5-6]。近年来,研究人员不断地寻找病害解决方案,降低疾病造成的损失[7]。
对虾养殖中防治病害常见的做法是使用抗生素,但长期添加抗生素不仅会通过食物链富集,危害人类的健康,也破坏水产养殖环境中的微生物结构,甚至使病原体产生耐药性[8]。因此我国正不断限制抗生素在畜牧业中的使用,寻找有效的抗生素替代物防治病害[9]。有研究报道,水解单宁(Hydrolyzable Tannins,HTs)在替代抗生素方面有巨大的潜力[10]。
水解单宁在多种植物中存在,分子质量500~3000 u,具有较强收敛、抗菌、抗氧化、抗炎等生物活性,在皮革、医药、食品、日用化学等领域应用广泛[10]。近年来,研究发现在如鸡、猪和兔等畜禽动物的饲料中添加低浓度的水解单宁可以提高动物的生长性能和保护肠道健康[11-14]。然而,目前水解单宁在水产动物中的研究较少。
本研究通过流式细胞仪测定感染副溶血弧菌24 h 后对虾血细胞的细胞凋亡率、活性氧(Reactive oxygen species,ROS)含量、一氧化氮(Nitric oxide,NO)含量和酯酶活力,并且测定免疫相关的酶活性和基因表达水平,综合分析饲料中添加水解单宁对凡纳滨对虾感染副溶血弧菌后血液及血细胞的影响,为今后水解单宁在对虾养殖中的应用提供研究基础。
1 材料和方法
1.1 饲料制备
本实验基础饲料根据凡纳滨对虾的生长需求制备,饲料成分和营养水平参照Prabu 等[15]。在饲料中按质量分数0%(对照组,CK)、0.05%、0.10%、0.15%、0.20%等5 个浓度梯度添加水解单宁(斯洛文尼亚Tanin 公司提供)。实验所用饲料按照要求制备完成后晾干,用塑料袋封装后放入4 ℃的冰箱储存备用。
1.2 饲养管理
凡纳滨对虾由广东海洋大学东海岛海洋生物研究基地提供。进行为期60 d 的养殖后从5 个组中分别挑选规格大小统一均匀、活泼、附肢完整、无明显损伤或病害、无附着生物的健康个体,每组10尾对虾,设3 个重复,将对虾运送到广东海洋大学水产楼实验室暂养2 周。暂养期间仍然用不同浓度的水解单宁饲料进行投喂,每天投喂2 次(分别于8:00、18:00 进行投喂),投喂后0.5~ 1 h 观察摄食剩料情况,根据凡纳滨对虾的摄食和生长情况调整饲料的投喂量。每天进行一次水质检测,定期进行排换水,检测并记录水中的溶氧、水温、pH 的变化,每天采取换水操作。暂养期间不断充氧,溶氧≥ 6 mg/L,水温为27~ 29 ℃,pH 为8.0 ± 0.2,自然光照。空腹24 h 后注射副溶血弧菌进行攻毒实验。
1.3 弧菌的制备
本实验所用副溶血弧菌(V.parahaemolyticus)由广东省水产经济动物病原生物学及流行病学重点实验室提供。首先配制100 mL 的大豆蛋白胨培养基(TSB,质量分数2% NaCl),经121 ℃灭菌后冷却至室温,接种-20 ℃保存的副溶血弧菌,于28 ℃、120 r/min 条件下震荡培养22 h,进行第一次活化;第二次用250 mL 的培养基进行培养,方法同第一次。接着4 ℃、7 000 r/min 离心10 min,弃上清液,加磷酸盐缓冲液(PBS)重悬细菌细胞。预实验利用细菌平板计数法获得合适的浓度。参考Kiran 等[16]的实验,攻毒时间为24 h。攻毒用菌浓度为2.5×108CFU·mL-1,注射量为0.2 mL,注射部位为凡纳滨对虾第三腹节。
1.4 样品采集
注射副溶血弧菌24 h 后,使用一次性无菌注射器(1 mL),内含预冷的抗凝剂(葡萄糖20.5 g·L-1,柠檬酸钠8 g·L-1,氯化钠4.2 g·L-1,pH 7.5),与血淋巴体积比为1∶1。在围心腔处抽取其血淋巴部分于4 ℃放置,用于流式细胞仪FAC Verse(Becton Dickinson,USA)检测,通过Cell Quest(Becton Dickinson Immunocytometry Systems,San Jose,CA)软件进行数据获取和分析;另一部分提取RNA 用于TLR 和HSP70 基因表达的测定。余下的血淋巴放至高速冷冻离心机(Eppendorf,德国)进行4 ℃离心(3 500 r/min)10 min,取上清液于1.5 mL 的离心管中,保存在-80 ℃超低温冰箱,用于非特异性免疫、抗氧化相关酶活性的测定。
1.5 非特异性免疫酶和抗氧化相关酶活性的测定
血清的碱性磷酸酶(Alkaline phosphatase,AKP)、酸性磷酸酶(Acid phosphatase,ACP)、超氧化物歧化酶(Superoxide dismutase,SOD)、总抗氧化能力(Total antioxidant capacity,T-AOC)和溶菌酶(Lysozyme,LZM)活性检测均使用商业试剂盒(南京建成生物工程研究所)。AKP 和ACP 活性采用微量酶标法测定,SOD 活性采用WST-1 法测定,T-AOC 采用FRAP 法测定,LZM 活性采用比浊法测定。测定操作过程严格遵守试剂盒说明书进行,确保测量结果的准确性。
1.6 总RNA 的提取及cDNA 的合成和实时荧光定量PCR(Q-PCR)
使用TRIzol(Invitrogen,美国)法进行凡纳滨对虾血淋巴总RNA 的提取,实验操作严格按照试剂说明书进行。将总RNA 用15 mg/mL 的琼脂糖凝胶进行电泳操作,之后在全自动数码凝胶图像分析系统(Tanon,上海)观察其完整性。用Nano Drop 2000c(Thermo Fisher Scientific,美国)微量分光光度计检测总RNA 浓度。总RNA 样品保存于-80 ℃超低温冰箱用于后续实验。使用反转录酶试剂盒(Takara,日本)对所提取的血淋巴总RNA 反转录成cDNA,实验操作步骤严格参照试剂盒说明书进行。反转录所得产物用超纯水稀释10 倍后用于实时荧光定量PCR。
1.6.1引物设计 内参基因β-actin参照文献[17],Toll 样受体(Toll-like receptors,TLR)和热休克蛋白70(Heat shock protein70,HSP70)基因引物参照文献[18],引物均由上海生工生物工程股份有限公司合成,引物序列见表1。

表1 Q-PCR 所用引物序列Table 1 Primers sequences for Quantitative Real-time PCR
1.6.2实时荧光定量PCR 检测分析 按照SYBR Green qPCR Mix(with ROX)试剂盒(广州东盛生物科技有限公司)说明书进行实验操作,反应体系(10 μL):DNA 模板1 μL,上游引物1 μL,下游引物1 μL,超纯水ddH2O 2 μL,2×Power Green qPCR Mix 5 μL。
实验仪器为LightCycler480 荧光定量PCR 仪。三种目的基因qPCR 反应程序如下:94 ℃预变性3 min;下面三步循环40 次:95 ℃ 15 s,58 ℃ 15 s,72 ℃ 20 s。基因结果使用2-ΔΔCt法分析计算表达水平[19]。
利用SPSS 18.0 对实验数据进行单因素方差分析(one-way ANOVA),若组间数据差异显著,则采用Duncan 多重比较检验,显著性水平设为0.05。若P< 0.05 则认为组内数据差异显著,数据均以平均值±标准差(mean ± S.D.)来表示。使用 Excel 2016 对数据进行分析处理与作图。
2 结果与分析
2.1 血细胞流式指标
注射副溶血弧菌24 h 后,实验组凡纳滨对虾的血细胞凋亡率、ROS 含量、NO 含量、酯酶活性与对照组都有显著性差异。结果显示,添加水解单宁的凡纳滨对虾血细胞凋亡率均显著低于对照组(P<0.05),其中0.10%和0.15%组的凋亡率最低,其次为0.05%组,0.20%组(图1_A)。ROS 含量呈现逐级递减趋势,对照组含量显著高于实验组(P<0.05),是0.05%组含量的两倍,0.15%和0.20%组的含量最低(图1_B)。实验组的NO 含量均显著低于对照组(P< 0.05),0.10%组的NO 含量最低,其次为0.15%、0.05%和0.20%组(图1_C)。0.10%组的酯酶活性最大,同时其他实验组都显著高于对照组(P< 0.05)(图1_D)。
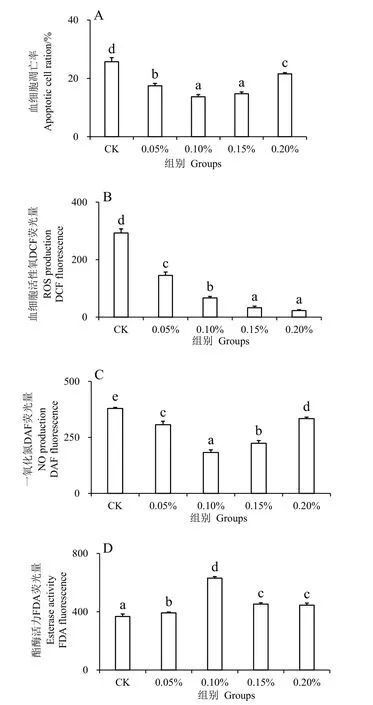
图1 水解单宁对凡纳滨对虾经副溶血弧菌胁迫后血细胞凋亡率、ROS 含量、NO 含量、酯酶活性的影响Fig.1 Effects of HTs on Apoptotic cell ratio,ROS content,NO content and esterase activity of Litopenaeus vannamei challenged by Vibrio parahaemolyticus
2.2 血清非特异性免疫酶活性
图2 为水解单宁对凡纳滨对虾经副溶血弧菌胁迫后血清非特异性免疫酶活性的影响。AKP,ACP和LZM 活性反映机体非特异性免疫能力。结果发现,在注射副溶血弧菌24 h 后,与对照组相比,实验组血清的AKP、ACP 和LZM 活性显著增高(P<0.05)。并且0.15%组凡纳滨对虾血清的AKP(图2_A)和ACP(图2_B)达到最大值,在0.10%组凡纳滨对虾血清的LZM(图2_C)达到最大值,表明水解单宁可有效提高凡纳滨对虾血清的非特异性免疫酶活力。
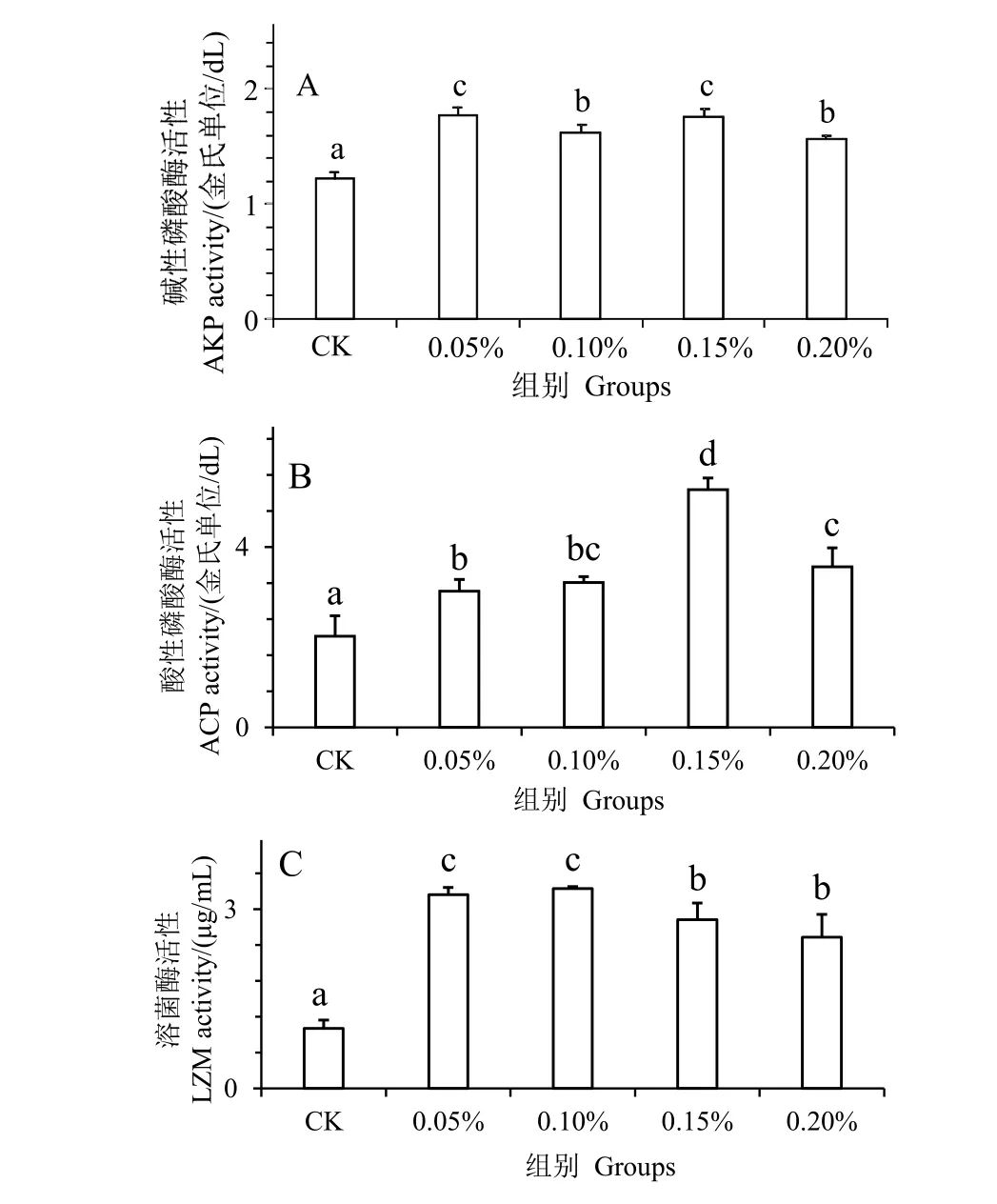
图2 水解单宁对凡纳滨对虾经副溶血弧菌胁迫后血清非特异性免疫酶活性的影响Fig.2 Effects of HTs on non-specific immunity enzymatic activities in the serum of Litopenaeus vannamei challenged by Vibrio parahaemolyticus
2.3 血清抗氧化相关酶活性
图3 为水解单宁对凡纳滨对虾经副溶血弧菌胁迫后血清抗氧化酶活性的影响。SOD 和T-AOC 是重要的抗氧化酶。在注射副溶血弧菌24 h 后的实验发现,与对照组相比,实验组血清的SOD 和T-AOC活性显著增高(P< 0.05)。并且在0.15%组,凡纳滨对虾血清的SOD(图3_A)达到最大值,实验组各组之间的T-AOC 活性无显著差异(P> 0.05)(图3_B),均显著高于对照组(P< 0.05)。结果表明,水解单宁可有效提高凡纳滨对虾血清的抗氧化酶活力,增强凡纳滨对虾对弧菌的抗性。
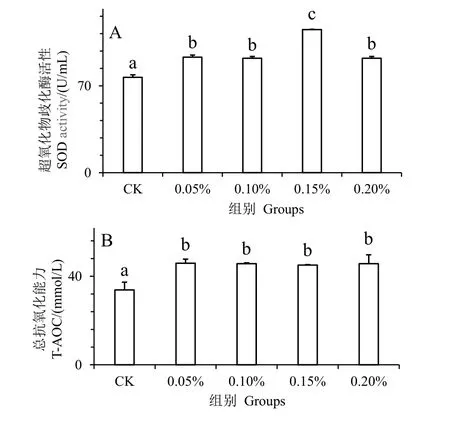
图3 水解单宁对凡纳滨对虾经副溶血弧菌胁迫后血清抗氧化酶活性的影响Fig.3 Effects of HTs on antioxidant capacity enzymatic activities in the serum of Litopenaeus vannamei challenged by Vibrio parahaemolyticus
2.4 TLR 和HSP70 的基因表达
图4 为TLR 和HSP70 基因相对表达水平。TLR和HSP70 与机体免疫作用有关。本实验对凡纳滨对虾注射副溶血弧菌24 h 后,实验组TLR 和HSP70 基因相对表达水平显著高于对照组(P< 0.05),并且0.15%组的表达水平最高,分别是对照组的18 倍和9倍,说明水解单宁可促进TLR 和HSP70 基因的表达。
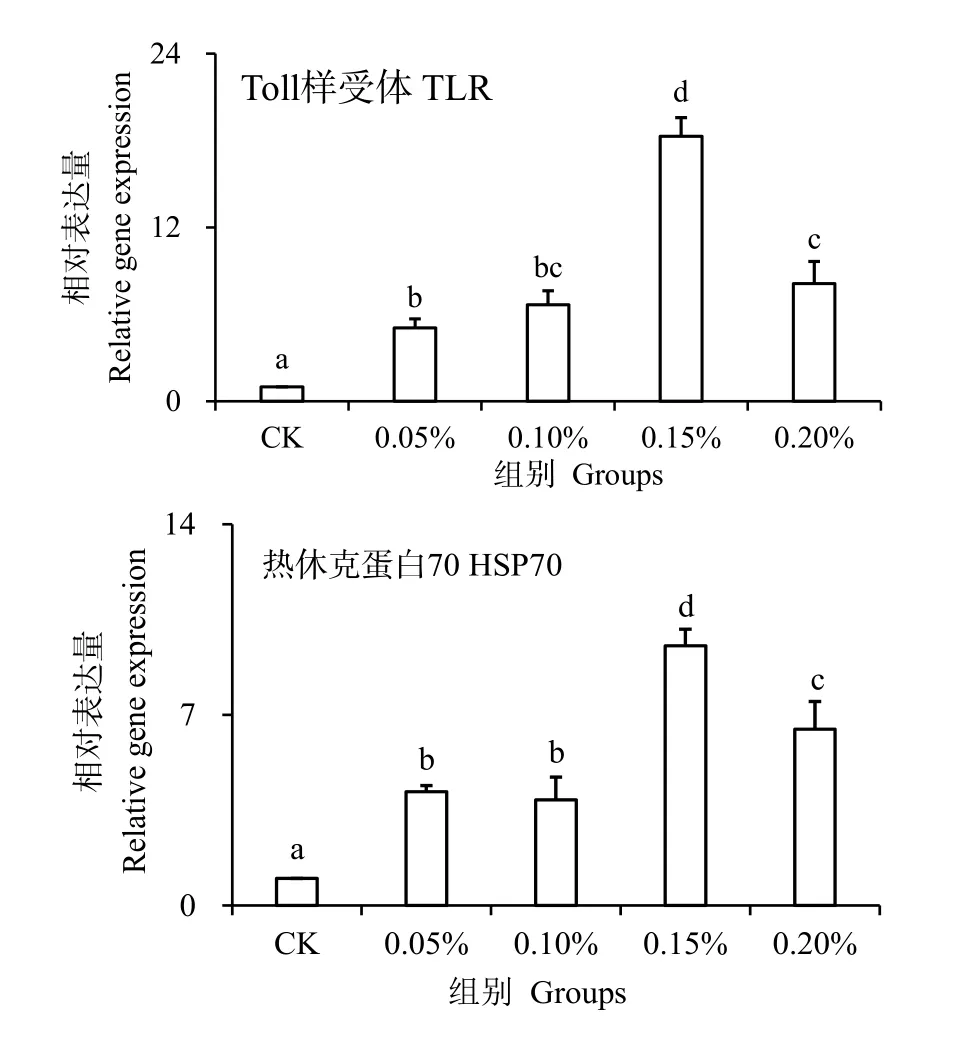
图4 水解单宁对经副溶血弧菌胁迫后凡纳滨对虾TLR 和HSP70 基因表达水平的影响Fig.4 Effects of HTs on relative mRNA expression levels of TLR and HSP70 genes in the hemocyte of Litopenaeus vannamei challenged by Vibrio parahaemolyticus
3 讨论
副溶血弧菌会感染鱼、虾、贝等养殖水产动物,造成严重疾病,给养殖户带来巨大的经济损失。通过Zhu 等[20]的实验结果,发现凡纳滨对虾在感染副溶血弧菌16 h 后,死亡率趋于平稳,24 h 后饲料添加0.10%~ 0.20%水解单宁的实验组存活率显著高于对照组,说明水解单宁能够提高凡纳滨对虾对副溶血弧菌的抗性。
甲壳类动物的免疫系统不同于脊椎动物,主要依靠非特异性免疫识别和清除入侵异物,保护机体健康[21]。AKP、ACP 和LZM 是反映凡纳滨对虾非特异性免疫的重要指标[22]。AKP 和ACP 是存在于甲壳动物溶酶体酶中重要的水解酶类,它们形成的水解酶体系可杀灭带有磷酸酯的异物[23]。AKP 和ACP 在磷酸基团转移过程中发挥重要作用,不仅参与DNA 合成与蛋白质分泌,还与脂的代谢有关[24]。LZM 是一种天然抗感染且具有杀菌作用的碱性酶,在甲壳动物体内广泛存在。通过水解细菌的多糖,引起细胞壁破裂内容物逸出而使细菌溶解,达到免疫预防作用[25]。本研究结果显示,在副溶血弧菌胁迫下,实验组对虾血清的AKP、ACP 和LZM 活力均显著高于对照组,表明水解单宁有效提高对虾非特异性免疫能力。近年来,甲壳类动物的TLR 基因受到越来越多关注[26]。有研究显示,TLR 通路机制在免疫中发挥重要作用[18],可识别相关的病原相关分子模式,是参与病毒或弧菌引起对虾免疫调控的一类重要蛋白质分子,因此机体受到病原体等外来刺激之后,TLR 便会激活凡纳滨对虾的免疫应答[27]。实验组TLR 基因表达水平显著高于对照组,表明水解单宁可在一定程度上提高凡纳滨对虾非特异性免疫能力。HSP70 可增强应激细胞耐受力,还在抗细胞凋亡、抗氧化和免疫等反应中起重要作用[28]。Gullo 等[29]研究发现,当细胞内HSP70 基因表达水平升高时,氧化应激产生的H2O2对细胞膜的损伤减小,这与本研究结果一致。相对于对照组,实验组的HSP70 基因表达水平均显著增高,表明水解单宁可提高凡纳滨对虾的抗性。
血细胞在甲壳动物的细胞免疫和体液免疫中起着重要作用[30]。血细胞损伤会造成机体免疫功能下降[31]。据报道,副溶血弧菌能破坏对虾机体免疫防御系统[32]。由于对虾受到胁迫会产生氧化应激反应,影响细胞吞噬活性等,血细胞的细胞凋亡率、ROS 含量、NO 含量和酯酶活性会因此发生变化[33-35],故这些指标的变化可作为机体免疫状态的判断依据。本研究发现,实验组的细胞凋亡率显著低于对照组,说明当对虾受到副溶血弧菌胁迫时,水解单宁能够增强对虾机体免疫能力,减少对虾体内血细胞损伤。ROS 是细胞吞噬过程中呼吸暴发现象产生的一种高活性化学物质。正常情况下,ROS 是机体新陈代谢的副产物,具有杀灭微生物和恶性细胞的作用。虽然ROS 具有强大杀菌作用,但是持续不断的外界刺激会打破机体内ROS 平衡,ROS 水平会急剧增加,对细胞结构造成损害。已经有许多研究报道各种非生物因素胁迫会导致动物体内产生过量ROS[36-37]。卢芷程等[38]研究发现,溶藻弧菌感染凡纳滨对虾会造成体内血细胞ROS 不断累积,说明弧菌的感染也会影响机体内ROS 水平。本研究结果显示,水解单宁可有效降低在副溶血弧菌胁迫下凡纳滨对虾血清中ROS 的累积。NO 是一种重要的第二信使分子,与ROS 相似,低浓度的NO 和ROS 对机体是有益的,能够抑制细胞的凋亡,正常情况下NO 在机体中处于平衡状态,参与机体免疫相关的生理过程,还能通过与氧代谢产生的超氧自由基结合生成过氧化一氮杀灭病原体[39]。刘文珍等[40]研究表明,NO 系统可以杀灭凡纳滨对虾体内入侵的溶藻弧菌,但是在弧菌等刺激下,机体会不断累积NO,高浓度的NO 会扰乱对虾的抗氧化系统,诱导细胞凋亡[41-42]。本研究结果发现,实验组NO水平相对于对照组均较低,即水解单宁可有效降低在副溶血弧菌胁迫下凡纳滨对虾血清中NO 的累积。酯酶是溶酶体酶类的一种,广泛存在于各种细胞内,在细胞降解致病菌和清除外源性物质中起着重要作用[43],其活力的大小也反映细胞的免疫能力[44]。郭慧等[34]研究发现,细胞的酯酶活性下降与细胞活性下降有关,且会导致细胞凋亡。对水产动物环境胁迫的研究[45-46]显示,甲壳动物细胞的酯酶活性会显著被抑制。本研究结果发现,相对于对照组,水解单宁显著激发凡纳滨对虾细胞内的酯酶活性,以应对副溶血弧菌的胁迫。
抗氧化酶防御系统在清除或中和ROS 的过程中起着关键作用,并最终维持生物系统的稳态[47]。SOD 和T-AOC 是生物体中反映机体抗氧化能力的重要指标,可清除体内产生的活性氧,阻止由活性氧诱导产生的氧化应激[22],其活性变化可反映对虾健康状况。一些研究[38,40]发现,弧菌会造成对虾体内氧自由基系统异常,从而造成机体氧化损伤。目前,水解单宁在水生动物中的研究还较少,在畜禽饲料中的应用研究较多,水解单宁提高机体抗氧化能力也得到广泛的认可。庞树坤[48]研究发现,在饲料中添加水解单宁能够清除育肥猪体内的氧自由基,提高育肥猪的抗氧化酶活性及减少体内氧化应激造成的损伤。Liu 等[49]实验表明,在饲料中添加水解单宁可提高断奶仔猪血清和肠黏膜的抗氧化能力以及机体免疫能力。Starčević 等[50]研究发现,饲料中添加水解单宁可提高1~ 28 日龄仔鸡的抗氧化能力。陈赛娟等[51]研究发现,饲料中添加0.10%、0.15%和0.20%的水解单宁能促进生长獭兔免疫器官的发育,提高机体的抗氧化能力。刘华伟[52]研究发现,饲料中添加水解单宁可显著提高肉兔血清中SOD 活性。本研究结果表明,饲料中添加水解单宁可提高凡纳滨对虾的抗氧化能力,维持机体氧化还原平衡。
4 结 论
本研究发现,饲料中添加水解单宁可提高凡纳滨对虾血细胞的抗氧化能力,增强非特异性免疫能力,从而提高抗副溶血弧菌感染的能力;可有效降低血细胞ROS 和NO 的累积,提高酯酶活性,减少细胞凋亡。本研究对应用水解单宁在对虾养殖中有一定的指导意义,但水解单宁的作用机制仍需要进一步探索。
