酵母培养物对珍珠龙胆石斑鱼生长性能、肠道形态、免疫功能和抗病力的影响
2021-06-12刘泓宇李立贤AYIKUStephen谭北平董晓慧迟淑艳杨奇慧周文豪
刘泓宇,李立贤,AYIKU Stephen,唐 泽,范 炜,谭北平,董晓慧,迟淑艳,杨奇慧,章 双,周文豪
(1.广东海洋大学水产动物营养与饲料实验室,广东 湛江 524088;2.农业部华南水产与畜禽饲料重点实验室,广东 湛江 524088;3.广东省水产动物精准营养与高效饲料工程技术研究中心,广东 湛江 524088;4.北京英惠尔生物科技有限公司,北京 100081)
珍珠龙胆石斑鱼是鞍带石斑鱼 (Epinephelus lanceolatus,) 与棕点石斑鱼 (Epinephelus fuscoguttatus,♀) 的杂交种[1]。由于其饲料系数低,生长速度快,适口性好,市场价值高,许多亚洲国家均有养殖[2]。我国南方各省市石斑鱼养殖已形成一定规模[3],然而集约化养殖的石斑鱼易暴发传染病,给石斑鱼养殖业造成重大的经济损失[4-6]。
酵母水解物在水产饲料中多以酵母粉(酵母细胞失活后形成的蛋白类物质)形式的单细胞蛋白,未进行细胞壁裂解和酶解等深加工处理,未能充分释放酵母细胞的内含物质,导致其功能性物质的不能发挥到最大功效。酵母培养物是酵母菌在特定工艺条件下经特定培养基厌氧发酵的微生态制品[7],含酵母细胞及其代谢产物,以及变性培养基。酵母细胞壁的β-葡聚糖和甘露寡糖(MOS)成分有促进免疫的作用,其中β-葡聚糖成分可激活巨噬细胞,使巨噬细胞释放白细胞介素和细胞因子等免疫球蛋白,以帮助水生动物抵御各种病原体[8]。酵母产物在鱼类养殖业中潜在应用优势日益增大,利用酵母产物改善鱼类的生长和免疫反应已成为近年来的研究热点。何远法等[9-10]发现,酵母培养物可显著提高凡纳滨对虾(Litopenaeus vannamei)的生长性能和非特异性免疫力,并改善凡纳滨对虾肠道菌群多样性。酵母培养物中的甘露寡糖可提高豹星斑(Mycteroperca rosacea)生长性能、免疫力和抗病性[11]。雷宇杰等[12]研究发现,饲料中添加酵母培养物可显著提高斑点叉尾鮰(Ictalurus punetaus)生长性能及饲料养分表观消化率。草鱼(Ctenopharyngodon idella)饲料中添加质量分数12%的酵母培养物可调节其肠道微生物区系,显著提高氨基酸、脂肪代谢及消化能力[13]。
目前,酵母蛋白饲料研究中一般采用高蛋白含量固体发酵培养法,通过在发酵底物中添加非蛋白氮的方式来提高饲料蛋白质的含量。已有酵母培养物对珍珠龙胆石斑鱼的生长、血清生化指标、抗氧化能力影响等研究[14-16],本研究在此基础上评估饲料中不同发酵底物 [含非蛋白氮(L)和不含非蛋白氮(N)] 酵母培养物对珍珠龙胆石斑鱼生长性能、免疫应答和肠道形态及抗哈维氏弧菌感染能力的影响,为珍珠龙胆石斑鱼健康养殖研究及环保节能饲料开发提供科学依据。
1 材料和方法
1.1 实验材料
两种不同发酵底物的酵母培养物(L,发酵底物含非蛋白氮,蛋白质量分数55%;N,发酵底物不含非蛋白氮,蛋白质量分数50%,其他成分氨基酸、酸溶蛋白、甘露聚糖、核苷酸、活性肽基本一致)由北京英惠尔生物技术有限公司提供。实验饲料中矿物质预混料购自广东湛江粤佳饲料有限公司,其他原料购自广东湛江市海宝饲料厂。所有原料粉碎后过孔径250 μm 的筛,按照配方准确称取,混合均匀,放入V 型立式混合机中混合,缓慢加入所配饲料质量25%~30%的水,混匀。用F-26 型双螺杆挤条机 (华南理工大学) 加工成粒径为2.5 mm的颗粒饲料,室温下风干至水分质量分数约10%,用封口袋分装,于-20 ℃冰箱储存备用。
实验用珍珠龙胆石斑鱼为湛江某养殖孵化场遗传背景相同、无病原体的鱼苗。实验前在室内用玻璃钢养殖桶暂养2 周,期间投喂商业饲料(蛋白质量分数50%,脂肪质量分数11%左右)。攻毒用哈维弧菌(Vibrio harveyi)分离自广东省海洋大学水产动物病原生物学与流行病学省级重点实验室的患病珍珠龙胆石斑鱼,在-80 ℃下冻存于含体积分数25%胰蛋白酶的大豆蛋白胨中。
1.2 实验设计
配制5 种蛋白质质量分数为50%、脂肪质量分数为11%的等氮等脂饲料,对照组(C0)含质量分数34%的鱼粉,试验组L1 和L2 分别添加质量分数2%、4%的酵母培养物L,N1 和N2 组分别添加质量分数2%、4%的酵母培养物N,分别记为C0(0%)、L1(2%)、L2(4%)、N1(2%)和N2(4%)。实验饲料成分及营养水平见表1。
实验鱼停饲12 h 后,取体质量为(17.56±0.02)g 的幼鱼450 尾,随机放入15 个0.5 m3玻璃钢养殖桶,每桶30 尾。每天9:00、17:00 按体质量5%~ 8%饱食投喂。每天早上投喂前,各桶更换60%的海水。观察饲料摄入量、石斑鱼死亡率和水质参数。养殖水温(28.0±2.0)℃,pH 8.1±0.1,盐度28~ 31,自然光周期,溶解氧6~ 8 mg·L-1。
1.3 样本采集
养殖实验结束后,停饲24 h。记录每个养殖桶中鱼的数量和体质量。每个养殖桶随机取鱼11 尾,2 尾冻存在-20 ℃用于体成分分析;6 尾样本尾静脉中抽取血样,在4 ℃静置12 h 后,以3 500 r/min 离心10 min,上清液于-80 ℃下保存,用于酶活性测定;3 尾样本于无菌条件下剖取中肠 (0.8~ 1.2 cm),用体积分数10%甲醛溶液固定,用于组织学分析。
1.4 生长指标分析
实验8 周后,分别统计各实验组和对照组的投喂饲料总量。计算存活率、增重率 (WGR)、特定生长率 (SGR) 和饲料系数 (FCR):

mf,平均终末体质量 (g);mi,初始体质量(g);t,饲养时间 (d);mt,实验期间投入饲料量 (g)。
1.5 饲料和全鱼的化学成分分析
使用AOAC (Association of Official Analytical Chemists,2005)[17]标准方法检测配方饲料成分和鱼体成分。在105 ℃的烘箱干燥样品至质量恒定。采用凯氏定氮仪(FOSS KT8400)测定蛋白含量。在550 ℃的马弗炉中灼烧2 g 样品4 h,测定灰分含量。使用脂肪测定仪(ANKOM XT15)测定粗脂肪含量。
1.6 血清免疫分析
使用南京建成公司的试剂盒用全波长酶标仪(ThermoFisher Multiskan GO)测定血清葡萄糖(SOD)、丙二醛 (MDA)、酸性磷酸酶 (ACP)、天冬氨酸转氨酶 (AST)、丙氨酸转氨酶 (ALT)、碱性磷酸酶 (AKP)、溶菌酶 (LZM) 和免疫球蛋白(Glu)、总蛋白(TP)、甘油三酯 (TG)、胆固醇(CHO)、过氧化氢酶 (CAT)、超氧化物歧化酶(IgM)。测定过程中严格遵循试剂盒的操作方法。

表1 实验饲料组成及营养水平(干基)Table 1 Formulation and proximate composition of experimental diets (dry matter) %
1.7 肠道组织学分析
取肠道组织,切片,厚度为5 μm,苏木精-伊红染色,在显微镜 (Olympus,model BX51,Serial number:9K18395,Tokyo,Japan) 下观察和拍照,使用Image-Pro Plus 6.3 (Media Cybernetics,Inc.,Rockville,USA) 软件,测定放大100 倍时肠绒毛高度 (VH)、绒毛宽度 (VW) 和肌肉厚度 (MT)。每个切片取12 个测量值平均值。确定添加酵母培养物的饲料对鱼类肠道形态的影响。
1.8 攻毒实验
将冻存的哈维氏弧菌置于装有LuriaBertani(LB) 培养液的250 mL 平底烧瓶内,在培养箱中以37 ℃、180 r/min 条件振荡培养20 h。以4 ℃、8 000 r/min 离心10 min,弃去上清液,用无菌磷酸盐缓冲溶液 (PBS) 冲洗2 次。根据预实验,3 d半致死浓度为3.58 × 105cfu/mL,因而用PBS 连续稀释至3.58 × 105cfu/mL。经过56 d 的饲养实验,从每组中随机取鱼12 尾进行攻毒实验,每尾鱼注射200 μL 细菌悬浮液。另外从每组中取12 尾,分别注射同剂量的生理盐水作为空白对照组(NC)。各组攻毒期间仍投喂相应的实验饲料。注射12 h后随机取鱼2 尾,采集血液样本。样品以4 ℃、3 500 r/min 的条件离心10 min。上清液于-80 ℃条件下保存,用于酸性磷酸酶 (ACP)、碱性磷酸酶(AKP)、溶菌酶(LZM)和免疫球蛋白M(IgM)的活性测定。记录攻毒168 h 后各组的存活率。
1.9 数据统计
实验结果以“平均值±标准误”(mean±SEM)表示,采用SPSS 21.0 软件进行单因素方差分析和Turkey 检验,存活率数据则先进行反正弦平方根转换再进行统计分析,以P<0.05 表示差异显著。
2 结果
2.1 生长、饲料利用率和存活率
表2 表明,与对照组相比,实验组的生长性能有增加趋势或显著增加,其中N1 和N2 组的终末体质量(FW)、增重率和特定生长率最高(P< 0.05)。实验组饲料系数有降低趋势或显著降低,N1 和N2组饲料系数显著降低(P< 0.05)。存活率分析结果显示,L2、N1、N2 组存活率显著提高(P< 0.05)。
表2 添加酵母培养物对珍珠龙胆石斑鱼生长性能的影响Table 2 Effects of dietary yeast culture supplementation on the growth of Epinephelus fuscoguttatus♀×E.lanceolatu

表2 添加酵母培养物对珍珠龙胆石斑鱼生长性能的影响Table 2 Effects of dietary yeast culture supplementation on the growth of Epinephelus fuscoguttatus♀×E.lanceolatu
注:同列数据肩标凡含一个相同字母表示组间无显著差异(P>0.05);1) 反正弦平方根转换值。Note:The data in same column with a same letter mean no significant difference between them at level of 0.05;1) arcsine of square root of percentage.
2.2 全鱼体常规成分
表3 可见,与对照组相比,饲喂酵母培养物饲料后,L1、L2 组粗蛋白显著升高,N1、N2 组的干物质、粗蛋白、灰分含量(干基)均有显著提高(P< 0.05)。N2 实验组干物质、粗蛋白、灰分含量显著提高,而N1 组粗脂肪含量显著增加(P< 0.05)。
表3 酵母培养物对珍珠龙胆石斑鱼全鱼常规成分的影响Table 3 Effects of dietary yeast culture supplementation on whole body composition of Epinephelus fuscoguttatus♀ ×E.lanceolatu
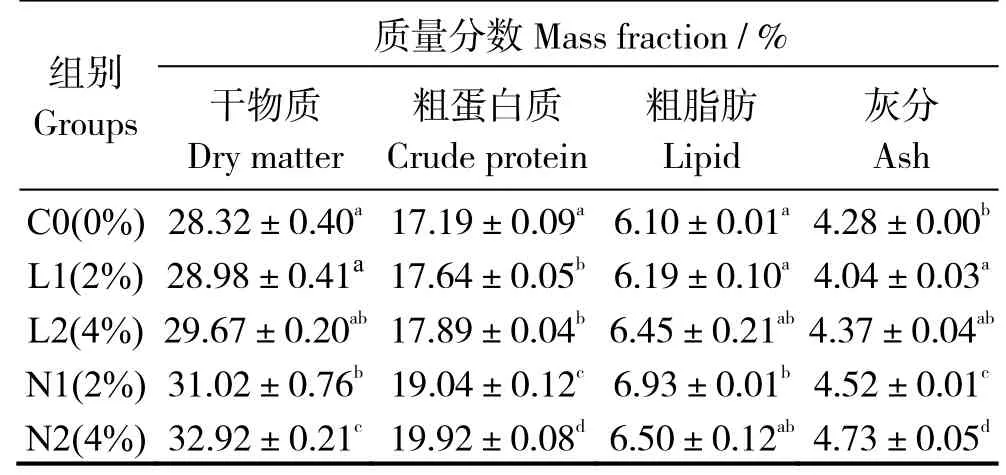
表3 酵母培养物对珍珠龙胆石斑鱼全鱼常规成分的影响Table 3 Effects of dietary yeast culture supplementation on whole body composition of Epinephelus fuscoguttatus♀ ×E.lanceolatu
注:同列数据肩标凡含一个相同字母表示组间无显著差异(P>0.05)。Note:The data in same column with a same letter mean no significant difference between groups at level of 0.05.
2.3 肠道消化酶
表4 可见,与对照组C0 相比,各实验组胰蛋白酶、脂肪酶和淀粉酶均显著升高(P< 0.05),L2组胰蛋白酶、脂肪酶、淀粉酶平均值最高,显著高于C0、N2 组(P< 0.05)。
表4 酵母培养物对珍珠龙胆石斑鱼肠道消化酶活性的影响Table 4 Effects of dietary yeast culture supplementation on the gastrointestinal digestive enzyme activities of Epinephelus fuscoguttatus♀×E.lanceolatuU/mg

表4 酵母培养物对珍珠龙胆石斑鱼肠道消化酶活性的影响Table 4 Effects of dietary yeast culture supplementation on the gastrointestinal digestive enzyme activities of Epinephelus fuscoguttatus♀×E.lanceolatuU/mg
注:同列数据肩标凡含一个相同字母表示组间无显著差异(P>0.05)。Note:The data in same column with a same letter mean no significant difference between groups at level of 0.05.
2.4 血清生化指标
表5 可见,在饲料中添加酵母培养物可显著增加血清的总蛋白(TP)水平(P< 0.05)。N2 组TP含量最高(P< 0.05)。与对照组相比,各实验组血清葡萄糖含量呈下降趋势,N2 组平均值最低,与对照组有显著差异(P< 0.05)。与对照组相比,除N1组甘油三酯(TG)显著升高外,各组间TG 及胆固醇差异无统计学意义(P> 0.05)。各组间CHO 差异无统计学意义(P> 0.05)。N2 组的丙氨酸转氨酶和天冬氨酸转氨酶活性显著低于对照组(P< 0.05)。
表5 添加酵母培养物对珍珠龙胆石斑鱼血清生化指标的影响Table 5 Effects of dietary yeast culture supplementation on hematological indices of Epinephelus fuscoguttatus♀×E.lanceolatu

表5 添加酵母培养物对珍珠龙胆石斑鱼血清生化指标的影响Table 5 Effects of dietary yeast culture supplementation on hematological indices of Epinephelus fuscoguttatus♀×E.lanceolatu
注:数据肩标凡含一个相同字母表示组间无显著差异(P>0.05)。Note:The data in same column with a same letter mean no significant difference between groups at level of 0.05.
2.5 血清抗氧化指标
图1 可见,攻毒12 h 后,N2 组血清SOD 活性显著高于对照组(P< 0.05),但与L1、L2 和N1 组差异不显著(P>0.05)。N1 和N2 组CAT 含量(图1_B)在攻毒12 h 后显著高于其余三组(P< 0.05)。在攻毒前和攻毒12 h 后,酵母培养物处理组MDA 活性(图1_C)显著低于对照组 (P< 0.05)。攻毒12 h 后,N2组MDA 活性最低,显著低于其余各组(P<0.05)。
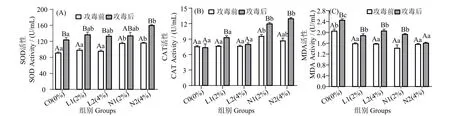
图1 珍珠龙胆石斑鱼攻毒前和攻毒12 h 后血清SOD,CAT 和MDA 含量变化Fig.1 Effects of dietary yeast culture supplementation on serum SOD,CAT and MDA response in Epinephelus fuscoguttatus♀×E.lanceolatu pre-challenge and 12 h after challenge
2.6 血清免疫指标
图2 可见,攻毒后12 h,N2 组血清酸性磷酸酶(ACP)含量显著高于攻毒前(图2_A),且显著高于同期对照组(P< 0.05)。攻毒后12 h,L1、L2、N1 和N2 组血清碱性磷酸酶(AKP)活性无显著差异(P>0.05),但较攻毒前显著提高(P<0.05)(图2_B)。各组血清溶菌酶(LZM)活性在攻毒前显著低于攻毒后(图2_C)(P< 0.05),L2和N1 组LZM 活性在攻毒后显著高于同期对照组(P< 0.05)。攻毒12 h 后,N1 和N2 组免疫球蛋白(IgM)活性显著升高(图2_D),且显著高于同期对照组(P< 0.05)。
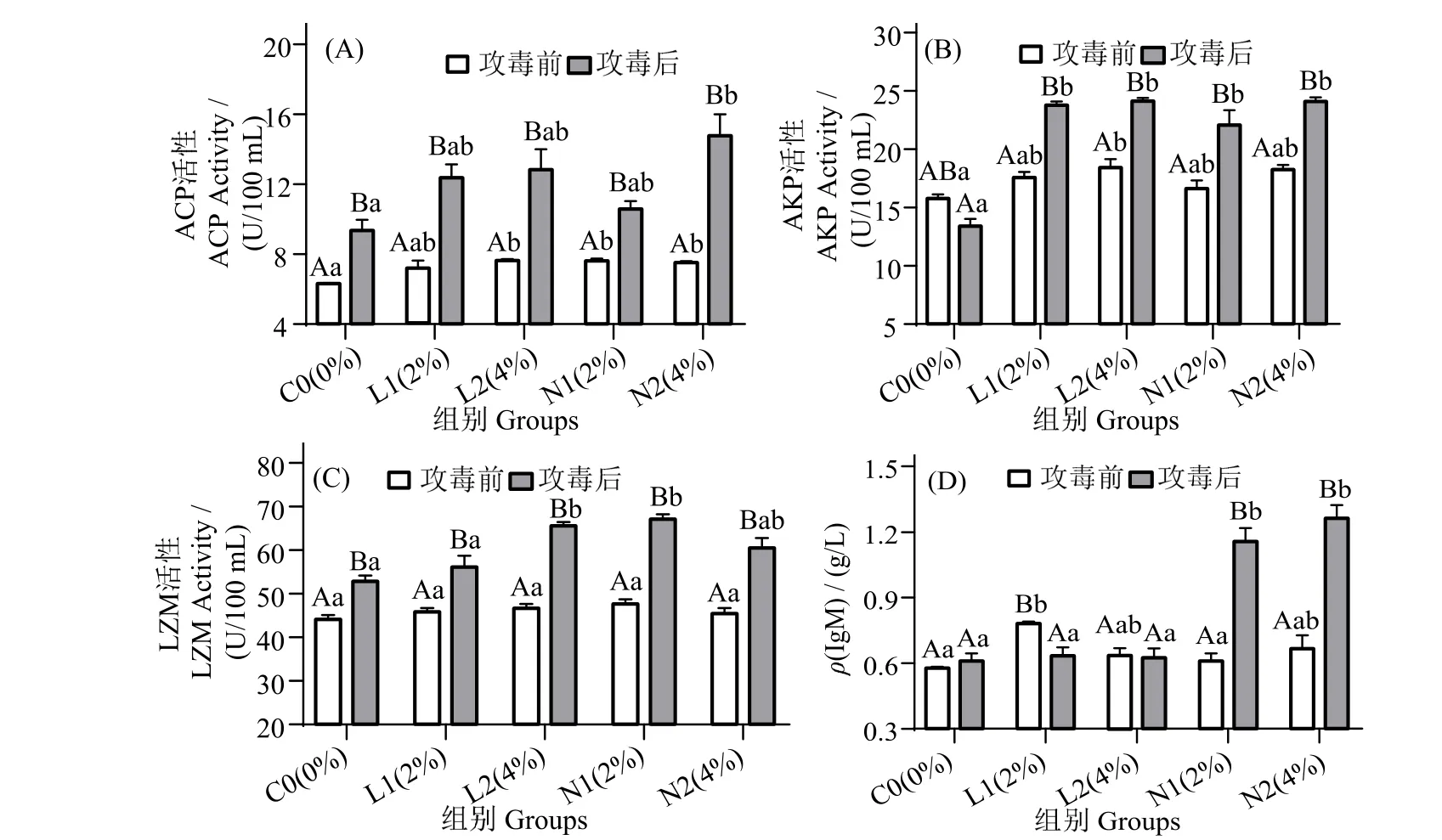
图2 珍珠龙胆石斑鱼攻毒前和攻毒12 h 后血清ACP,AKP,LZM 和IgM 活性变化Fig.2 Effects of dietary yeast culture supplementation on serum ACP,AKP,LZM and IgM response in Epinephelus fuscoguttatus♀×E.lanceolatu pre-challenge and 12 h after challenge
2.7 肠道形态结构
图3 和表6 可见,除L1 组外,添加酵母培养物后,其余各组绒毛高度 (VH) 和绒毛宽度 (VW)均显著增加(P< 0.05),而N1 和N2 组间无显著性差异(P> 0.05)。实验组中肌肉厚度 (MT) 有所增加,与对照组相比,仅N1 组显著增加P< 0.05)。

图3 添加酵母培养物鱼粉对珍珠龙胆石斑鱼肠绒毛高度、绒毛长度和肠肌厚度的影响Fig.3 Effects of supplementation of fishmeal with yeast culture on villus height,villus width and intestinal muscle thickness of Epinephelus fuscoguttatus♀×E.lanceolatu
表6 酵母培养物对珍珠龙胆石斑鱼肠道形态的影响Table 6 Effects of supplementation of fishmeal with yeast culture on intestinal morphology of Epinephelus fuscoguttatus♀×E.lanceolatu μm

表6 酵母培养物对珍珠龙胆石斑鱼肠道形态的影响Table 6 Effects of supplementation of fishmeal with yeast culture on intestinal morphology of Epinephelus fuscoguttatus♀×E.lanceolatu μm
注:同列数据肩标凡含一个相同字母表示组间无显著差异(P>0.05)。Note:The data in same column with a same letter mean no significant difference between groups at level of 0.05.
2.8 哈维氏弧菌攻毒实验
图4 可见,攻毒168 h 后,注射生理盐水组(NC)珍珠龙胆石斑鱼无死亡记录,酵母培养物处理组累积存活率与对照组相比差异显著(P< 0.05)。N2实验组存活率最高 (80%),对照组C0 存活率最低(20%)。

图4 珍珠龙胆石斑鱼攻毒168 h 后累积存活率Fig.4 Survival rate of 168 h in Epinephelus fuscoguttatus♀ × E.lanceolatu after challenged by Vibrio harveyi
3 讨论
3.1 酵母培养物对珍珠龙胆石斑鱼生长性能的影响
本研究表明,珍珠龙胆石斑鱼饲料中添加酵母培养物可显著提高珍珠龙胆石斑鱼生长性能和饲料利用率。N1、N2 组显著提高体质量、增重率、特定生长率,降低饲料系数,说明发酵底物不含非蛋白氮的酵母培养物对珍珠龙胆石斑鱼的生长性能和饲料利用率有较好的提升作用。这种良性影响可能与N1、N2 组酵母培养物的生物活性化合物(包括蛋白质、氨基酸、脂肪酸、维生素和多糖)有关,以及饲料酵母培养物对肠道消化酶的影响有关。同时,实验组消化酶活性显著提高,表明肠道增强了对饲料的消化吸收能力,推测N1、N2 组激发了较高的消化酶活性,从而提高饲料利用率。刘明等[18]指出,饲料中添加酵母培养物可显著提高凡纳滨对虾(Litopenaeus vannamei)肠道消化酶活性,并降低饲料系数;李高峰[19]也报道了酵母培养物可显著降低团头鲂(Megalobrama amblycephala)饲料系数,与本研究结果一致。添加酵母培养物的饲料对珍珠龙胆石斑鱼鱼体蛋白质、脂质和灰分含量有显著的积极影响,亦表明酵母培养物可增强水生动物生长和生理机能。以增重率为判据,添加酵母培养物可通过促进体内肠道消化酶分泌,提高珍珠龙胆石斑鱼生长性能,虽在发酵底物添加非蛋白氮可提高酵母培养物粗蛋白质量分数(55%),但与未添加非蛋白氮组(粗蛋白质量分数50%)相比生长性能无显著差异。
3.2 酵母培养物对珍珠龙胆石斑鱼血清生化、抗氧化的影响
血清生化指标与水生动物的生理、营养和疾病有密切联系,可准确反映水生动物健康情况[20]。葡萄糖为鱼类抗应激代谢参数的指标,本研究中,N2组珍珠龙胆石斑鱼血清葡萄糖在饲喂酵母培养物后显著降低,可能由酵母培养物中含免疫刺激剂β-葡聚糖所致[21]。酵母培养物主要成分除酵母菌体蛋白外,还含有大量β-葡聚糖、甘露寡糖[22]。在动物体内,β-葡聚糖可通过激活PI3K/AKT 途径降低血糖。TG 和CHO 是鱼类血脂的关键成分,二者含量高低可反映鱼体脂类代谢状况,高含量会对鱼类肝胰脏产生损伤[23]。本研究中,用酵母培养物饲喂珍珠龙胆石斑鱼时,除N1 组TG 显著升高外,其余各组无显著差异,且各组间CHO 无显著差异。N1 组TG 的升高可能与酵母培养物添加量有关,具体机制需进一步验证。总体而言,饲料中添加酵母培养物不会对珍珠龙胆石斑鱼造成不良影响。课题组前期研究发现,饲料添加酵母培养物对凡纳滨对虾(Litopenaeus vannamei)血清中TG 和CHO 含量无显著影响[24],与珍珠龙胆石斑鱼研究结果一致。
养殖动物代谢活动常产生多种活性氧 (ROS),可能导致氧化应激。SOD 可将超氧阴离子转化为过氧化氢和氧气,从而构成抗氧化酶防御第一道防线,已用作确定鱼类氧化应激状况分子标志物[25]。CAT 为一种抗氧化酶,在水生动物免疫反应中可催化过氧化氢分子转化为水和氧[26]。MDA 是脂质过氧化的主要产物,反映了脂质氧化的程度[21]。本研究中,N2 组血清SOD、CAT 含量攻毒后显著高于对照组。与用酵母培养物饲喂凡纳滨对虾[9,27]、黄颡鱼(Pelteobagrus fulvidraco)[28]和斑点叉尾鮰(Ictalurus punetaus)[29]的结果一致。N2 组MDA 含量攻毒后最低且显著低于其余各组,与凡纳滨对虾饲料中添加酵母培养物的结果一致[24]。酵母培养物可增强抗氧化能力可能与酵母细胞富含维生素有关(B 族复合维生素可降低单核细胞中由H2O2引起的氧化应激[30])。本研究中,N 组抗氧化水平高于L 组,这可能与两种酵母培养物的发酵方式有关,L 组发酵底物含非蛋白氮,而N 组发酵底物不含非蛋白氮。具体作用机制需进一步研究。AST 和ALT是存在于肝细胞细胞质中的可溶性酶,其活性增强反映了肝损伤[31]。通过血清ALT 和AST 水平可知,酵母培养物对珍珠龙胆石斑鱼并无不良影响,与草鱼的相关研究结果一致[32]。推测酵母培养物在保护肝脏组织的同时,可增强鱼类的抗氧化免疫系统。
LZM、AKP、ACP、TP、IgM 等先天免疫指标常用于鱼类的非特异性免疫监测。TP 是先天免疫系统的重要组成部分,保护鱼类免受潜在入侵生物的侵害[33-35]。本研究中,N2 组显著提高血清TP。在凡纳滨对虾[36]中亦有类似结果。ACP 和AKP 是鱼类体内重要的溶酶体酶,可水解和消化入侵的病原体,在免疫应激反应中发挥重要作用,是免疫系统巨噬细胞活化的特征标记物[36]。鱼体ACP 和AKP 活性升高表明免疫力相对增强。在珍珠龙胆石斑鱼的饲料中添加甘露寡糖可刺激鱼类的AKP 活性[37]。LZM是一种天然免疫酶,可溶解和消化感染性细菌。IgM是鱼血清的主要免疫球蛋白,可作为反映鱼免疫状态的标志物[38]。大量研究表明,酵母培养物对天然免疫反应有积极影响。在乌苏里鲇(Pseudobagrus ussuriensis)中,添加质量分数10%的饲料酵母培养物可提高血浆中ACP、AKP 和血清中LZM 含量,表明先天免疫反应得以改善[39]。饲料中添加两种组合的酵母培养物可改善虹鳟(Oncorhynchus mykiss)先天免疫反应[40]。雷宇杰等[29]研究表明,饲料添加酵母培养物可提高斑点叉尾鮰血清LZM 的含量。李高峰[19]研究证实,团头鲂(Megalobrama amblycephala)饲料中酵母培养物的添加可提高其非特异性免疫反应。饲料中添加酵母培养物可增强异育银鲫(Carassius auratus gibelioCAS Ⅲ)[41]和凡纳滨对虾[18]的非特异性免疫反应。本研究发现,攻毒后N2 组血清ACP、AKP 含量显著高于对照组,而LZM 含量高于对照组但无显著差异。此外,N2 组IgM 攻毒后含量最高且显著对照组,再次表明饲料中添加质量分数4%酵母培养物可增强珍珠龙胆石斑鱼的非特异性免疫应答。酵母培养物可提高鱼类免疫力可能与其含有的甘露寡糖以及β-葡聚糖有关。有研究表明,甘露寡糖和β-葡聚糖可激活机体免疫系统[42],β-葡聚糖可与水产动物机体内巨噬细胞结合,进而激活巨噬细胞活性,激发机体免疫反应,从而清除机体内病原微生物[43]。甘露寡糖有一定的免疫刺激作用,可与Toll 样受体4(TLR-4)结合,提高机体免疫应答反应[44]。本研究表明,N 组石斑鱼先天免疫反应的改善高于L 组,N 组中以N2 组酵母培养物效果最佳。这是否与酵母培养物发酵底物中非蛋白氮的添加有关,有待进一步研究。
3.3 酵母培养物对珍珠龙胆石斑鱼肠道形态和抗病力的影响
肠道形态和结构对吸收营养物质和维持正常功能至关重要[45-47]。绒毛在吸收营养物质和提高生长性能方面有重要作用[48],肠壁功能取决于绒毛长度。建鲤(Cyprinus carpiovar.Jian)幼鱼饲料中添加酵母水解物可增加肠道绒毛高度,提高生长性能[49]。此外,酵母培养物中的甘露寡糖增加凡纳滨对虾的肠道绒毛长度[50],说明饲料甘露寡糖可有效调控肠道绒毛结构。本研究中,饲料添加酵母培养物对珍珠龙胆石斑鱼的绒毛高度和宽度有显著促进作用,从而进一步提高石斑鱼的生长性能,可能与酵母培养物中含甘露寡糖有关。
养殖动物传染病暴发是水产养殖业发展的瓶颈问题。弧菌是石斑鱼传染病的病原体之一,常导致集约化高密度养殖的石斑鱼大量死亡,给养殖户造成严重经济损失[51-55]。本研究中,饲以添加酵母培养物饲料,珍珠龙胆石斑鱼对哈维氏弧菌有显著的抵抗作用,尤其是N2 组。与饲以含有质量分数1%酵母培养物对虾的研究结果一致[56]。对哈维氏弧菌的抵抗力增强,表明酵母培养物可刺激和延长珍珠龙胆石斑鱼对病原性感染的免疫应答。
4 结论
本研究表明,在珍珠龙胆石斑鱼饲料中添加酵母培养物可显著提高其生长性能、血清免疫力和抗菌能力。还对肠道形态和结构有积极影响。在本实验条件下,以增重率、免疫指标和累积存活率为判据,饲料中添加4%的酵母培养物 (发酵底物不含非蛋白氮) 对珍珠龙胆石斑鱼生长性能、免疫和抗病能力有最显著促进作用,发酵底物添加非蛋白氮可提高酵母培养物粗蛋白含量,但与未添加非蛋白氮组相比对生长性能并无显著促进作用。
