海水酸化对珊瑚藻生长和钙化作用的影响
2021-06-12谢子强
聂 磊,谢子强,彭 丹
(1.深圳信息职业技术学院环境工程学院,广东 深圳 518268;2.广东海洋大学深圳研究院,广东 深圳 518120)
人类现代社会活动高强度排放大量温室气体,导致大气CO2浓度不断升高,进而引发诸如海平面升高、水循环异常、全球变暖、海洋酸化等系列重大环境问题,且相关问题自工业革命以来不断加剧。据报道,全球海洋pH 值至21 世纪末期可能降至7.4,大气CO2浓度可能加大到现在的5 倍[1]。珊瑚藻(coralline algae)属于红藻门(Rhodophyta)红藻纲(Rhodophyceae)真红藻亚纲(Florideophycidae)珊瑚藻目(Corallinales),是一类海洋常见大型红藻,物种多样性丰富,体内含有大量碳酸钙。珊瑚藻主要有壳状、枝状和瘤块状三种形态,叶状体坚硬,又分有节和无节两大类。珊瑚藻是海洋生物礁系统中最为重要的功能类群之一,在生物礁生态系统和礁体建造中具有广泛和核心作用。开展珊瑚藻研究和保护,对生物礁生态系统的可持续保护、以珊瑚为主的海洋受损生态系统的恢复等具有重大影响[2]。珊瑚藻具有钙质无机骨架,在生物礁钙质体的建造与维护方面不可替代,同时又被认为是对海洋酸化最敏感的藻类生物之一,但目前国内外关于海水酸化态势下珊瑚藻的生理机制研究仍较少见,至于壳状珊瑚藻(crustose coralline algae,CCA)的国内生理生态研究更是空白[3]。本研究以南海海域典型的壳状珊瑚藻拟中叶藻和枝状珊瑚藻叉节藻为对象,比较分析海水酸化对于壳状及枝状珊瑚藻的生长、光合色素积累、碳酸酐酶(CA)以及钙化固碳的影响差异,以期为探索珊瑚藻,尤其壳状珊瑚藻的生态机理以及珊瑚礁的生态系统保护提供理论支持。
1 材料与方法
实验采用的叉节藻(Amphiroa ephedraea)和拟中叶藻(Mesophyllum simulans)样品于2018 年8 月采集于深圳大鹏湾潮间带(114°36′N,22°25′E),新鲜采集的叉节藻,蒸馏水洗去泥沙及其他附着物,去除杂藻,选择生长旺盛,藻体完整的样本灭菌处理3~4 次。以500 mL 锥形瓶作为培养容器,保持每瓶添加的叉节藻藻体质量为(5.0±0.05)g。壳状藻拟中叶藻连同原有生长基石一起在锥形瓶中培养[4]。
1.1 不同培养条件的设置
实验设置3 个不同pH 值的培养条件:8.2、7.8和7.4,各设3 个平行组。pH 值使用经标准液校正的pH 计(FE20,Mettler Toledo,Switzerland)测定。pH 值8.2 的处理为深圳大鹏湾自然海水,通过向自然海水充入瓶装CO2气体获得7.8 和7.4 的 pH值,充气时用pH 计即时监测海水pH 值变化,当pH 达到所需值时停止充气,放入藻体进行静水培养。光照培养箱控制培养温度为20 ℃,光照强度为100 μmol·m-2·s-1,光暗比为12 h∶12 h,每天摇动藻体 2 次。培养过程监测 pH 值,90 d 后测定不同处理下珊瑚藻的各项生长和生理生化指标。
1.2 生长分析
培养开始前和结束时用蒸馏水清洗藻体,其中拟中叶藻藻结皮用刀片轻轻刮下。用吸水纸吸干藻体表面,分别测定藻体的鲜质量,按公式(1)计算出相对生长率(RGR)[4]:
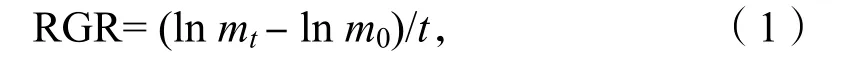
其中,m0为实验开始时海藻的鲜质量,mt为实验t天后海藻的鲜质量。t为实验中藻类培养时间,单位为d。
1.3 光合色素分析
采用分光光度法测定珊瑚藻叶绿素a(Chl a)、类胡萝卜素(Car)和藻红蛋白(PE)质量浓度,取 0.1 g 左右的新鲜藻体经丙酮研磨后浸提,4 000 r/min 离心10 min,取上清液分别在波长 480 nm、645 nm和 663 nm 下测定提取液的光密度,然后再按照下列公式将浓度换算为样品叶绿素 a 质量浓度(单位:mg·L-1)和类胡萝卜素质量浓度(单位:μg·L-1),D代表上清液在相应波长下光密度[5]:
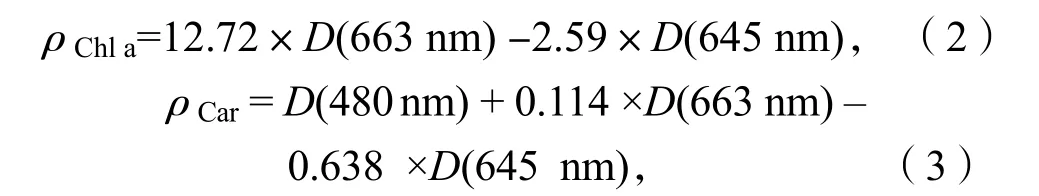
藻红蛋白(PE)质量浓度的测定:取 0.1 g 新鲜藻体在磷酸缓冲液(pH=6.8)研磨后浸提,经4 000 r/min 离心10 min,取上清液分别在波长455、564 和592 nm 波长处测定光密度D[5]。PE 质量浓度按公式(4)计算,单位为mg·L-1:
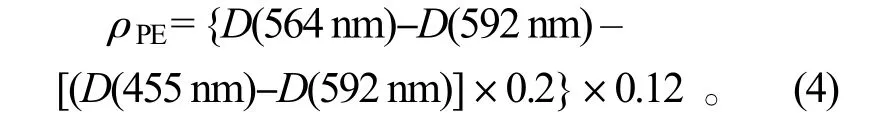
1.4 碳酸酐酶(CA)活性分析
称取藻样品0.5 g 置于预冷研钵中,在冰浴条件下加入3 mL 提取液(5 mmol/L 巯基乙醇,15 mmol/L 巴比妥缓冲液,pH=8.2)进行研磨,用4层消毒纱布对研磨匀浆过滤,滤液在4 ℃环境中用离心机7 000 r/min 下离心5 min,取上清液(CA粗提液),4 ℃下冷藏待进行CA 活性测定,以煮沸5 min 冷却的部分上清液作为对照。采用pH 计法测定碳酸酐酶活性,分别在两个冰浴条件下的小烧杯中依次加入15 mmol/L 巴比妥缓冲液、未煮沸或者煮沸的碳酸酐酶粗提液以及冰冷的CO2饱和水,记录下pH 值由8.2 下降至7.4 所用的时间。研磨过滤后的固体残渣及离心后的沉淀物用于叶绿素a 浓度的测定。CA 活性的计算公式如下[6]:
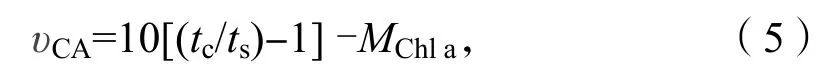
其中υCA代表碳酸酐酶活性,tc代表对照中pH 值从8.2 下降至7.4 所用的时间(min),ts代表未煮沸酶液pH 值从8.2 下降至7.4 所用的时间(min),MChla代表测定藻体的叶绿素量(μg)。
1.5 藻体中碳成分的含量测定
珊瑚藻样品经烘箱烘干(于50 ℃条件下)后研磨成粉末状,准确称取1.0 mg 样品用玻璃微纤维滤纸包裹,置于不密封的玻璃试管中,试管在浓盐酸挥发形成的酸雾条件下暴露酸熏24 h,除去样品中的颗粒无机碳(PIC),第二次烘干待测定,样品有机碳含量由碳氮分析仪(multi N/C UV,Analytik Jena AG,Germany)测定。经过酸熏处理的粉末样品测定结果为珊瑚藻藻体颗粒有机碳(POC)含量,未经酸熏处理的样品测定结果为总的碳颗粒含量,减去POC 的量即为藻体颗粒无机碳(PIC)含量。
1.6 钙化固碳速率和光合固碳速率的测定
不同培养条件下的珊瑚藻分别测定其在3 h 的时间间隔内PIC 和POC 含量变化,以PIC 含量的增加速率表示藻的钙化固碳速率(Cn),POC 含量的增加速率表示光合固碳速率(Pn)。
1.7 数据处理
实验数据采用SPSS18.0 分析后,根据单因素方差分析(one-way ANOVA)检验数据差异显著性,显著性水平α设为0.05。
2 结果与分析
2.1 海水酸化对于珊瑚藻光合固碳速率、光合色素含量及碳酸酐酶活力的影响
珊瑚藻的光合作用是以CO2和为底物,把无机碳合成有机物的过程,可以用方程式表示为:CO2+H2O ⇌ CH2O+O2;这是对CO2的一个吸收过程。在本研究中,通过向培养水体中充入高浓度CO2的方法降低海水pH 值,珊瑚藻的光合固碳速率(Pn)随着pH 值的下降而逐步上升,其中pH7.4 条件下藻体的光合固碳能力要高于pH 7.8(图1)。经90 d 培养后,pH7.4 培养条件下的叉节藻光合固碳速率达到[(6.21±0.47)mg·g-1·h-1],较pH 7.8 条件下增加了6.15%,达到了pH 8.2 条件下的26.52%。壳状珊瑚藻在pH 值降低状况下的光合能力上升幅度绝对值不如枝状珊瑚藻,但相对差异值则更为明显。经90 d 培养后,拟中叶藻在pH 7.8到 pH 7.4 之间的光合固碳效率上升幅度达到13.46 %(达到显著水平),超过叉叶藻的上升幅度。
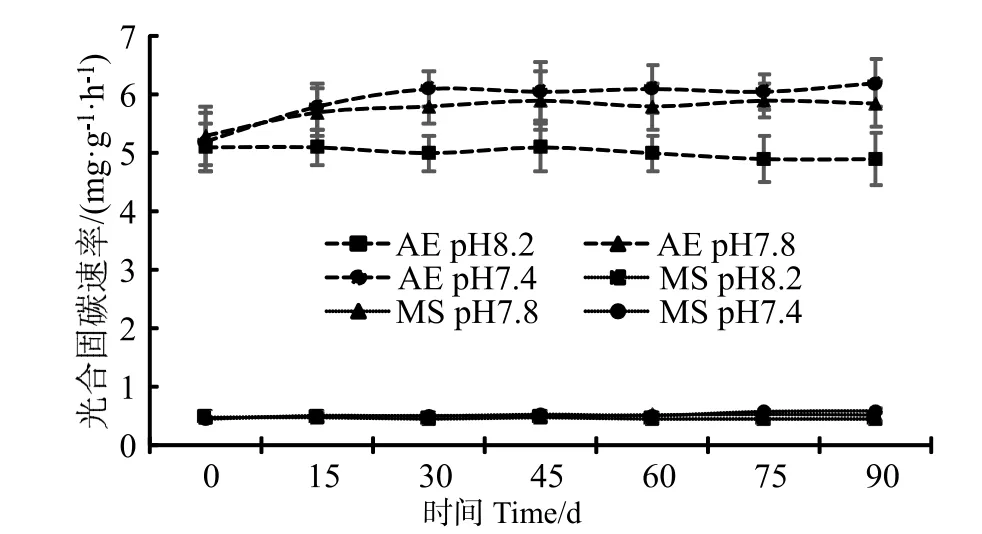
图1 海水酸化处理对珊瑚藻光合固碳速率的影响Fig.1 The effects of seawater acidification on the rate of photosynthetic carbon fixation of coralline algae
不同pH 海水处理90 d 后测定珊瑚藻中的叶绿素a 质量浓度,结果见图2。与pH 8.2 的对照组比较可发现,海水酸化处理下实验组的叶绿素a 与藻红蛋白(PE)质量浓度明显降低,且随着pH 值减低而不断下降,在pH 7.8 和pH 7.4 处理下,叉节藻分别下降了29.52%和48.30%,而拟中叶藻叶绿素a 分别下降了22.72%和50.15%,均达到了显著水平,藻红蛋白质量浓度的变化趋势与此类似。在pH 7.8 和pH 7.4 的海水酸化处理下,叉节藻的类胡萝卜素含量分别上升了21.52%、和23.47%,而和拟中叶藻则上升了24.33%和33.35%,珊瑚藻的类胡萝卜素质量浓度在海水酸化处理下的变化趋势与叶绿素a 与藻红蛋白(PE)相反。

图2 海水酸化处理对珊瑚藻光合色素含量的影响Fig.2 The effects of seawater acidification on the contents of photosynthetic pigments of coralline algae
作为与Rubisco 羧化酶(1,5-二磷酸核酮糖羧化酶)同样属于光合作用过程中催化(同化)无机碳的关键(限速)性酶,碳酸酐酶(CA)主要分布在珊瑚藻细胞内的质体、叶绿体中或者细胞质膜表面,主要生理功能为可逆性催化CO2(碳酸酐)水合反应的迅速进行,反应式为:CO2+H2O ⇌+H+[6]。由图3 可见,海水酸化处理下珊瑚藻的碳酸酐酶活性明显下降。在pH 7.8 和pH 7.4 处理下,叉节藻的碳酸酐酶活性分别下降了 23.10%和40.43%,和拟中叶藻则下降36.3%和59.61%,经统计分析均达到了显著水平。
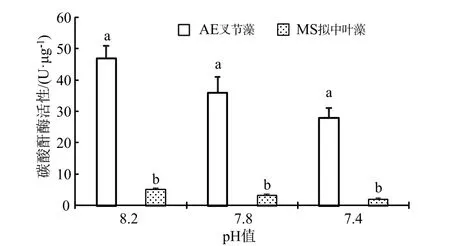
图3 海水酸化处理对珊瑚藻碳酸酐酶活性的影响Fig.3 The effects of seawater acidification on the activities of CA of coralline algae
2.2 海水酸化对于珊瑚藻钙化固碳速率及相对生长速率的影响
珊瑚藻能够通过钙化作用(Calcification),将海水中的碳酸氢根转化为气态CO2,具体方程式为:海水酸化处理明显降低了珊瑚藻钙化固碳速率,在海水pH值7.4 的酸性环境条件下,叉节藻经过90 d 处理后钙化能力表现为负值[(-0.52±0.07)mg·g-1·h-1],较对照绝对值下降了110.42%,壳状珊瑚藻也在酸化环境下明显降低了钙化能力,在海水pH 7.8 酸化处理的75 d,拟中叶藻的钙化固碳速率就下降为了负值[(-0.08±0.01)mg·g-1·h-1] (图4)。pH 7.8 和pH 7.4 的海水处理90 d 后,拟中叶藻的钙化固碳速率绝对值分别下降了77.78%和128.89%。
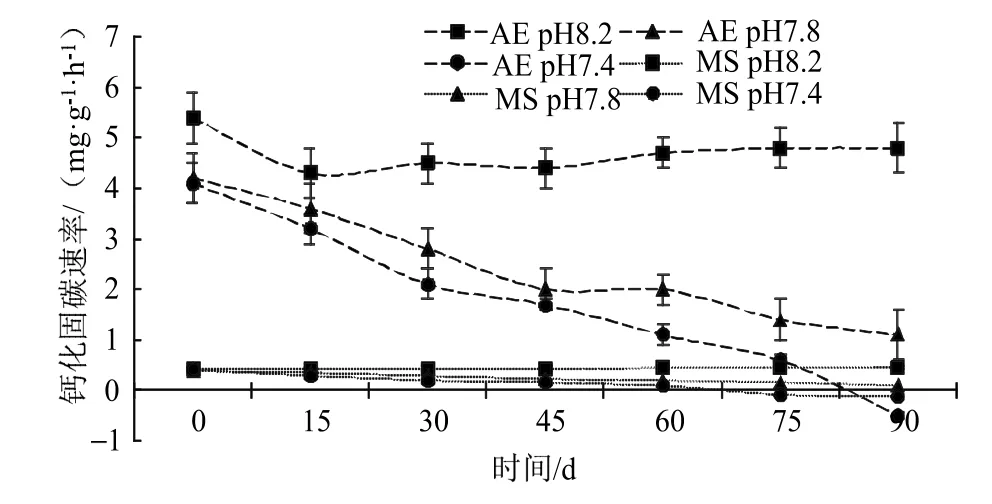
图4 海水酸化处理对珊瑚藻钙化固碳速率的影响Fig.4 The effects of seawater acidification on the rate of calcified carbon fixation of coralline algae
藻体钙化量(PIC)与有机物(POC)的比例同时受到珊瑚藻光合固碳能力与钙化固碳能力影响。由于海水酸化条件下,珊瑚藻的光合能力明显提升,钙化能力却显著下降,因此PIC/POC 比值有明显的降低,pH 7.8 和pH 7.4 酸化海水处理下,叉节藻和拟中叶藻的PIC/POC 比值均在0.2 以下(图5)。
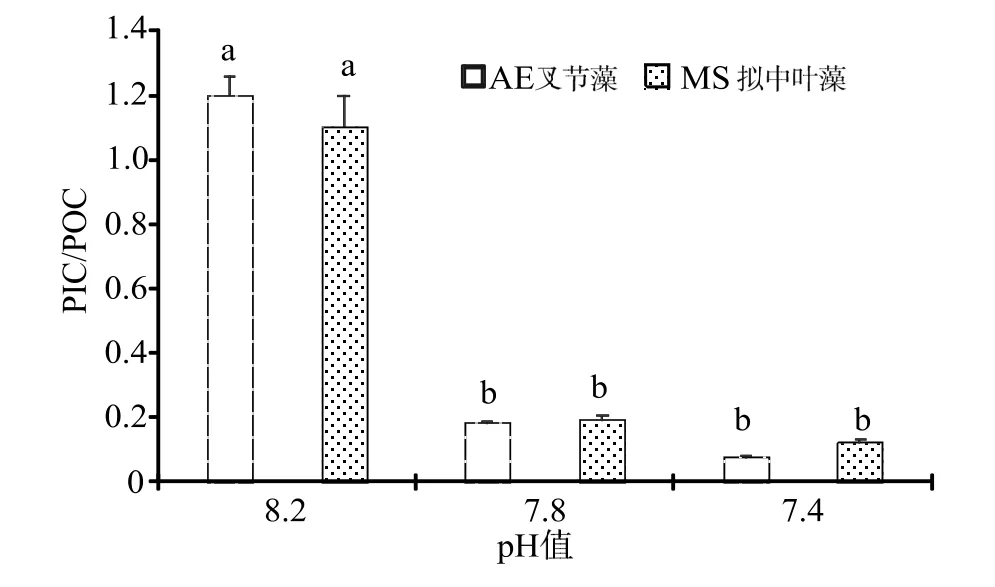
图5 海水酸化处理对珊瑚藻PIC/POC 比值的影响Fig.5 The effects of seawater acidification on the ratio of PIC/POC of coralline algae
随着海水酸化处理的pH 值逐渐降低,尽管光合固碳能力有所升高,但枝状珊瑚藻的钙化能力却急剧下降,因此相对增长率(RGR)越来越小,在pH7.4 海水处理下,叉节藻相对增长率较对照明显下降了38.24%(P< 0.05),而壳状的拟中叶藻可能由于生长缓慢,在90 d 的培养期内相对增长率的下降程度并未达到显著水平(图6)。
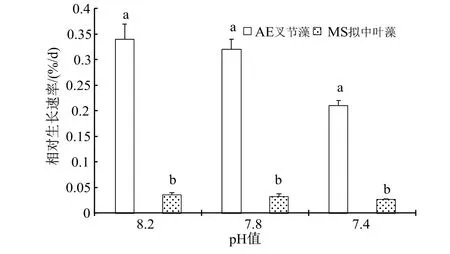
图6 海水酸化处理对珊瑚藻生长的影响Fig.6 The effects of seawater acidification on the growth of coralline algae
3 讨论
海洋是地球碳循环体系里的核心部分,随着全球变化的进程,海水里的CO2体积分数逐渐增大,加剧海洋酸化。海水pH 值不断降低,极大地改变了海洋碳酸盐系统面貌,对于在全球碳循环中扮演举足轻重角色的海洋钙化生物,包括钙化海藻也将产生重要影响[8]。作为全球海洋底栖世界的最重要成分,珊瑚藻的生理生态特性在国内外已有一些科学探索,包括光合生理、碳酸盐骨架矿物学以及生态服务功能等,但仍有大量理论空白等待研究,人类尤其在壳状珊瑚藻领域了解不多[9]。国内外对于环境因素对珊瑚藻的生理影响研究很少,当前仅少量报道研究了光照、海水酸化等因素对枝状珊瑚藻的生理影响,至于壳状珊瑚藻生理生化分析方面的专门研究则更为少见[3,10]。
深圳海域位于我国南亚热带海区,尤其东部的大鹏海域水温、盐度比较稳定,而且水体清澈、透光性好,适宜珊瑚藻栖息生长[11]。本区珊瑚藻群落可以分为近岸与离岸两种类型,近岸型的种类以对于浊度、沉积速率和悬浮物耐受能力较强的种类为主,并且对光照强度较敏感。本实验以本地区近岸型的典型枝状珊瑚藻种类叉节藻和壳状珊瑚藻种类拟中叶藻为研究对象,开展海水酸化相关研究。
3.1 海水酸化对珊瑚藻的光合作用影响分析
在以往的大型海藻研究中,都已发现高浓度CO2能促进光合作用[12]。本实验通过向培养水体中充入高浓度的CO2,使pH 值降低(如降至pH=6.8),引起培养海水中CO2和的浓度增加,为光合作用的暗反应过程提供了更充足的底物,同样导致了小珊瑚藻光合作用的升高。其中,pH7.4 条件下藻体的光合固碳效率要高于pH 7.8。壳状珊瑚藻在pH 值降低状况下的光合能力上升变化幅度更为明显(P< 0.01)。
在光合色素方面,实验发现高浓度CO2使得珊瑚藻体中叶绿素a 和藻红蛋白的含量下降,类胡萝卜素含量升高,这与之前在细基江蓠(Gracilaria tenuistipitata)等藻类研究结果相似[13]。保护色素含类胡萝卜素量的增加,应该是海水酸化刺激下藻体应对的保护措施;藻红蛋白起着吸收光能与传递能量的重要作用,从实验结果看,海水酸化处理对珊瑚藻藻红蛋白有明显的破坏作用。
3.2 海水酸化对珊瑚藻的钙化作用影响分析
珊瑚藻通过光合和钙化两种方式固定二氧化碳,因为无法直接利用空气中的无机碳,珊瑚藻在漫长的进化历程中形成了一套无机碳浓缩机制,亦被称为“CO2/泵”[14]。碳酸酐酶(CA)在其中扮演了将气态CO2分子转换为可溶性的核心角色,再以特殊转运机制,最终为珊瑚藻的光合暗反应提供无机碳底物。在各种大型海藻中,红藻门的海藻对利用能力较弱,远不如褐藻和绿藻[15]。因此碳酸酐酶(CA)通过CO2浓缩机制提供足够的浓度,对于保障珊瑚藻等红藻类的光合能力有着重要意义。对于钙化藻类的无柄珊瑚藻(Corallina sessilis)相关研究结果显示,海水CO2浓度升高会导致碳酸酐酶活性下降[16],主要原因可能在于浓度的不断提高导致了CA 的活性受到抑制,而本研究在枝状珊瑚藻和壳状珊瑚藻的实验结果也与此类似。
珊瑚藻的生命过程中涵括了钙化作用和有机碳生产两个过程,藻体通过有机碳泵(生物泵)从事有机碳的初级生产,通过碳酸盐反向泵(溶解泵)完成胞壁沉积CaCO3的钙化作用,最终,全球广泛分布的珊瑚藻通过这两个刚好相反同时又相辅相成的化学过程实现对大气CO2浓度的调节,进而影响全球的气候变化[17]。珊瑚藻属于对CO2浓度升高引起海水酸化过程高度敏感的重点生物种之一,其钙化作用容易受到空气和海水中 CO2浓度变化的双重影响。学术界普遍的认识是,当空气CO2体积分数升高时,海水中H+浓度对数值将相应减小,导致CaCO3饱和度逐渐降低,珊瑚藻钙化因此会受到抑制[18]。徐智广等[19]研究发现海水pH 值5.5 的酸性环境条件下,小珊瑚藻钙化表现为负值[(-2.53±0.57)mg·g-1·h-1],这可能是过多的H+使得小珊瑚藻的钙化组织部分溶解所造成。本研究同样发现海水酸化处理明显降低珊瑚藻钙化固碳速率,海水pH 值7.4 的酸性环境条件下,叉节藻和拟中叶藻在实验处理后钙化均表现为负值。在海水pH 7.8 酸化处理的75 d,拟中叶藻的钙化固碳速率就已下降为负值[(-0.08±0.01)mg·g-1·h-1] 。海水酸化条件下,珊瑚藻的光合能力明显提升,钙化能力却显著下降,因此PIC/POC 比值相应有明显降低。pH 7.8 和pH 7.4 酸化海水处理下,叉节藻和拟中叶藻的PIC/POC 比值均在0.2以下。
3.3 海水酸化对珊瑚藻的生长影响分析
已有的相关研究显示[16,20],珊瑚藻的生长及生理活性对于海水酸化以及伴随而来的海水温度升高有负面的反应,海水CO2浓度升高可抑制珊瑚藻的钙化与生长,破坏藻体的生理结构。在本实验中,枝状珊瑚藻随着海水酸化处理的pH 值下降出,光合固碳能力有所升高,但钙化能力却急剧下降,因此相对增长率(RGR)越来越小,在pH 7.4 海水处理下,叉节藻相对增长率较对照明显下降了38.24%(P< 0.05),而壳状的拟中叶藻由于生长缓慢的原因,在90 d 培养期内相对增长率的下降程度并未达到显著水平。
海水酸化对于壳状及枝状珊瑚藻的生长、光合色素积累、碳酸酐酶活性以及钙化固碳能力的影响存在明显差异。壳状珊瑚藻在海水酸化下的钙化生理指标和生长数值变化幅度不算明显,但相对差异更为显著。实验中壳状珊瑚藻拟中叶藻可能由于本身生长缓慢,且由于本实验设计周期的持续时间有限,暂未发现海水酸化对于藻体生长的负面影响达到显著水平,尚有待今后更长周期的培养和实验。
综上,一定pH 值范围内的海水酸化处理,对于珊瑚藻的光合作用有所促进,同时明显降低钙化量和碳酸酐酶活性,改变光合色素含量与PIC/POC比值,进而抑制枝状藻体生长。鉴于珊瑚藻在海洋生态系统中所承担的重要角色,在未来研究中,非常值得对珊瑚藻,尤其是壳状珊瑚藻的钙化过程开展更加广泛和深入的研究,为海洋生物对于海水酸化响应研究,以及全球变化下生物圈碳循环与碳汇的研究提供相应依据[2-3,21]。
