微生物碳酸酐酶特性研究
2018-09-05洪子茜
洪子茜
(四川师范大学,四川成都 610101)
在研究喀斯特地貌形成过程中,地质学家发现微生物碳酸酐酶可能加速石灰石的溶解,其主要成分是碳酸盐,对钙和镁离子的溶解贡献很大[1-2]。碳酸酐酶在自然界中广泛分布,并能够催化二氧化碳(CO2)的可逆水化反应至HCO3-,具有很大的经济效益。到目前为止,已经描述了十六种同工酶[3],它们的亚细胞定位、催化活性和对不同种类抑制剂的敏感性不同。
1 酸酐酶捕获二氧化碳能力
微生物碳酸酐酶是由多种组织产生的,它们参与了一系列重要的生物过程,如酸碱平衡、呼吸、二氧化碳和离子转运、体细胞生成等[4]。基于生物的捕获系统是二氧化碳捕获技术改进的潜在途径。这些系统基于二氧化碳在活生物体中自然发生的反应,其中一种可能性是酶的作用,如碳酸酐酶。作为可替代的工业过程,碳酸酐酶具有捕获二氧化碳的潜力,以减少二氧化碳排放到大气中[5]。捕获可以通过酶的二氧化碳水合和随后的碳酸盐矿物形式的化学反应来完成,其具有存在于自然中的天然优点。在使用碳酸酐酶捕获二氧化碳时,很少使用高度纯化的酶制剂。因此,有必要用经济适用的低纯度酶提取液进行捕获,这是通过工业应用的纯化技术获得的,从而降低了捕获和封存二氧化碳的成本。
2 酸酐酶活性
碳酸酐酶活性试验是在布劳内尔等方法改进后进行的,在2℃冷冻反应室中,分别将4.5毫升冰冷的新制备的二氧化碳饱和水加入到0.5毫升煮沸和未煮沸的碳酸酐酶液体中,并测试单位pH值下降所用的时间。酶活性单位可以根据公式计算,蛋白质的测试是指劳里等人的方法。碳酸酐酶活性以每毫克蛋白质(U/mg)中所含的单位酶活性来表示。
3 碳酸酐酶的提取
通常用氯仿和乙醇提取碳酸酐酶。如表1所示,对四种不同比例的氯仿和乙醇对酶的提取和纯化进行了评价。将悬浮液搅拌并分离,除去过量的氯仿和沉淀,上清液除去任何残留沉淀物。
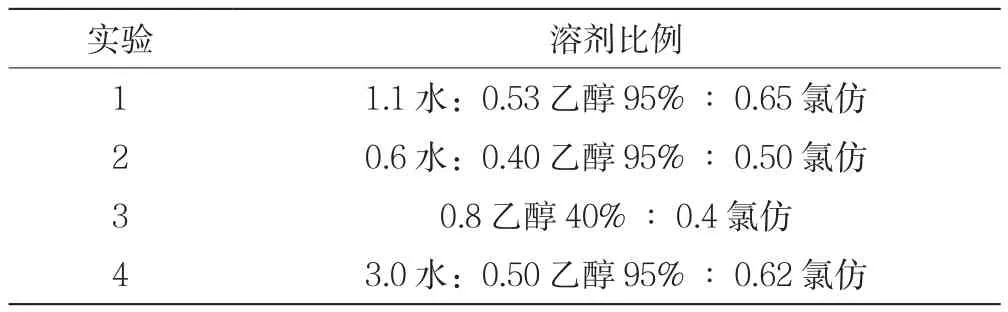
表1 采用水、乙醇和氯仿的比例进行研究
利用硫酸铵沉淀法纯化碳酸酐酶。将碳酸酐酶提取液置于锥形溶液中,加入不同量的硫酸铵,得到10%~80%的硫酸钠。在10℃下放置14小时后,4℃下将4700 g样品分离30分钟,分离上清液,将沉淀悬浮在去离子水中。在上清液和沉淀物中测定酶活性和总蛋白含量。
纯化的碳酸酐酶被用来作为二氧化碳捕获的催化剂,以CaCO3的形式沉淀。反应混合物包括:7.5毫升纯化酶提取液,7.5毫升1.2M的Tri-HCl缓冲液,含有4.5%(W/V)氯化钙的溶液(pH值为10.5)和30毫升二氧化碳溶液。用气态二氧化碳将去离子水在压力为0.1 MPa和温度为5℃的条件下制备二氧化碳溶液,当二氧化碳溶液加入到密封环境中时,反应开始。在所有实验中,将温度保持在5℃,然后分别在10分钟和20分钟的反应后对混合物进行过滤和干燥,以确定CaCO3沉淀的重量(酶测定法)。同时,用去离子水代替酶(非酶法)制备样品,并将结果表示为酶法测定值与非酶法测定值之间的差值。为了在二氧化碳捕获中使用,用硫酸铵沉淀法纯化酶需要除去盐,反应于4℃进行。
4 碳酸酐酶稳定性测试
4.1 微生物碳酸酐酶热稳定性的研究
提取的碳酸酐酶分别在10℃、40℃和60℃下分别处理15分钟、30分钟和45分钟,并对酶处理活性进行测试。从处理时间可以看出,三个不同处理时期相对酶活性的变化趋势是一致的。在相同的温度下,随着处理时间的延长,酶活性下降,但在30℃时,酶在30分钟处理期间的相对活性比15分钟处理提高约7%,但45分钟处理的活性低于15分钟和30分钟。但随着时间不断增长,碳酸酐酶的活性可能丢失。从处理温度来看,碳酸酐酶的活性保持在10~30℃,特别是在20℃时,酶活性提高到一定水平。当处理15分钟时,活性提高12%,但当温度升高至40℃时,活性可能下降到80%以下。超过50℃后,活性明显下降,15分钟后只剩下50%的活性。此外,酶活性将继续下降,当温度为60℃时,活性仅维持在20%以下,说明高温可以抑制碳酸酐酶的活性。当温度在10~40℃之间时,酶可以保持良好的活性,因此,用碳酸酐酶处理循环冷却水系统不应太高,或者酶的作用可能受到严重影响。酶的预处理应在放入高温系统之前进行。Raju指出,用凝胶材料固定碳酸酐酶可以提高酶的稳定性和使用期限。
4.2 pH对微生物碳酸酐酶的影响
提取的碳酸酐酶分别在pH5.0、pH6.0、pH7.0、pH8.0、pH9.0中分别处理1小时,并对其酶活性进行检测。
4.3 金属阳离子对微生物碳酸酐酶的影响
制备了一定浓度的 Zn2+、Ca2+、Mg2+、Fe2+、Hg2+、K+和Na+金属阳离子溶液,然后将其与萃取的碳酸酐酶以一定比例混合,使金属离子混合物的浓度分别达到0.01moL/L、0.10moL/L和1.00moL/L,并在室温下放置1小时,对处理后的酶活性进行测试。
4.4 阴离子和抑制剂对微生物碳酸酐酶的影响
制备了一定浓度的SO42-、NO3-、Cl-、Br-和 I-阴离子溶液,以及乙酰唑胺、磺胺和氰化物,然后在一定比例下与萃取的碳酸酐酶混合,使混合离子浓度达到设计浓度。将混合物置于室温下1小时,并测定处理后的酶活性,以确定阴离子对碳酸酐酶浓度的影响。
测试结果采用方差分析和Tukey检验,考虑95%的置信水平(P<0.05)。
5 氯仿-乙醇萃取法分离碳酸酐酶
用乙醇沉淀法和氯仿法对四种酶进行了提取和纯化。结果显示在表2中。表2表明PF在统计学上相似(P<0.05)。对于%R,在试验中获得了该反应的最高值(98%),与其他酶活性(2623 U/mL)有统计学差异。
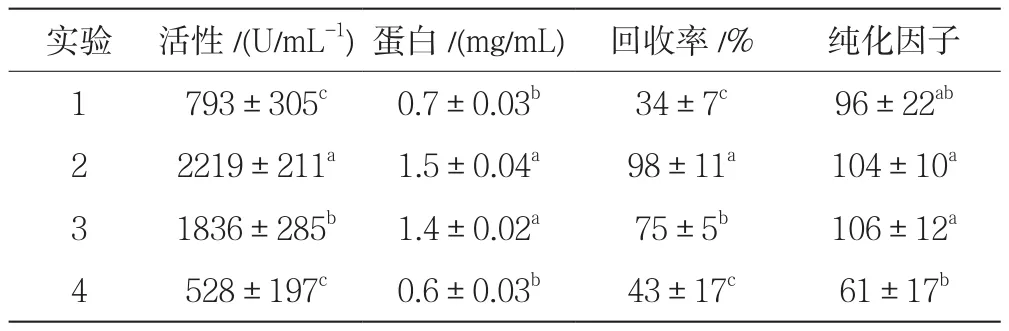
表2 用乙醇和氯仿提取碳酸酐酶中的酶活性、回收率和纯化因子的方法和标准偏差
6 碳酸酐酶溶解碳酸钙的性能研究
将碳酸钙大颗粒研磨,取1克碳酸钙颗粒,分别放入几个1升锥形烧瓶中。同时,在烧瓶中加入500.0毫升去离子水。设置了三个实验组,加入10.0mL碳酸酐酶作为实验组,加入10.0毫升碳酸酐酶和碳酸酐酶抑制剂乙酰唑胺作为对照组,1×10-4mol/L,此外,加入10.0毫升去离子水作为空白组。在室温下应放置三组锥形烧瓶,以80转/分钟的速度摇动,每隔2小时后取样。实验持续24小时。将样品用于pH值、电导率、Ca2+浓度和总硬度的测定,从而研究碳酸酐酶对碳酸钙溶解的影响。
当使用硫酸铵沉淀技术时,首要掌握的是蛋白质和任何干扰物沉淀的盐浓度的范围,从而允许生物分子的纯化。在本例中,通过改变硫酸铵饱和度在10%和80%之间进行试验。在10%和50%的饱和百分率下没有蛋白沉淀,因此在这些百分比下没有分析活性。在70%和80%之间的饱和百分比中,观察到酶(CA)和血红素都完全沉淀,因此不可能将两者分离。然而,在使用60%硫酸铵饱和的试验中,大部分的钙沉淀,相当数量的酶留在上清液中。根据这些结果,用硫酸铵饱和60%和硫酸铵65%倍进行了新的试验,得到了酶活性、PF和酶活性的平均值和标准偏差。
%R显示在表3中,在95%置信水平上的平均值没有显著性差异。从表3可以看出,在60%和65%饱和度下得到的上清液中的%R以及在两种沉淀中得到的%R和PF的值基本相同(P<0.05)。此外,在上清液和沉淀(60%饱和度)中回收的血红蛋白的值在统计学上是相等的。60%的饱和度是PF(1.4倍)和%R(66%)的最佳结果。65%的饱和不足以满足酶的要求,因为几乎所有的血球蛋白都随着钙沉淀,不可能分离这两类分子。用该方法测定的PF值低于乙醇/氯仿法测定的PF值。然而,根据预期的应用,不需要高程度的纯化因子,但有必要验证任何残留血红蛋白对二氧化碳捕集目的碳酸酐酶性能的影响。
7 结论
本文研究了微生物碳酸酐酶的特性,研究了碳酸钙颗粒对碳酸酐酶的溶解作用。最后,在二氧化碳捕集实验中获得的结果表明,提取的碳酸酐酶不仅提高了二氧化碳的水合作用,而且促进了CaCO3的形成。

表3 用硫酸铵沉淀碳酸酐酶的酶活力、纯化因子和回收率和血红蛋白回收率
结果表明,在10~40℃的环境中,酶能保持良好的活性,但一旦温度超过60℃,酶活性可能受到严重的影响。在中性和碱性环境中,即pH值在7.0~9.0时,对碳酸酐酶活性的影响最小,在酸性环境中对酶活性有严格的限制。Ca2+、Mg2+、K+和Na+对碳酸酐酶的活性影响不大,但Fe2+和Zn2+的浓度对碳酸酐酶的活性有增强作用,Zn2+的增强作用极为明显,Hg2+对碳酸酐酶的活性有严重的影响。碳酸酐酶SO42-浓度为 200 .0 MoL/L,Cl-为 180.0MoL/L。NO3-、I-和Br-在一定程度上抑制了碳酸酐酶。
