植物五环三萜类化合物生物合成途径研究进展
2021-06-11李传旺郑东然李玉花
李传旺 ,张 贺 ,饶 攀 ,郑东然 ,王 宇 *,李玉花 *
1.黑龙江省植物天然活性物质的生物合成与利用重点实验室,黑龙江 哈尔滨 150040
2.东北林业大学 东北盐碱植被恢复与重建教育部重点实验室,黑龙江 哈尔滨 150040
萜类是分子骨架以异戊二烯单元为基本结构单元的化合物及其衍生物,普遍存在于自然界中,是构成植物香精、树脂、色素等次生代谢物的主要成分。根据萜类分子中异戊二烯单位数目的不同可分为单萜、倍半萜、二萜、二倍半萜、三萜、四萜、多聚萜等。三萜类化合物是一类基本母核由30 个碳原子组成的重要植物次生代谢产物,在自然界中以游离形式或与糖结合成苷或酯的形式广泛存在,具有抗癌、抗病毒、降低胆固醇等药理作用。三萜类物质根据结构中含环数量的不同又分为单环三萜、双环三萜、三环三萜、四环三萜和五环三萜等,其中四环三萜和五环三萜化合物种类较多。五环三萜类化合物的碳骨架存在多种修饰类型,结构复杂多样,使其具有多种功能而被广泛关注。根据其苷元的不同,可分为齐墩果烷型(如齐墩果酸、甘草酸和山楂酸)、羽扇豆烷型(如白桦酸、羽扇豆醇和白桦脂醇)、乌苏烷型(如熊果酸和积雪草酸)和木栓烷型(如雷公藤红素)4 大类,见图1。

图1 五环三萜化合物的4 种主要类型Fig.1 Four main types of pentacyclic triterpenoids
五环三萜类化合物具有广泛的药理作用和重要的生物活性,尤其在抗炎、降血糖、抗肿瘤以及抗艾滋病等方面已经显现良好的药理特性。如白桦脂醇能通过增加脂肪细胞中过氧化物酶体增殖物激活受体-γ(peroxisome proliferator-activated receptor-γ,PPAR-γ)的活性,增强胰岛素刺激葡萄糖的吸收[1];熊果酸可通过减少视网膜血管内皮生长因子、环氧化酶-2 和基质金属蛋白酶2 表达,抑制新生血管的形成,通过抵抗氧化应激延缓糖尿病视网膜病变的发展[2];积雪草酸通过抑制氧化应激和恢复线粒体功能,改善缺血/再灌注诱导的大鼠肝损伤和缺氧/复氧诱导的大鼠肝线粒体损伤[3];此外,Jamkhande等[4]研究发现山楂酸具有与抗坏血酸类似的抗氧化活性。近些年来,研究者们不仅对五环三萜类化合物药理学功能的研究日益增多,而且更多研究者开始关注对五环三萜类化合物生物合成途径的解析,并取得了一些进展。
1 五环三萜类化合物骨架的合成
植物三萜类化合物的合成主要是通过胞质中的甲羟戊酸(mevalonate,MVA)途径和质体中的甲基赤藓糖醇磷酸(2-C-methyl-D-erythritol-4-phosphate,MEP)途径。质体中由丙酮酸和甘油醛-3-磷酸经由7 个酶反应来合成异戊烯二磷酸(isopentenyl pyrophosphate,IPP),IPP 被运输至胞质中参与萜类合成。在 IPP 异构酶(isopentenyl diphosphateisomerase,IDI)的作用下,IPP 与二甲基烯丙基焦磷酸(dimethylallyl pyrophosphate,DMAPP)相互转换。在胞质的MVA 途径中,乙酰辅酶A 为初始供体生成IPP;IPP 与DMAPP 在二磷酸合成酶(farnesyl pyrophosphate synthase,FPS)作用下转化成二磷酸(farnesyl diphosphate,FPP),又在鲨烯合成酶(squalene synthase,SQS)的作用下合成角鲨烯,然后经鲨烯环氧酶(squalene epoxidase,SE)催化转变为2,3-氧化鲨烯[5]。2,3-氧化鲨烯经过氧化鲨烯环化酶(oxido squalene cyclase,OSC)的环化生成各种四环和五环三萜类骨架。然后这些骨架依赖细胞色素P450 单加氧酶(cytochrome P450,CYP)和以尿苷二磷酸(uridine diphosphate glycoside,UDP)为糖基供体的糖基转移酶(UDP-glycosyltransferase,UGT)进行氧化、置换及糖基化等化学修饰,最终生成各种五环三萜类化合物(图2)。
2 OSC 环化2,3-氧化鲨烯生成五环三萜类化合物骨架
OSC 可催化2,3-氧化鲨烯生成甾醇和三萜类前体物质,是该反应的关键酶,也是产生三萜类产物多样性的关键步骤。OSC 可催化2,3-氧化鲨烯环化生成100 多种不同碳骨架的三萜类化合物,其催化的环化作用是经一系列的质子化、环化、重排和去质子化作用完成的。OSC 催化2,3-氧化鲨烯环化为不同的构象而形成不同的三萜骨架,如大多数四环骨架甾醇,包括环阿屯醇、羊毛甾醇和帕克醇,都是通过椅式-船式-椅式(chair-boat-chair,C-B-C)构象衍生出来的。而达玛烷型四环三萜骨架和大多数五环三萜骨架,包括羽扇豆醇和β-香树脂醇都是通过椅式-椅式-椅式(chair-chair-chair,C-C-C)构象的达玛烯基阳离子形成[6]。OSC 以基因家族形式存在,该家族成员具有DCTAE 和QW 等高度保守序列。保守序列DCTAE 可能与底物结合相关,保守序列QW(QXXXXXW)是带有负电性的芳香族氨基酸区域,其作用是在2,3-氧化鲨烯环化反应中稳定碳阳离子,这些重复序列可能与稳定蛋白质结构和其功能相关。
随着现代生物技术的不断发展,越来越多的OSC基因被分离和克隆出来。截至目前已经在拟南芥、大豆、苜蓿、白桦、人参、甘草等植物中都发现了参与五环三萜类化合物生物合成的OSC(表1)。这些OSC主要催化生成4 种不同的五环三萜骨架:α-香树脂醇、β-香树脂醇、羽扇豆醇和木栓酮(图2-A)。有些植物中存在多个β-香树脂醇合成酶,如苹果、人参和苜蓿等植物存在催化活性不同的β-香树脂醇合成酶[7-9],且OSC 基因具有组织表达特异性,不同的OSC 负责不同组织的三萜类化合物的合成;而有些植物的OSC 具有多重功能,如雷公藤TwOSC1 可以将2,3-氧化鲨烯环化同时生成β-香树脂醇、α-香树脂醇和木栓酮[10],紫荆花BfOSC1 可以将2,3-氧化鲨烯环化同时生成β-香树脂醇、α-香树脂醇和羽扇豆醇[11]。


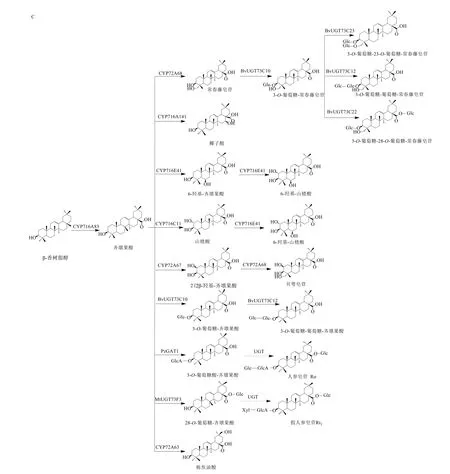
图2 五环三萜类化合物的合成途径Fig.2 Synthetic pathway of pentacyclic triterpenoids

表1 五环三萜类化合物生物合成相关的OSC 信息Table 1 OSC related to biosynthesis of pentacyclic triterpenoids
3 CYP450 对五环三萜类化合物的修饰
CYP450 是广泛存在于动物、植物、细菌及真菌等细胞内的血红素-铁硫蛋白,由血红素蛋白、黄素蛋白及磷脂组成,相对分子质量约5×104,具有一个保守的血红素结构域。CYP450 家族成员之间的一级结构差异较大,但空间结构十分相似,均具有由含铁血红素和半胱氨酸组成的活性中心,活性中心的铁离子一侧与半胱氨酸的硫络合,另一侧与水中的氧分子络合。绝对保守的半胱氨酸与催化活性中心亚铁血红素中铁元素形成硫醇盐离子键,成为铁的一个配体[39],从而使CYP450 中的铁能与一氧化碳络合,在波长450 nm 处有最大吸收峰,CYP450也由此得名。
目前,已鉴定出约67 种CYP450 可以修饰植物五环三萜类骨架(表2),其中大多数属于CYP716家族成员。其他CYP450 家族CYP51、CYP71、CYP72、CYP87、CYP88 和CYP93 也参与对五环三萜的修饰[39]。
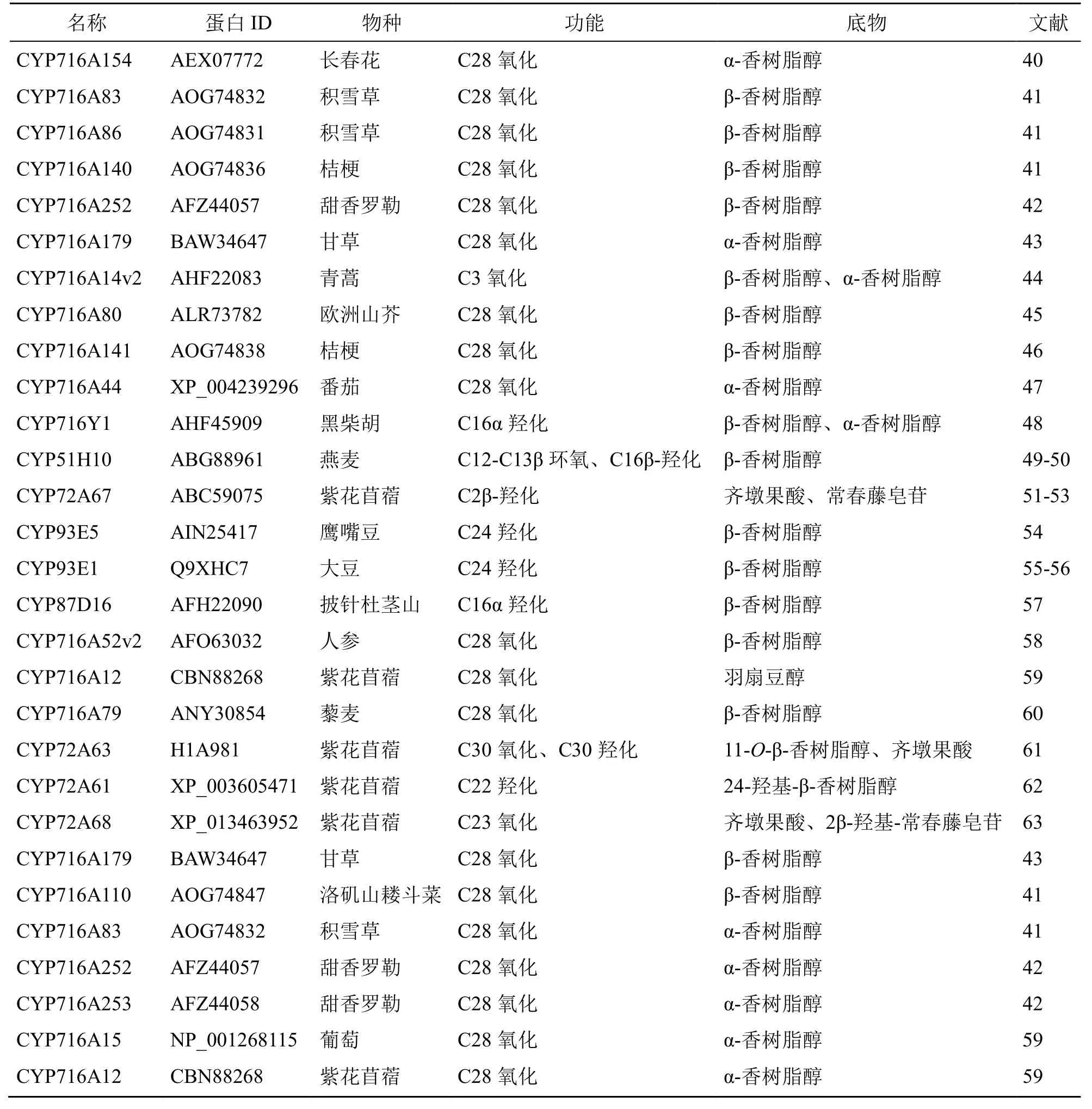
表2 五环三萜化合物生物合成相关的CYP450s 信息Table 2 CYP450s related to biosynthesis of pentacyclic triterpenoids

续表2
3.1 CYP716 家族对五环三萜类化合物的修饰
大部分植物CYP716 家族可以参与五环三萜类骨架的修饰。CYP716 家族参与五环三萜类化合物生物合成的第1 个证据来自拟南芥,研究显示CYP716A1 和CYP716A2 与PEN3(OSC)共表达[40]。此后,结合代谢组、转录组和基因组分析,从植物中鉴定出了其他CYP716A 家族[41-43]。Carelli 等[44]发现CYP716A12 可以催化β-香树脂醇C28 位的连续3 步氧化生成齐墩果酸。之后利用异源体系进行体外和体内研究,发现CYP716A12 还可以将α-香树脂醇和羽扇豆醇C28 位置连续3 步氧化分别生成熊果酸和桦木酸。大约40 种CYP716A 具有香树脂醇、羽扇豆醇C28-氧化酶活性。这些CYP716A 大多数催化香树脂醇、羽扇豆醇骨架C28 的连续3 步氧化,分别连续形成羟基、醛基和羧基。一些植物的CYP716A 也靶向香树脂醇骨架的其他碳原子,如作用于C22α 羟化的拟南芥CYP716A2,作用于C3 氧化的青蒿CYP716A14v2 和作用于C16β 羟化的青蒿CYP716A111 和桔梗CYP716A141[41,45-46]。
除 CYP716A 亚家族成员外,CYP716C、CYP716E、CYP716S 和CYP716Y 亚家族成员也能够氧化五环三萜骨架。积雪草CYP716C11 催化齐墩果酸、6β-羟基齐墩果酸和熊果酸的C2α 羟基化[41];番茄CYP716E26 和积雪草CYP716E41 具有分别以α-香树脂醇、β-香树脂醇和齐墩果酸、熊果酸、山楂酸为底物的C6β-羟化酶活性[41,47];桔梗CYP716S5则能催化β-香树脂醇和齐墩果酸的C12-C13α 环氧化。此外,柴胡CYP716Y1 是一种C16α-羟化酶,它对β-香树脂醇和α-香树脂醇骨架具有修饰作用[41,48]。
3.2 CYP 其他家族对五环三萜类化合物的修饰
CYP51H 是专门修饰五环三萜骨架的亚家族。CYP51H10 催化β-香树脂醇C 环C12-C13β-环氧化和β-香树脂醇D 环的C16 位β-羟基化,最终形成12,13β-环氧-16β-羟基-β-香树脂醇,即燕麦白蛋白生物合成途径的中间体[49-50]。CYP72A 亚家族成员也普遍参与五环三萜类化合物的生物合成,苜蓿和甘草的CYP72As 与豆类特异性五环三萜类化合物的生物合成有关。已报道有 4 种苜蓿 CYP72A(CYP72A61、CYP72A63、CYP72A67 和CYP72A68)和一种甘草CYP72A(CYP72A154)参与齐墩果烷五环三萜骨架的氧化[51-53]。CYP72A67 和CYP72A68分别属于C2β-羟化酶(齐墩果酸、常春藤C2β-羟化酶)和C23-氧化酶(齐墩果酸酸、常春藤、2β-羟基常春藤C23-氧化酶)[51,53]。CYP88D6 是与乌拉尔甘草甜素生物合成相关的酶[54]。CYP88D6 催化β-香树脂醇C11 位的连续2 步氧化以产生CYP72A154 的底物11-氧代-β-香树脂醇。CYP93E 亚家族成员参与豆科植物三萜皂苷的生物合成[55]。大豆CYP93E1 被第1 个证明属于C24-羟化酶[56],它将β-香树脂醇和槐二醇转化为24-羟基-β-香树脂醇和大豆皂苷B。迄今为止,8 种豆科物种已鉴定出8 种CYP93E(E2-E9),它们均具有C24-羟化酶活性。而杉木CYP87D16是目前发现的与五环三萜骨架修饰相关的唯一CYP87D 亚家族成员[57],CYP87D16 通过催化β-香树脂醇C16α-羟基化参与五环三萜类化合物的合成。
4 UGT 对五环三萜类化合物的修饰
在五环三萜类化合物合成过程中,骨架的糖基化是关键的修饰反应,该反应通过糖基转移酶来实现。糖基转移酶使糖基和天然产物之间形成特定的糖苷键来合成糖苷类化合物,通过糖基化反应参与维持细胞代谢稳态。糖基转移酶能够识别多种受体,催化活化的糖基从供体分子转移到受体分子上,改变受体分子的化学稳定性、水溶性以及受体分子的转运能力和生物活性等,进而有助于提高其生物利用度和生物活性等。
糖基转移酶是高度分化的超级酶家族,随着对其研究的深入,越来越多的糖基转移酶被鉴定出来。截至目前,碳水化合物活性酶数据库(carbohydrateactive enzyme database,CAZy)中共收录了高达736 091 个不同物种的糖基转移酶氨基酸序列,包括17 115 个尚未分类的序列。根据糖基转移酶序列的相似度、催化底物的特异性和催化产物的立体化学结构,CAZy 数据库将糖基转移酶分为111 个家族(GT1~GT111),同一家族成员间的氨基酸序列一致性高于40%,而同一亚家族成员间氨基酸序列一致性高于60%[64]。参与植物次生代谢的糖基转移酶主要分布在GT1 家族。GT1 家族糖基供体为核苷- 2-磷酸糖,其中UGT 的供体分子主要包括UDP-葡萄糖、UDP-葡萄糖醛酸、UDP-鼠李糖和UDP-木糖等[65-67]。
五环三萜类化合物的糖链合成是通过将UDP的糖基转移至皂苷元上的连续反应来实现的。目前,在大豆、燕麦、山芥、甘草以及苜蓿等植物中已鉴定出31 种参与植物五环三萜类化合物后修饰的糖基转移酶(表3),对这些已知功能的UGT 利用neighbor-joining 的方法构建了系统进化树(图3),发现这些糖基转移酶主要分布在UGT73、UGT74、UGT91、UGT99 等家族。
4.1 UGT73 家族对五环三萜类化合物的修饰
在植物中,大多数UGT73 家族糖基转移酶被发现参与五环三萜类化合物的糖基修饰,负责在齐墩果酸、常春藤皂苷等的C3、C23 和C28 位转移糖基。目前,在山芥中找到了10 种参与五环三萜类化合物糖基修饰的UGT,Augustin 等[68]发现糖基转移酶UGT73C10 和UGT73C11 可以催化常春藤皂苷和齐墩果酸的C3 位葡萄糖糖基化,UGT73C12 和UGT73C13 可以连续催化常春藤皂苷以及齐墩果酸的C3 位转移2 个葡萄糖基生成3-O-葡萄糖-葡萄糖-常春藤皂苷和3-O-葡萄糖-葡萄糖-齐墩果酸。在其他植物中,Naoumkina 等[71]用全面的基因表达聚类分析鉴定得出苜蓿糖基转移酶UGT73F3 可以催化常春藤皂苷以及齐墩果酸的C28 位羧基的葡萄糖基化。另外,Achnine 等[70]通过对苜蓿转录谱和代谢谱的整合分析确认苜蓿中的糖基转移酶UGT73K1可以分别催化常春藤皂苷C3、C28 位2 个不同位置的葡萄糖糖基化,同时发现UGT73K1 可以催化大豆皂苷C3、C22 和C23 位的葡萄糖糖基化。Shibuya等[76]通过比对大豆和蒺藜苜蓿的表达序列标签信
息,成功鉴定出大豆中参与大豆皂苷I生物合成的糖基转移酶UGT73P2,体外酶活分析显示UGT73P2从UDP-半乳糖中转移1 个半乳糖基至大豆皂苷B单葡糖醛酸苷上从而合成大豆皂苷Ⅲ。Sayama 等[80]发现大豆糖基转移酶UGT73F4 和UGT73F2 依次从UDP-木糖基和UDP-葡萄糖基中转移糖基至大豆皂苷A 的C22 位生成22-O-木糖-葡萄糖-大豆皂苷A。
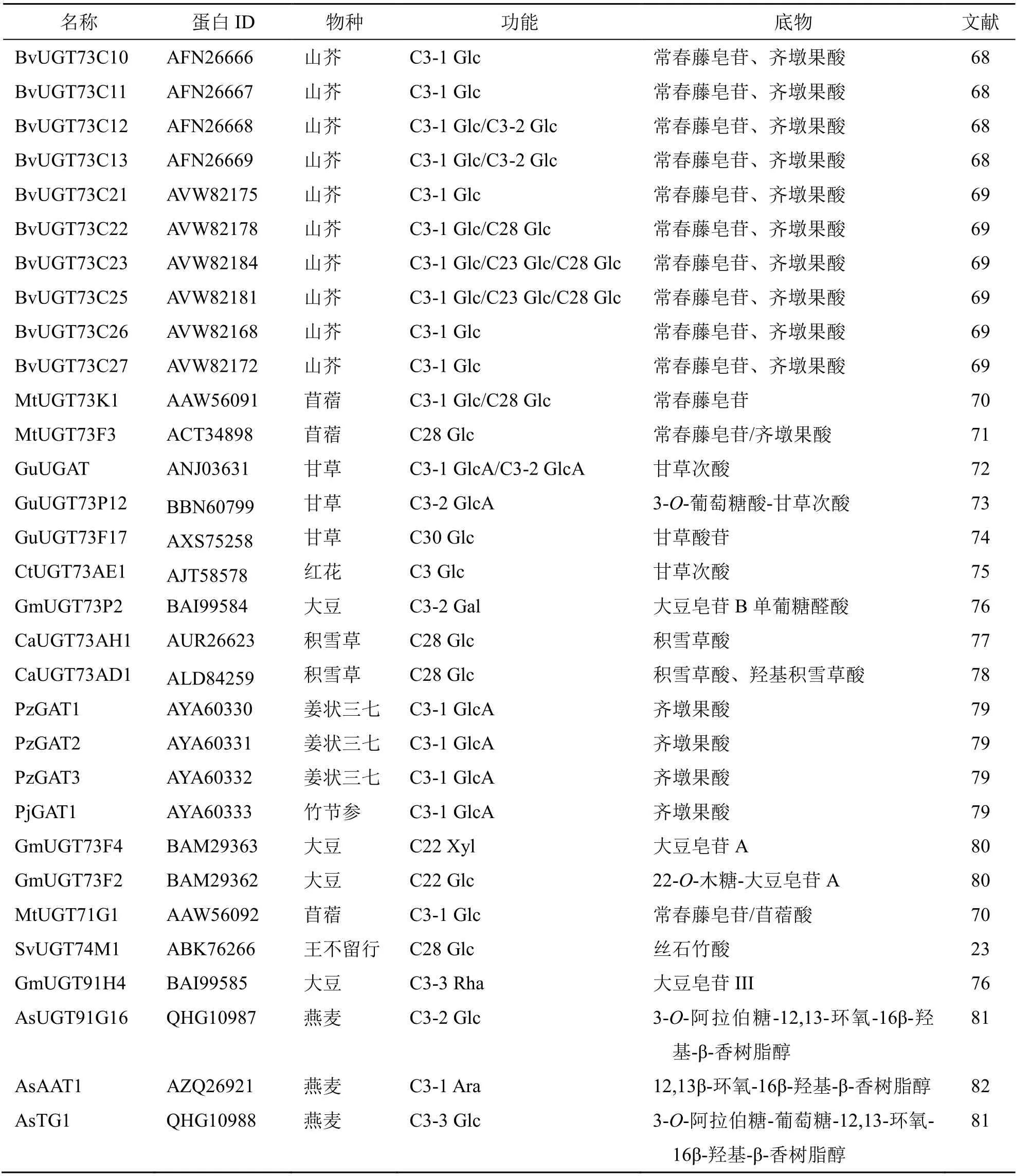
表3 五环三萜类化合物合成相关UGTs 信息Table 3 Summary of UGTs related to the synthesis of pentacyclic triterpenoids
在UGT73 家族中,存在一类特异识别UDP-葡糖醛酸基的UGT,如Tang 等[79]从姜状三七以及竹节参中发现了PzGAT1、PzGAT2、PzGAT3、PjGAT1 4 个糖基转移酶,它们具有相同的功能,可以催化齐墩果酸的C3 位葡萄糖醛酸化。其中,姜状三七中发现的3 个葡萄糖醛酸基糖基转移酶均属于UGT73 家族,并且相互之间序列差异较小,同在姜状三七根部特异表达。Nomura 等[73]发现糖基转移酶UGT73P12 通过将UDP-葡糖醛酸的葡糖醛酸基转移至3-O-葡萄糖酸-甘草次酸的C3-2 位来生产甘草酸苷。此外,Xu 等[72]发现了甘草中与香树脂醇合酶协同表达的糖基转移酶GuUGAT,体外验证GuUGAT 可以连续催化甘草次酸的C3-1 和C3-2 位添加葡萄糖醛酸基,最终生成甘草酸苷。
目前只在积雪草中发现了2 个参与乌苏烷型皂苷糖基修饰的UGT,均属于UGT73 家族。de Costa等[78]发现糖基转移酶CaUGT73AD1 可以将积雪草酸和羟基积雪草酸的C28 羧基部分葡萄糖基化。此外,Kim 等[77]通过茉莉酸甲酯处理积雪草叶片后转录组测序分析到6 个糖基转移酶表达显著上调,其中糖基转移酶UGT73AH1 可以催化五环三萜类化合物的糖基化,负责积雪草酸的C28 位葡萄糖基糖基转移。
4.2 其他糖基转移酶对五环三萜类化合物的修饰
除了UGT73 家族,其他家族的UGT 也被报道参与五环三萜类化合物的糖基修饰,如Meesapyodsuk等[23]从石竹科王不留行发育种子的表达序列标签中发现了 1 个五环三萜羧酸葡糖基转移酶UGT74M1,可以从UDP-葡萄糖基中转移1 个葡萄糖基至丝石竹酸C28 位的羧基生成28-O-葡萄糖-丝石竹酸。Shibuya 等[76]发现GmSGT3(UGT91H4)可以从UDP-鼠李糖中转移鼠李糖基到大豆皂苷Ⅲ的C3-3 位生成大豆皂苷I。Achnine 等[70]利用茉莉酸甲酯处理蒺藜苜蓿,结合转录谱、代谢谱和体外功能分析实验发现糖基转移酶UGT71G1 不仅可以催化五环三萜类化合物,催化苜蓿酸和常春藤皂苷C3 位的葡萄糖基糖基化,也可以黄酮类化合物为底物进行糖基修饰,将槲皮素糖基化为多种槲皮素葡萄糖苷。Louveau 等[82]结合转录组学和系统发育学分析,在燕麦中找到了催化12,13β-环氧,16β-羟基-β-香树脂醇的C3-1 位阿拉伯糖糖基转移酶AsAAT1。而后,Orme 等[81]发现在燕麦的基因簇上同时存在1个糖基转移酶AsUGT91G16 和1 个糖苷酶AsTG1,他们共同参与了燕麦皂苷的合成,依次在12,13β-环氧,16β-羟基-β-香树脂醇的C3-2、C3-3 位添加2 个葡萄糖基生成下游燕麦根皂苷合成的前体物质。值得注意的是AsTG1 并不是UGT 家族成员,而是属于GH1 的糖苷酶,与GT 亲缘关系较远(图3),是目前在植物中首次发现具有萜类化合物糖基转移酶活性的糖苷酶。除此之外,亚细胞定位发现糖基转移酶AsUGT91G16 定位在细胞质中,而糖苷酶AsTG1定位在液泡中,说明萜类化合物可以在细胞器之间运输和合成。
4.3 糖基转移酶的特异活性位点
根据糖基转移酶三维结构的折叠特征,可以将其分为GT-A、GT-B、GT-C 和GT-D 4 种类型。目前已经解析的植物糖基转移酶的结构均属于GT-B折叠方式,含有2 个罗斯曼折叠的β/α/β 结构域。目前一共有13 个植物GT 的结构被解析出来,其中MtUGT71G1(PDB ID∶2ACV)[83]是同时作用于五环三萜类化合物和黄酮化合物的糖基转移酶,其晶体结构常被用于参与萜类化合物糖基化的糖基转移酶三维结构的预测(图4-A)。
晶体结构分析发现MtUGT71G1 的N 端结构域和C 端结构域之间形成一条细长的缝隙,其中N 端结构域的保守性较差,主要参与结合糖基受体,但是参与糖基化催化反应的重要氨基酸位点(His22组氨酸和Asp121 天冬氨酸)是高度保守的,分别定点突变His22 和Asp121,糖基转移酶活性完全丧失[84]。糖基供体通过与植物GTC 端结构域PSPG(putative secondary plant glycosyltransferase)区域的氨基酸残基之间的多个氢键相互作用,从而与糖基转移酶稳定地结合。PSPG 无论在长度还是氨基酸序列上都高度保守(图4-C),保守的PSPG 结构单元与糖基供体进行主要的相互作用,构成结合口袋的一面。植物糖基转移酶PSPG 的44 个氨基酸残基中,至少10 个高度保守氨基酸残基与UDP-糖发生直接相互作用,与糖部分形成氢键[85]。如MTUGT71G1 结构中参与供体分子接触的氨基酸残基Trp339、Gln342、 His357 和Glu365 在植物UGTs 一级序列中保守存在。Gln382 在葡萄糖糖基转移酶中保守,而相对的His382 在半乳糖糖基转移酶中保守。Glu381 和Gln382 这2 个位点被推测对于糖基专一性至关重要,Glu381 在有的蛋白中被天冬氨酸所代替。Trp360、Glu381 和Gln382 这3 个残基与糖形成氢键保守存在(图4-B、C)[83],位于糖基供体结合中心的相对保守的苏氨酸Thr143 被认为在糖基供体识别过程中发挥非常重要的作用[86]。
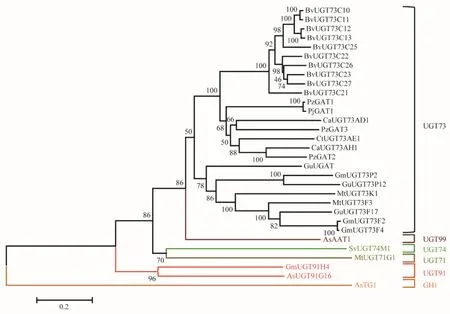
图3 参与五环三萜化合物生物合成的糖基转移酶进化分析Fig.3 Evolutionary analysis of glycosyltransferase involved in biosynthesis of pentacyclic triterpenoids
具有阿拉伯糖糖基转移酶活性的AsAAT1 具有1 个关键的保守组氨酸残基,用于特异性的识别糖供体,位于PSPG 区域的末端。该组氨酸H404 和P154 的突变将AsAAT1 从阿拉伯糖糖基转移酶转化为葡萄糖糖基转移酶[82]。此外,Arg32 被认为是甘草糖基转移酶UGT73P12 的必需氨基酸残基,它对UDP-葡萄糖醛酸具有高度特异的催化能力。Arg32 突变为Ser32,UGT73P12 会失去对葡萄糖醛酸的高特异性,并获得对UDP-葡萄糖和UDP-半乳糖的高选择性。His29 或Asp131 突变,则会导致UGT73P12 蛋白失活[73]。
确定植物UGTs 的糖基供体专一性、受体专一性以及UGTs 催化活性是非常复杂的过程,为了更精确的理解这一过程,解析UDP-葡萄糖以外的糖基供体分子复合物的结构会很有帮助。
5 结语与展望
五环三萜类化合物结构多样,涉及修饰酶基因种类繁多,目前对其合成途径的了解还不够深入,仍需对五环三萜骨架后修饰阶段进行研究。4 种类型的五环三萜类化合物骨架的生物合成途径已经比较完善,但对羽扇豆烷型和木栓烷型皂苷元氧化、羟化等修饰的具体机制了解还知之甚少。糖基转移酶参与糖基修饰时对于位点识别特异性较强,因此,已知糖基转移酶的鉴定和催化机制的研究将会有助于对植物中未知糖基转移酶的挖掘。
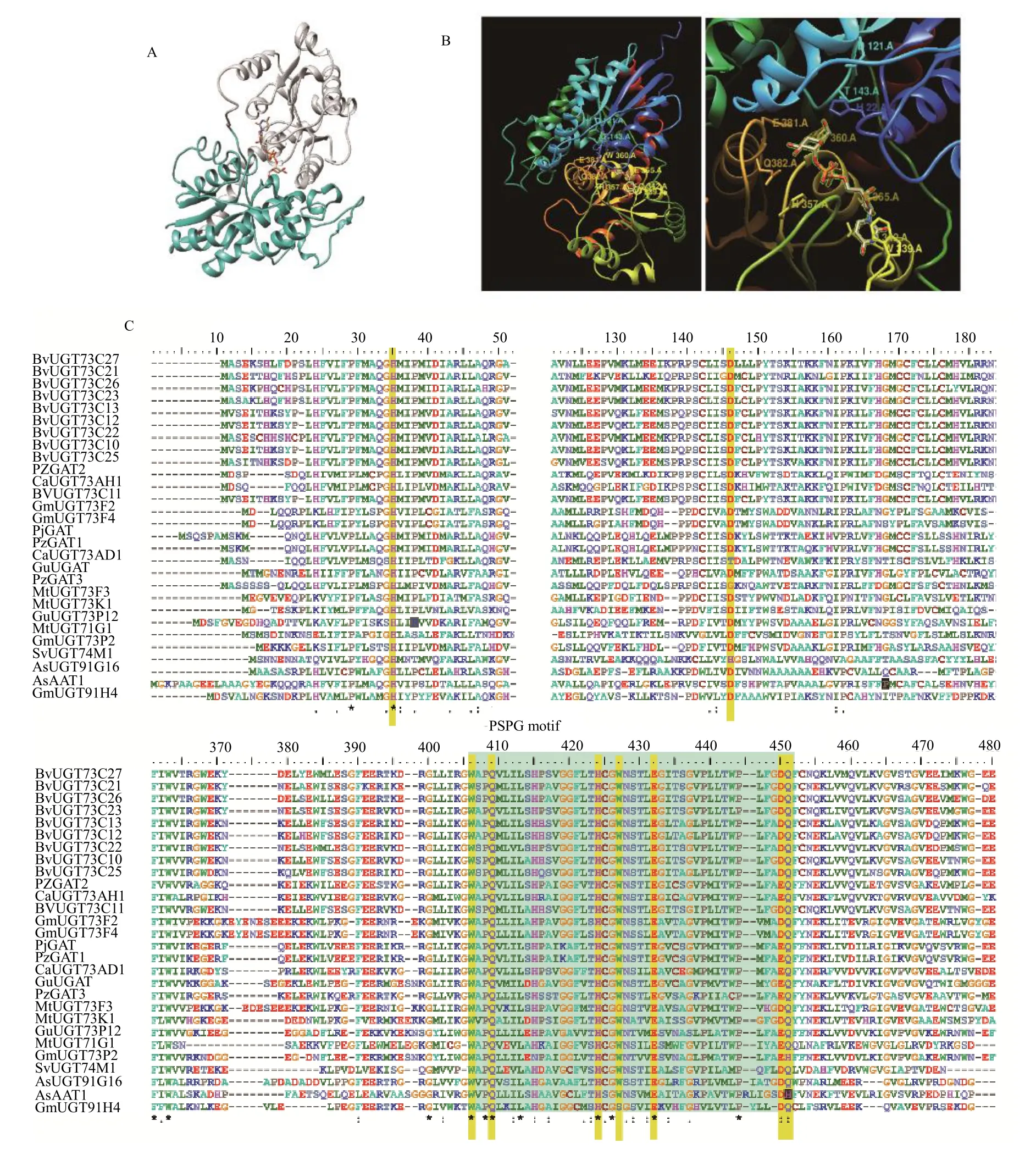
图4 UGT 蛋白三级结构及活性位点分析Fig.4 Analysis of three-dimensional structure and active sites of UGT protein
五环三萜类化合物因其优越的药理活性逐步进入人们的生活,但由于植物中五环三萜类化合物的含量较少,提取步骤复杂,植物资源稀缺,急需开发可以高效合成五环三萜类化合物的方法。随着研 究者们对植物次级代谢产物合成途径研究的深入,以及转基因技术和大规模发酵工艺的快速发展、优化,构建微生物细胞工厂有望代替传统方法来大量合成植物五环三萜类化合物。目前,对五环三萜类化合物异源生物合成已有少量的研究。Liu 等[87]将β-香树脂醇合酶转入酿酒酵母中,通过增加乙酰辅酶A 的代谢通量,提高β-香树脂醇的合成量达到279.0 mg/L;Arendt 等[88]在酿酒酵母中异源合成了齐墩果酸、苜蓿酸、贝萼皂苷、常春藤皂苷、羽扇豆醇和白桦酸等多种五环三萜类化合物,并发现磷脂酸磷酸酶的缺失会导致酵母内质网膜面积增加,从而促进五环三萜类化合物及其糖基化产物的生成。
尽管已有一些成功异源合成五环三萜类化合物的例子,但目前的技术仍未达到工业生产级别。构建高产量的微生物细胞工程合成五环三萜类化合物还存在几个主要限制因素:(1)大部分植物五环三萜类化合物的合成途径尚未解析;(2)部分植物来源的酶在微生物宿主细胞中难以表达,可溶性低;(3)五环三萜类化合物合成过程中需要消耗大量的辅酶和供体;(4)部分五环三萜类化合物对微生物宿主细胞有毒性。针对上述问题,快速发展的代谢组学和基因组学分析技术有助于解决植物代谢途径解析的问题;酶结构改造以及内质网工程的应用可以提高微生物宿主中植物来源酶的表达能力和催化活性;通过合成生物学对宿主代谢流向优化来解决辅酶和供体不足的问题;通过宿主选择和细胞器区域化生产有望解决产物对宿主产生细胞毒性的问题。
利益冲突所有作者均声明不存在利益冲突
