头针抑制脑出血后神经细胞凋亡机制初探*
2021-06-11张菶,邹伟
张 菶,邹 伟
(1.黑龙江中医药大学,黑龙江 哈尔滨 150040;2.黑龙江中医药大学附属第一医院,黑龙江 哈尔滨 150040)
脑出血(Intracerebral hemorrhage, ICH)后血肿、水肿与炎症等病理反应参与了神经细胞凋亡过程,而神经细胞大量凋亡是ICH后神经功能缺损的重要原因之一[1-2]。作为在动物胚胎期决定各种前体细胞分化并参与多种组织器官生长发育的重要通路,Shh通路在成体动物生理及病理条件下,在抑制神经细胞凋亡方面发挥着重要功能[3]。“百会”透“曲鬓”针刺法作为临床治疗脑卒中的常用方法,在改善脑卒中后神经功能缺损方面发挥着重要作用,目前已有研究发现针刺头穴可抑制脑卒中后神经细胞凋亡[4],但该针刺法在ICH后是否可发挥相似作用以及通过何种机制达到这一效果仍待进一步研究。
1 材料与方法
1.1 实验材料
1.1.1 实验动物 75只体质量(250±20)g雄性SD大鼠,购于黑龙江中医药大学实验动物中心[动物许可证号:No.SCXK(Heilongjiang)2013-004]。人工饲养于室温20 ℃、相对湿度50%和光照12 h(7:30—19:30)的环境,每日适量进水进食,造模前12 h禁水禁食。本实验获黑龙江中医药大学动物伦理委员会批准(IACUC:2019-05-13-01),且遵照《实验动物使用与护理指南(2011年,第8版)》[5]执行。
1.1.2 仪器 针灸针(0.3 mm×25 mm,华佗牌,中国);牙钻(Strong90,世新,韩国);立体定位仪(68001,RWD,中国);组织包埋机(TES99,MEDITE,德国);石蜡切片机(HM355S,Thermo Fisher Scientific,美国);光学显微镜(BX53,Olympus,日本);病理图像分析系统(Motic Med6.0,麦克奥迪,中国);低温冷冻离心机(Fresco17,Thermo Fisher Scientific,美国);酶标仪(MultiSkan3,Thermo Fisher Scientific,美国);电泳仪(Powerpac Universal,Bio-Rad,美国);NC膜(0.45 μm孔径,Millipore,美国);凝胶成像分析系统(GelDoc XR+,ProteinSimple,美国)。
1.1.3 试剂 PBS(P1010,Solarbio Technology,中国);Smo一抗(ab113438,Abcam,美国);Gli1一抗(ab151796,Abcam,美国);Smo和Gli1二抗(S004F,TDY Biotech,中国);10×Tris-Glycine-SDS电泳缓冲液(P0014C,Beyotime Biotechnology,中国);上样缓冲液(P0015,Beyotime Biotechnology,中国);丽春红(P0022,Beyotime Biotechnology,中国);ECL(WBKLS0500,Millipore,美国);purmorphamine(S3042,Selleck,美国);TUNEL试剂盒(1684817,Roche,德国)。
1.2 实验方法
1.2.1 造模方法 ICH造模采用Sinar等[6]提出的自体血注入法。大鼠10%水合氯醛以350 mg/kg剂量腹腔注射麻醉,剪毛备皮,俯卧位固定于立体定位仪。手术刀以矢状位沿正中线划开头皮,暴露前囟点,在其向右旁开3.5 mm、向后旁开0.2 mm部位用牙钻钻孔。同时将鼠尾尖剪断,并用微量注射器抽取50 μL自体血后将其固定于立体定位仪上,使针尖对齐钻孔,并使针尖在触及脑表面后再进针6 mm,到达尾状核,将血以20 μL/min速度注入脑内,避免外溢,同时包扎鼠尾伤口。出针后,牙科水泥封闭钻孔,缝合伤口并消毒。手术全程动物体温保持在37 ℃。
1.2.2 成功模型筛选方法 ICH成功模型筛选及干预后神经功能恢复评价均采用Bederson神经功能评分[7],该评分法将神经功能分为:0分:无神经功能缺损;1分:悬尾实验时对侧前爪不完全伸展;2分:对侧前爪抗推力下降;3分:水平放置后向对侧转圈。神经功能评分1~3分为造模成功的标准。
1.2.3 实验分组 实验分假手术组、模型组、模型+针刺组(针刺组)、模型+激动剂组(激动剂组)和模型+非经非穴组(非经非穴组)。实验首日,75只大鼠中随机挑选60只按上述方法复制ICH模型,待苏醒后随机平均分入除假手术组的其他4组中,每组各15只。假手术组造模时用相同剂量生理盐水替代。
1.2.4 干预方法 假手术组和模型组:造模后不做处理。激动剂组:腹腔注射Shh通路激动剂purmorphamine,将其配成1 mg/mL浓度,每日1 mg/kg剂量腹腔注射直至取材[8]。针刺组:每日“百会”透“曲鬓”针刺治疗。本实验挑选我院针灸科5名平均年龄27.9岁且针灸技术成熟的住院医师为针刺组大鼠进行干预。大鼠俯卧位,四肢固定,按《实验针灸学》[9]确定选穴部位,取规格0.3 mm×25 mm针灸针从百会穴(两耳连线中点)向右侧曲鬓穴(右耳屏前缘)透刺,进针深度约20 mm,使针尖刚透过曲鬓穴皮肤表面为度;行针时用拇指和食指把持针柄,手工形式顺逆方向交替捻针,转速200 r/min;每日固定时间行针1次,每次30 min,在此期间共捻针3次,每次6 min,每6 min捻针完毕后休息6 min再进行下一次捻针,休息时留针。非经非穴组:在“百会”透“曲鬓”针刺法水平向后1 cm部位予以针刺,其他与针刺组相同。
1.2.5 取材方法 所有大鼠连续干预5 d后取脑组织,取材前再次通过Bederson评分评价神经功能缺损情况。随后各组15只大鼠中的5只做HE染色,5只做TUNEL检测,5只做western blot。其中,做HE染色和TUNEL检测的大鼠先后用150 mL生理盐水和150 mL 4%多聚甲醛/0.1M PBS(pH=7.2~7.4)灌注后取材,之后4 ℃固定于4%多聚甲醛/0.1M PBS(pH=7.2~7.4)内;做western blot大鼠直接冰上取脑,之后-80 ℃保存。
1.2.6 观察指标检测方法
1.2.6.1 HE染色 组织分别经梯度酒精和100%二甲苯脱水、透明,石蜡包埋后冠状位在出血半暗带区切成厚5 μm切片,依次浸入二甲苯和梯度酒精脱蜡,苏木精染色,0.5%盐酸乙醇液分化,再依次经100%酒精和100%二甲苯脱水、透明,树胶封片,光镜下400倍在出血半暗带观察脑组织病理损伤程度。
1.2.6.2 TUNEL检测 组织固定、脱水、透明、石蜡包埋、切片和脱蜡与HE染色相同。之后0.1%Triton-X-100孵育2 min,避光条件TUNEL反应液37 ℃孵育1 h,DAB显色5 min后苏木精染色。400倍光镜下每张切片在出血半暗带随机选择3个不同视野观察凋亡细胞并计算神经细胞凋亡率。凋亡率=(某视野凋亡阳性细胞/某视野全部细胞)×100%。最后计算3个视野凋亡率平均值。
1.2.6.3 Western blot 组织研磨后冰上裂解30 min,15 000 rpm匀浆、4 ℃离心20 min。样品与BCA液1:8混合,酶标仪570 nm波长读取光密度值。配制8%、12%的SDS-PAGE分离胶和5%浓缩胶,待测蛋白每孔上样20 μg。电泳:浓缩胶恒压90 V,20 min;分离胶恒压160 V,通过预染蛋白marker确定电泳时间。转膜、封闭后加入Smo或Gli1一抗4 ℃过夜,次日取出换二抗孵育40 min,ECL显影,凝胶成像分析系统测量条带IOD值,IOD值与β-actin比值即为最终结果。

2 结果
2.1 针刺对ICH大鼠神经功能缺损的影响
治疗前,模型组、针刺组、激动剂组和非经非穴组Bederson评分与假手术组比较显著升高(P<0.01)。与同组治疗前比较,5 d后模型组、针刺组、激动剂组、非经非穴组神经功能评分显著降低(P<0.01)。疗后针刺组和激动剂组评分分别与模型组比较明显下降(均P<0.01),但针刺组与激动剂组比较差异无统计学意义(P>0.05)。非经非穴组评分虽较模型组比较略有下降,但二者差异无统计学意义(P>0.05),而仍较针刺组和激动剂组明显升高,与两组比较差异均有统计学意义(P<0.01)。同时,疗后针刺组与激动剂组分别同假手术组比较差异无统计学意义(均P>0.05)。见表1。

表1 各组大鼠干预前后神经功能评分比较
2.2 针刺对ICH大鼠出血半暗带区病理损伤的影响
模型组出血半暗带区有血肿形成,周围散在大量红细胞,血肿周围组织间隙、细胞内见明显水肿,组织结构排列紊乱。针刺组出血半暗带区组织结构仍紊乱,但血肿基本消失、水肿明显减轻,可见凋亡、坏死神经细胞。激动剂组与针刺组差异不明显。非经非穴组出血半暗带区有一定数量红细胞浸润,伴细胞水肿、组织间隙增宽及组织排列不规整等现象。而假手术组脑组织相同区域结构完整,无病理损伤。见图1。

注:黑色箭头所示为病理损伤情况。
2.3 针刺对ICH大鼠出血半暗带区神经细胞凋亡的影响
模型组神经细胞凋亡率较假手术组明显升高,结果差异有统计学意义(P<0.01)。针刺组和激动剂组神经细胞凋亡率分别与模型组比较明显下降(均P<0.01),但针刺组与激动剂组比较差异无统计学意义(P>0.05)。非经非穴组神经细胞凋亡率虽较模型组略有下降,但二者差异无统计学意义(P>0.05),而仍较针刺组和激动剂组明显升高,与两组比较差异均有统计学意义(P<0.01)。见图2、表2。
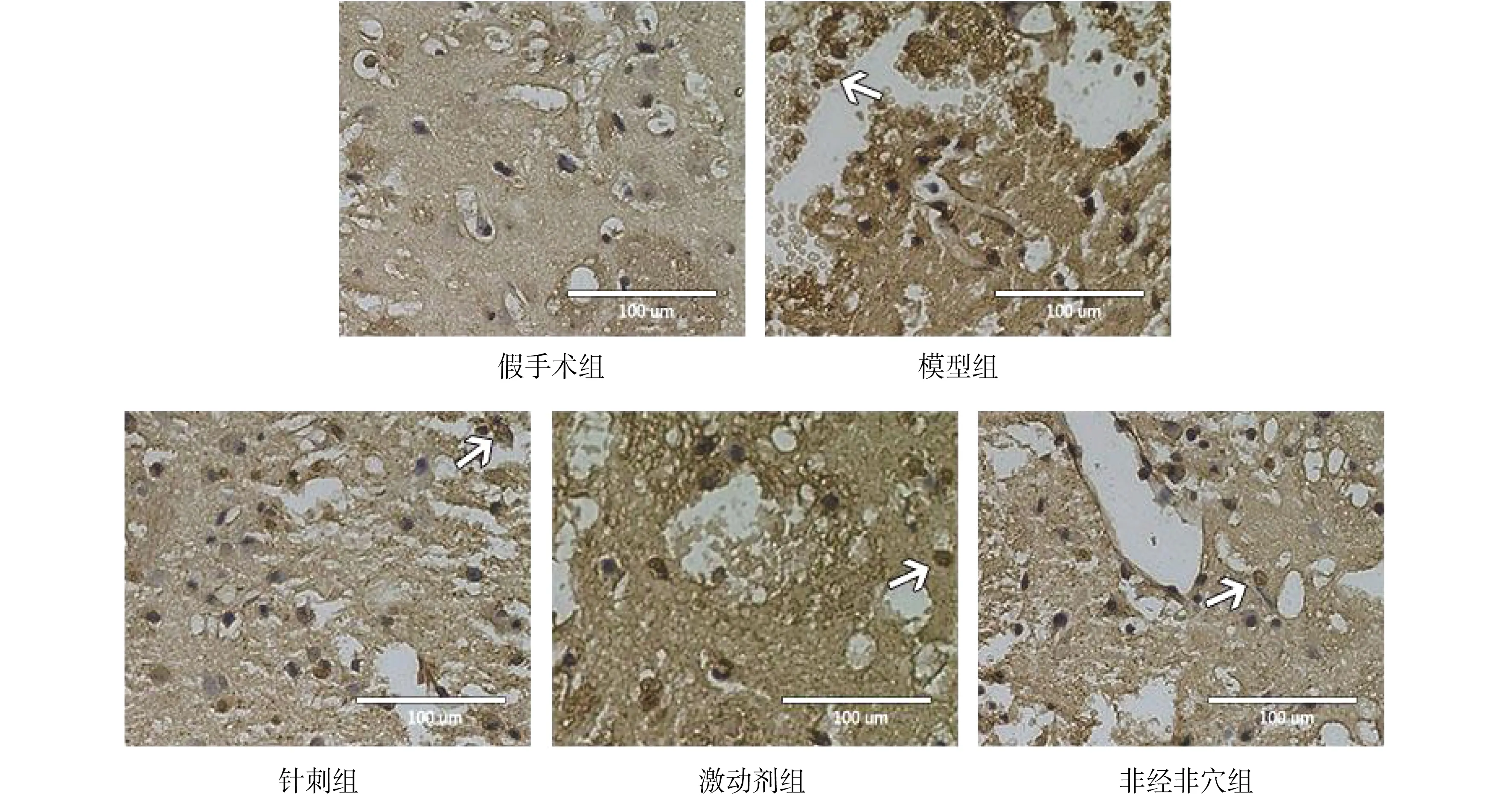
注:白色箭头所指为凋亡细胞。

表2 各组大鼠脑出血半暗带区凋亡细胞率
2.4 针刺对ICH大鼠脑组织Smo、Gli1蛋白表达的影响
模型组Smo蛋白表达较假手术组明显升高,结果差异有统计学意义(P<0.01)。针刺组和激动剂组Smo蛋白表达分别与模型组比较明显升高(均P<0.01),但针刺组与激动剂组比较无统计学意义(P>0.05)。非经非穴组Smo蛋白表达虽较模型组略有升高,但二者差异无统计学意义(P>0.05),而仍较针刺组和激动剂组明显下降,与两组比较差异均有统计学意义(P<0.01)。见图3、表3。

图3 各组大鼠脑组织Smo蛋白表达
模型组Gli1蛋白表达较假手术组明显升高,与假手术组比较差异有统计学意义(P<0.01)。针刺组和激动剂组分别与模型组比较明显升高(均P<0.01),但针刺组与激动剂组比较无统计学意义(P>0.05)。非经非穴组Gli1蛋白表达虽较模型组略有升高,但二者差异无统计学意义(P>0.05),而仍较针刺组和激动剂组明显下降,与两组比较差异均有统计学意义(P<0.01)。见图4、表3。

图4 各组大鼠脑组织Gli1蛋白表达

表3 各组大鼠脑组织Smo、Gli1蛋白表达结果
3 讨论
脑出血在中医学属中风范畴,该病按临床表现可分为中经络和中脏腑。中风病因是外感内伤共同致病的结果,且有虚实之分;按病机可分为肝阳上扰、痰热腑实、风痰瘀阻、气虚血瘀和正气虚脱等证型。但中风病名的变化经历了漫长过程,该词最早见于《素问》的“饮酒中风、新沐中风”,但多指外感风邪致汗出增多。宋元以前医家所指中风病,在临床表现方面与现代所指中风已十分接近,但发病机制方面多认为是外感风邪为主。随着对中风病认识的加深,宋元以后,朱丹溪在《丹溪心法》中提到:“中风大率主血虚有痰”,即中风病因是血虚致脾失濡养,脾虚生痰上犯于脑而致[10],这与现代观点相似。王清任在《医林改错》中认为中风病因应是元气亏损[11],他赞同张景岳的“非风”观点,更强调了中风病并非外感风邪所致。
针刺疗法治疗中风已有近千年历史,唐宋以后更多医家将针刺作为治疗中风的主要手段。元代王国瑞在《扁鹊神应针灸玉龙经》采用头针治疗中风[12],文中提到:“中风不语最难治,顶门发际亦堪施,百会穴中明补泻,及时苏醒免灾危”。明代陈氏在《神应经》中则采用体针治疗中风[13],以上均为中风的针刺治疗提供了理论基础。本实验中选取“百会”透“曲鬓”作为治疗脑出血的唯一方法,其原因在于:百会穴位于头部巅顶,为多条阳经之汇,针刺该穴可振奋脏腑之阳气,促进肢体功能恢复。此外,针刺百会穴可开窍醒神,用于肝阳上亢或痰浊蒙蔽清窍所致昏仆。再者,百会属督脉穴,针刺该穴可促进肾精转输、填补脑髓。曲鬓穴作为头穴之一,常用于治疗头痛、头晕等头疾。而透刺法相较刺激单一穴位而言,一针贯穿二穴,扩大了头皮表面刺激面积。
现代研究认为,“百会”透“曲鬓”针刺法可通过促进神经干细胞增殖[14]、抑制炎症反应[15]、减轻脑组织血肿和水肿[16]等多途径促进ICH后神经功能恢复,且近年也有研究发现,针刺可在脑卒中疾病中抑制神经细胞凋亡[17],但其机制是多方面的。许多实验均表明,Shh信号通路与细胞凋亡密切相关[3,18]。对该通路的抑制不仅在癌细胞中发挥促进细胞凋亡并减少癌细胞增殖的作用[19],同时在肾损伤[20]、骨骼肌缺血再灌注损伤[3]等创伤性疾病中,通过激活该通路Smo、Gli1等蛋白表达,可发挥抑制细胞凋亡的作用。Smo是Shh通路上游蛋白,当该通路被激活后,Smo摆脱了Ptch1的束缚,通过在细胞膜原纤毛表面大量聚集激活下游因子Gli1。Gli基因是1987年Kinzler[21]研究胶质细胞瘤时发现的编码锌指蛋白家族的基因,作为Shh通路的下游因子,当该通路被激活后,Gli1会以激动子形式进入胞核,激活转录,不仅发挥促进细胞增殖的作用,同时也可抑制细胞凋亡[3,18]。
本实验Shh通路关键蛋白Smo和Gli1的western blot结果可看出,激动剂组在模型组一定程度上调两种蛋白表达的基础上,再次上调两种蛋白表达。说明作为Shh通路激动剂的purmorphamine可明显上调该通路关键因子表达,从而激活该通路。而且观察各组凋亡细胞率可知,激动剂组相较模型组神经细胞凋亡率明显下降,结合western blot结果可推测,激动剂组神经细胞凋亡率的下降可能与Shh通路激动剂激活该通路有关。在脑出血半暗带观察神经细胞凋亡的实验中,“百会”透“曲鬓”针刺法作为针刺组唯一干预方法,相较模型组可明显抑制ICH后神经细胞凋亡,且可达到与Shh通路激动剂相同的水平。继而观察western blot结果,针刺组Smo和Gli1蛋白表达与激动剂组差异无统计学意义(P>0.05)。综上可知,“百会”透“曲鬓”针刺法可能通过激活Shh通路抑制ICH后出血半暗带区神经细胞凋亡。
此外,通过HE染色结果可知,Shh通路激动剂purmorphamine和“百会”透“曲鬓”针刺法均可在脑出血半暗带明显改善ICH大鼠各种病理损伤,且达到相似效果。脑出血半暗带血肿、水肿和炎症等病理损伤的缓解亦可为出血区神经细胞凋亡的减轻提供必要的大环境,结合之前实验结果亦可推测“百会”透“曲鬓”针刺法可能通过激活Shh通路改善脑出血半暗带各种病理损伤,继而下调该区域神经细胞凋亡水平,以达到促进神经功能恢复的目的。
