基于GEO差异分析及网络药理学的四逆散治疗溃疡性结肠炎作用机制研究△
2021-06-11杜金鑫杨士伟辛学知
杜金鑫,杨士伟,辛学知*
1.山东中医药大学 第一临床医学院,山东 济南 250014;2.山东第一医科大学 第一附属医院 肛肠科,山东 济南 250014
溃疡性结肠炎(UC)是一种慢性非特异性炎症性疾病,属于炎症性肠病(IBD)的一种,常累及直肠,并持续逆行进入结肠。其病因及发病机制尚无定论,病变主要涉及结直肠黏膜层及黏膜下层,临床表现以腹痛、腹泻、里急后重、黏液脓血便为主,部分患者还会伴有皮肤、肝脏、眼睛或关节等的肠外表现[1]。目前,UC的治疗措施主要有氨基水杨酸类药物、糖皮质激素、免疫抑制剂、新型生物制剂、白细胞吸附疗法、粪菌移植及中医药治疗[2]。
中医古籍中未见UC对应病名的记载,目前多认为其属于中医学“肠澼”“久痢”“大瘕泄”的范畴。2017年,中医专家共识将UC的中医病名归为“久痢”,并将其分为大肠湿热证、热毒炽盛证、脾虚湿蕴证、寒热错杂证、肝郁脾虚证、脾肾阳虚证、阴血亏虚证共7个证型[3]。中医疗法治疗UC取得了较为理想的临床疗效,相比于西医疗法,中医药的优势在于能够长期维持UC缓解期,并能降低复发率[4]。四逆散出自《伤寒论》,由柴胡、白芍、枳实、甘草4味药组成,具有透邪解郁、疏肝理脾之效,可用于治疗泄利下重之证。临床上有多位医家应用四逆散及其加减方治疗UC,且取得了满意的疗效[5-6],动物实验表明,四逆散可能通过调节血清促炎因子[7-8]、抑制炎性通路、调控细胞因子网络平衡[9]来干预UC,但其具体作用机制仍需进一步探究。
本研究利用GEO(Gene Expression Omnibus)数据库及网络药理学方法筛选四逆散有效成分及靶点,与疾病差异基因相互映射取其交集,构建药物-化合物-靶点调控网络并进行通路分析,预测四逆散治疗UC的潜在靶点及作用机制,为进一步研究提供理论依据。
1 方法
1.1 GEO差异基因分析
在GEO数据库(https://www.ncbi.nlm.nih.gov/pubmed/)中以“Ulcerative colitis”为关键词进行检索,选取人类正常样本及UC患者样本均大于10的GEO数据芯片,下载其相关GSE、GPL文件,进行数据整理分组后导入R软件,利用Limma包以|lgFC|>1(FC表示差异倍数)、P<0.05为条件筛选出差异表达基因,利用ggplot2包绘制差异基因火山图;pheatmap包绘制前20位差异基因的热图。
1.2 四逆散中化合物及靶点的收集与筛选
借助中药系统药理学分析平台数据库(TCMSP,http://tcmspw.com/tcmsp.php),分别以“柴胡”“白芍”“枳实”“甘草”为关键词检索四逆散中的化合物成分,以口服生物利用度(OB)≥30%,类药性(DL)≥0.18为标准筛选出符合标准的化合物作为有效成分。再次通过TCMSP数据库平台,将筛选出的四逆散中的有效成分进行检索,查找与之相对应的靶点信息,在UniProt(https://www.uniprot.org/)数据库中查询靶点对应的基因名称进行标准化处理。
1.3 构建药物-化合物-靶点调控网络
将筛选得到的药物靶点基因与疾病差异基因相互映射,得到交集基因,并查找与之相对应的有效成分,整理network、type文件,利用Cytoscape 3.7.2软件进行可视化处理,构建“药物-化合物-靶点”调控网络。
1.4 蛋白质-蛋白质相互作用(PPI)网络构建与拓扑分析
利用Cytoscape 3.7.2软件中的Bisogenet插件构建PPI网络(数据库来源:DIP、BIOGRID、HPRD、INTACT、MINT、BIND)。通过CytoNCA插件进行拓扑结构分析,以度中心性(degree centrality,DC)>61、介度中心性(betweenness centrality,BC)>600为标准,获得PPI核心网络。
1.5 靶点通路分析
利用Bioconductor平台将靶点基因名转化为基因ID,以R软件安装相关Bioconductor安装包,设置P=0.05、Q=0.05进行基因本体(GO)富集分析,保存富集结果并选取生物过程(BP)、细胞组分(CC)、分子功能(MF)各自前20位绘制图形文件。同样方法进行京都基因与基因组百科全书(KEGG)分析,选取富集排名前20位的通路,利用Cytoscape 3.7.2软件进行KEGG关系网络的构建。
2 结果
2.1 GEO差异基因分析
从GEO数据库中下载GSE87466肠道黏膜基因表达数据。所采用的平台为GPL13158[HT_HG-U133_Plus_PM] Affymetrix HT HG-U133+ PM Array Plate,共有21例正常人样本及87例UC患者样本。以|lgFC|>1、P<0.05为条件共筛选出差异表达基因910个,其中上调基因575个、下调基因335个。差异基因火山图及前20位差异基因的热图见图1~2。

注:红色代表上调基因;绿色代表下调基因;黑色代表无差异基因。图1 UC患者上调和下调的差异基因火山图

注:红色代表上调;绿色代表下调。图2 UC患者上调和下调的前20位差异基因热图
2.2 四逆散中化合物成分及靶点的收集与筛选
借助TCMSP数据库共检索到四逆散化合物成分共779种,以OB≥30%、DL≥0.18为标准筛选后得到四逆散关键化合物成分共144种,其中柴胡17种、白芍13种、枳实22种、甘草92种,部分化合物见表1。通过TCMSP数据库查找关键化合物对应的靶点,删除重复靶点后共得到239个有效靶点基因。

表1 四逆散中部分有效成分
2.3 药物-化合物-靶点调控网络构建
将药物靶点基因与疾病差异基因相互映射,共得到32个交集基因,并查找与之对应的有效成分,共得到109个有效成分,其中柴胡7个、白芍3个、枳实16个、甘草79个,另有4个有效成分山柰酚、异鼠李素、槲皮素、柚皮素来源于2味或多味中药。运用Cytoscape 3.7.2软件构建“药物-化合物-靶点”调控网络,具体见图3。运用网络拓扑结构分析得到各节点度值,度值排名前4位的化学成分为槲皮素、山柰酚、木犀草素、川陈皮素,排名前4位的靶点为前列腺素内过氧化物合酶2(PTGS2)、一氧化氮合酶2(NOS2)、过氧化物酶体增殖物激活受体γ(PPARG)、激酶插入区受体(KDR)。

注:橙色菱形代表基因;绿色椭圆形代表有效成分;蓝色长方形为中药。图3 四逆散治疗UC的药物-化合物-靶点网络
2.4 PPI网络构建与拓扑分析
利用Cytoscape 3.7.2软件的Bisogenet插件构建PPI网络,共得到1568个节点,33 863条边;利用CytoNCA插件进行拓扑结构分析,以度值>61为标准筛选后得到366个节点,13 439条边;以BC>600为标准进一步筛选,最终得到核心网络,该网络共包含40个节点、415条边,其中度值排名前10的节点为核仁磷酸蛋白(NPM1)、热休克蛋白A8(HSPA8)、酪氨酸3/色氨酸5-单加氧酶激活蛋白(YWHAZ)、泛素C(UBC)、含缬酪肽蛋白(VCP)、人异质性胞核核糖蛋白A1(HNRNPA1)、热休克蛋白90AA1(HSP90AA1)、热休克蛋白A5(HSPA5)、热休克蛋白90AB1(HSP90AB1)、异质核糖蛋白U(HNRNPU),这很可能是四逆散治疗UC发挥药理作用的关键靶点(图4)。

图4 四逆散治疗UC的PPI核心网络获取过程
2.5 靶点通路分析
利用R软件对32个交集基因进行GO富集分析和KEGG通路分析,共筛选得到661个GO条目(P<0.05)及42条KEGG通路(P<0.05)。选取GO富集前20位条目绘制气泡图(图5),可见靶点显著富集于对脂多糖的反应、对细菌源分子的反应、白细胞迁移等生物过程;脂阀、膜微区、膜区等细胞组分;细胞因子活性、受体配体活性、细胞因子受体结合等分子功能。

图5 四逆散治疗UC靶点的GO富集分析
同样选取KEGG通路分析前20位绘制柱状图(图6),可见疾病方面靶点显著富集于流体剪应力与动脉粥样硬化、类风湿性关节炎、疟疾等。生物通路主要涉及肿瘤坏死因子(TNF)信号通路、白细胞介素-17(IL-17)信号通路、糖尿病并发症中糖基化络末产物及其受体(AGE-RAGE)信号通路、Toll-样受体信号通路、核转录因子-κB(NF-κB)通路等。利用Cytoscape 3.7.2软件构建“靶点-通路”网络,如图7所示,图形大小与连接点数目相关,连接点越多图形越大,可见TNF通路(hsa04668)与12个靶标相关联,是所有通路中与疾病靶标相关数最多的通路,因此TNF通路很可能是四逆散治疗UC的关键通路。

图6 四逆散治疗UC靶点的KEGG通路分析
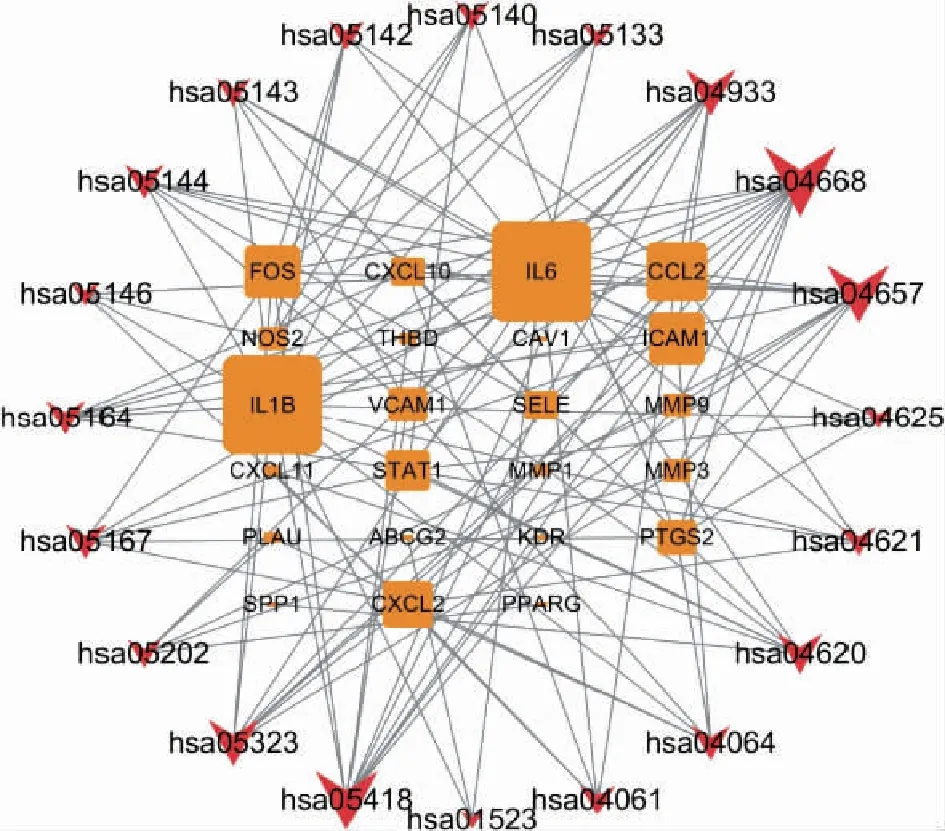
注:红色箭头代表通路;橙色方形代表靶点。图7 四逆散治疗UC的靶点-通路网络
3 讨论
UC为临床难治性疾病,其病因及发病机制目前尚无确切定论,多认为是遗传、环境、免疫等多种因素综合作用的结果[10]。UC在世界范围内的发病率呈上升趋势,目前我国尚缺乏全国性基于人口的流行病学调查,多为以医院为基础的小规模研究,数据主要集中在单个省份或地区。综合已发表的数据,在我国,每10万人中有1~2人患有UC[11-14]。UC治疗的最佳目标是持续、持久的非类固醇缓解期,尽量避免手术以及癌症的发生,且拥有正常健康的生活[15]。
与西医学相比,中医药在诱导UC缓解、预防复发、提高患者生活质量等方面具有独到的优势。四逆散为医圣张仲景所组之经方。方中柴胡疏肝解郁,升举阳气,与枳实相配,使得升中有降,共同调理气机;白芍养血敛阴,与甘草相合缓急止痛,与柴胡相合疏肝理脾;枳实下气破结,与白芍相伍调气和血;甘草甘温益气健脾、调和诸药,全方共奏疏肝理脾、调气和血、缓急止痛、透邪解郁之功。
本研究共筛选出四逆散有效成分144个,其中作用最显著的是槲皮素、山柰酚、木犀草素、川陈皮素,这四者均为黄酮类化合物。槲皮素具有抗炎、抗氧化、抗病毒、抗肿瘤、降糖等作用[16]。有研究认为,槲皮素可抑制一氧化氮(NO)、前列腺素E2(PGE2)、环氧化酶(COX-2)的水平,并通过抑制NF-κB及丝裂原活化蛋白激酶(MAPK)通路发挥其抗炎作用[17]。现有证据表明,富含槲皮素的食物能够降低UC发病的风险[18],如果槲皮素以糖基化形式(如芦丁)呈现,则通过口服途径给予槲皮素治疗UC是可以实现的[19]。山柰酚已被证明是一种有效的促炎分子抑制剂[20],有研究表明,山柰酚可抑制IL-32诱导的单核细胞分化为巨噬细胞样细胞,减少胸腺基质淋巴生成素、IL-1β、TNF-α及IL-8等促炎因子的产生及mRNA的表达[21]。木犀草素具有较强的体内外抗炎活性,已被用于治疗炎症相关疾病,有研究认为其抗炎活性来源于对转录因子信号传导与转录激活因子3(STAT3)、NF-κB和激活子蛋白-1(AP-1)的调节[22]。Nishitani等[23]的研究表明,木犀草素能够显著抑制CD4+T细胞向结肠黏膜的浸润,提高结肠组织中γ。干扰素(IFN-γ)的表达。李越等[24]认为,木犀草素能够激活核转录因子E2相关因子2(Nrf2)信号通路,抑制促炎因子TNF-α、IL-6 mRNA的表达,增强结肠抗氧化活性,从而减轻UC小鼠结肠组织病理损伤。川陈皮素生物利用度良好,具有抗炎、抗癌、抗氧化、神经保护等作用[25],能够抑制蛋白激酶B(Akt)、NF-κB等通路,降低TNF-α、IL-1β、IL-6、NO、PGE2等促炎因子的表达[26]。研究发现,川陈皮素能够通过降低炎性介质、促炎因子等的表达,显著缓解UC大鼠的结肠炎症、降低肠通透性[27]。
根据PPI网络,可见NPM1、HSPA8、YWHAZ、UBC、VCP、HNRNPA1、HSP90AA1、HSPA5、HSP90AB1、HNRNPU可能是四逆散治疗UC的关键作用靶点。NPM1是一种磷酸化蛋白,属于核磷蛋白/核纤溶酶蛋白家族,有维持基因组稳定、调节生长-抑制途径、感应核仁应激等功能,并在核糖体生物发生中起重要作用[28-29]。HSPA8、HSP90AA1、HSPA5、HSP90AB1均属于HSP,是高度保守的应激诱导因子,可管理热应激激活、促进T细胞粘附和迁移、加强免疫监视等,在炎症、肠道疾病及免疫中具有重要的相关作用[30]。研究表明,HSP参与多种自身免疫性和慢性炎症性疾病的发病,如UC、克罗恩病、类风湿性关节炎等[31]。YWHAZ可参与多种生理活动的调节,是结合和稳定信号转导、细胞增殖和凋亡中的关键蛋白的关键因子[32]。UBC属于多泛素基因,泛素化为泛素分子修饰靶点的过程,在损伤修复和炎症免疫等多种生物学功能的调节中起着重要作用[33],泛素作为一种与泛素化相关的必需蛋白,在UC的炎症反应中发挥核心作用[34]。VCP是一种同源六聚体AAA ATP酶,与多种细胞功能如泛素蛋白酶体系统、线粒体膜外膜蛋白降解及自噬相关[35-36]。HNRNPA1是一类与复杂多样的生物学过程相关的RNA结合蛋白,可调节mRNA的剪接、转录、核质穿梭和翻译以及端粒的维持[37]。Moriggi等[38]利用同位素编码蛋白标记法(ICPL)对UC患者及健康人肠上皮细胞提取物进行蛋白质组学分析,观察到UC患者HNRPNA1含量较健康人明显有所增加。HNRNPU是一种RNA结合蛋白,是最重要的mRNA稳定蛋白之一,在哺乳动物发育中起重要作用,有研究认为,HNRNPU可与NF-κB通路介导的长非编码RNA FIRRE相互作用来增强炎症基因的mRNA稳定性,从而特异性地促进肠上皮细胞炎症基因的表达[39-40]。
根据KEGG通路分析,四逆散治疗UC的主要涉及的通路为炎症反应及免疫相关通路,涉及TNF信号通路、IL-17信号通路、糖尿病并发症中AGE-RAGE信号通路、Toll-样受体信号通路、NF-κB通路等。 TNF通路与多种免疫性疾病相关,TNF是一种促炎因子,有研究认为,其为UC的主要病理细胞因子[41],抗TNF疗法已成为炎症性肠病的主要疗法之一,且取得了较为满意的临床效果。IL-23/17轴在黏膜免疫学和UC发病机制中起关键作用,在肠道中,脂多糖和肽聚糖与抗原提呈细胞上的Toll样受体结合,促进IL-23的释放,进而诱导Th-17细胞的扩张,导致IL-17的释放[42-43]。IL-17具有双重作用,有可能推动慢性黏膜炎症发展,但也可能通过对Th1细胞反应的负调控发挥抗炎作用[44]。Toll样受体是固有免疫中免疫受体的代表,过多的Toll样受体激活通过持续的促炎细胞因子和趋化因子的产生来破坏免疫动态平衡,从而导致许多炎症性和自身免疫性疾病的发生[45],Toll样受体活性增强很可能会导致肠道的先天免疫反应激活,进而诱发UC的发生[46]。据报道,在参与UC的信号通路中,NF-κB通路占据重要地位,在调节UC患者细胞因子的释放中起核心作用[47]。NF-κB作为一种逆转录因子,能够调节多种生理过程,包括天然和获得性免疫反应、细胞凋亡、细胞增殖、炎症和恶性转化等,在调节炎性细胞因子的表达中起着至关重要的作用[48-49],通过调节NF-κB通路治疗UC已成为当前关键治疗策略之一。
综上所述,本研究以四逆散中有效成分为研究对象,通过联合GEO差异分析及网络药理学初步探究了四逆散治疗UC的作用机制,为四逆散治疗UC提供了新的参考依据,但本研究仍存在一定局限性,仍需进一步研究进行完善。
