不同规格鹿茸饮片的多指标质量等级评价△
2021-06-11郭晓晗程显隆柳温曦李明华魏锋马双成
郭晓晗,程显隆,柳温曦,李明华,魏锋,马双成
中国食品药品检定研究院,北京 100050
鹿茸是传统名贵的动物药,《中华人民共和国药典》(以下简称《中国药典》)2015年版一部鹿茸片项下只规定其炮制方法为“取鹿茸,燎去茸毛,刮净,以布带缠绕茸体,自锯口面小孔灌入热白酒,并不断添酒,至润透或灌酒稍蒸,横切薄片,压平,干燥”[1],对鹿茸片的规格无明确的划分。实际上,市场上的鹿茸片常分为蜡片、粉片、砂片、血片和骨片等[2-4]。《中华人民共和国农业部行业标准》NY/T1162—2006[5]虽对鹿茸片的规格进行了划分,但农业农村部标准理化测定指标较少,只对不同规格等级鹿茸片的总氨基酸和钙的含量进行规定。鹿茸饮片质量等级标准不完善,导致难以对鹿茸产品进行有效的质量控制和评价,市场中出现的易混品、劣品与伪品[6-8],更给市场监管带来挑战。面对鹿茸片质量等级混乱问题,根据其传统应用及化学成分特点,建立多指标的综合质量评价体系显得尤为重要。
近年来,学者们对鹿茸的化学成分的一系列研究表明,其成分复杂多样,主要成分是蛋白质和氨基酸,还包括激素、脂类、多糖、多胺、生物碱等多种化学成分[9-11],其中蛋白质是鹿茸质量控制的重要指标[12-13]。同时,研究表明,鹿茸中化学成分随生长周期不同呈规律的变化[14-16],与这些指标相关的检测项目,包括总灰分、稀乙醇浸出物、总氮、氨基酸等,这些指标与鹿茸的质量密切相关;并且随着其生长年限的增加,鹿茸会逐渐骨化,钙的含量发生变化。因此,本研究根据《中国药典》2015年版中的检测指标设定惯例,对鹿茸蜡片、粉片、血片和骨片的总灰分、稀乙醇浸出物、总氮、氨基酸等进行测定,以期结合多指标定量分析为不同商品规格的鹿茸饮片的质量评价和等级划分提供参考。
1 材料
1.1 仪器
e2695型高效液相色谱仪(Waters公司);Binder FED-115型热循环干燥箱(宾德公司);KjeltecTM2400型自动凯式定氮仪(瑞典福斯公司);AE240型电子天平(Mettler-Toledo公司)。
1.2 试药
乙腈为色谱纯(英国Thermo Fisher公司);氨基酸(含量测定用)对照品均购于中国食品药品检定研究院:丝氨酸(纯度:99.9%)、甘氨酸(纯度:100.0%)、组氨酸(纯度:99.9%)、精氨酸(纯度:99.9%)、苏氨酸(纯度:99.9%)、丙氨酸(纯度:99.9%)、脯氨酸(纯度:99.9%)、酪氨酸(纯度:99.8%)、缬氨酸(纯度:99.9%)、甲硫氨酸(纯度:99.9%)、异亮氨酸(纯度:99.9%)、亮氨酸(纯度:99.9%)、苯丙氨酸(纯度:100.0%)、赖氨酸(纯度:100.0%),批号均为140624-201506;羟脯氨酸(批号:111578-201602,纯度:99.9%);异硫氰酸苯酯(Urchem公司,纯度:98.0%);三乙胺、正己烷、无水醋酸钠、冰乙酸、无水乙醇为分析纯,盐酸为优级纯,硫酸铵(批号:20170110)、氢氧化钠(批号:20170323)、硫酸钾(批号:20161215)、无水硫酸铜(批号:20170105)、硼酸(批号:20170228)、甲基红(批号:20161020)、溴甲酚绿(批号:20160330)、无水乙醇(批号:20160729)、硫酸(批号:20170321)、碳酸氢铵(批号:20131028)均购自国药集团化学试剂有限公司;0.05 mol·L-1硫酸滴定液(中国食品药品检定研究院,批号:539906-170405);水为自制纯水。
54批不同规格的鹿茸饮片购买自11家饮片公司(表1),由中国食品药品检定研究院魏锋研究员鉴定为正品,其中4种代表性规格饮片见图1。

表1 鹿茸样品信息

注:A.蜡片;B.粉片;C.血片;D.骨片。图1 4种规格代表性鹿茸饮片
2 方法与结果
2.1 灰分测定
不同规格鹿茸饮片随生长周期的变化,其骨化部分也呈现较为规律的变化,因此,参照《中国药典》2015年版四部(通则2302)灰分测定法,对收集到的不同规格的鹿茸饮片的灰分进行测定,从而确定其灰分的变化规律。
2.2 浸出物含量测定
2.2.1冷浸法 取鹿茸供试品粉碎,使能通过二号筛,并混合均匀。取供试品约2 g,精密称定,以稀乙醇为提取溶剂,参照《中国药典》2015年版四部(通则2201)浸出物测定法项下的冷浸法进行测定。
2.2.2热浸法 取鹿茸供试品粉碎,使能通过二号筛,并混合均匀。取供试品约2 g,精密称定,以稀乙醇为提取溶剂,参照《中国药典》2015年版四部(通则2201) 浸出物测定法项下的热浸法进行测定。
2.3 总氮含量测定
以定氮仪法测定不同规格鹿茸饮片的总氮含量[参照《中国药典》2015年版四部(通则0704)氮测定法中第三法]。
2.3.1反应溶液 碱液(40%的氢氧化钠溶液);吸收液(每升的1%硼酸溶液加0.1%甲基红乙醇7 mL与0.1%溴甲酚绿乙醇10 mL)。
2.3.2供试品溶液 取供试品粉末约0.3 g,精密称定于消化管中,依次加入硫酸钾(5 g)、无水硫酸铜(0.5 g)、硫酸(10 mL),置于消化仪中,消解至溶液呈澄清透明的蓝绿色之后,再继续消化20 min,取出,冷却,备用。
2.3.3空白溶液 将未加供试品粉末的消化管,按2.3.2项下方法消解。
2.3.4测定方法 样品测定开始前,用空白溶液测定,以便扣除空白值;然后将按照2.3.2项下方法将消解好的供试品溶液置于凯氏定氮仪中,设定好加入试剂的量(碱液50 mL、吸收液50 mL、水60 mL)及其他仪器参数,进行蒸馏和滴定。并且要不断测定硫酸铵化学试剂的含氮量,作为仪器校准使用。
2.3.5线性关系考察 分别精密量取硫酸铵溶液(26.435 2 mg·mL-1)0.5、1.0、2.0、3.0、5.0、10.0 mL置于25 mL量瓶中,用水定容至刻度,摇匀,分别转移至消化管中,按照上述方法依次制备和测定。将硫酸铵溶液取样体积(X)对含氮量滴定结果(Y)进行线性回归,结果表明,取样含氮量为2.76~56.07 mg时,具有较好的线性相关性,线性方程:Y=5.610 3X-0.043 7(r=1.000 0)。
2.3.6精密度试验 精密配制硫酸铵溶液(12.817 mg·mL-1)于消化管中,分别加入硫酸铵溶液10 mL及硫酸10 mL,按照上述方法连续测定6次。硫酸铵溶液的6次含氮量结果基本一致,平均值为21.15%,RSD为0.05%(n=6),表明精密度良好。
2.3.7重复性试验 精密称定同一供试品(批号:LP-1)粉末0.3 g(n=6)于消化管中,按照上述方法依次测定。结果含氮量分别为9.31%、9.30%、9.26%、9.26%、9.33%、9.33%,平均值为9.30%,RSD为0.54%(n=6),表明实验重复性良好。
2.3.8加样回收试验 分别精密称定供试品粉末(含氮量为9.30%)6份于消化管中,每份约0.15 g,按照上述方法依次测定含氮量,计算加样回收率,结果分别为98.49%、99.40%、103.36%、98.84%、100.88%、103.30%,平均回收率为100.71%,RSD为2.71%(n=6),结果表明准确度良好。
2.4 氨基酸成分的含量测定
鹿茸中氨基酸成分通过柱前衍生化技术,使用高效液相色谱法进行含量测定。空白溶液、混合对照品溶液及供试品溶液的制备参考相关文献[17]。系统适用性考察结果显示,15种氨基酸的分离度(R)和理论塔板数均符合要求,高效液相色谱图见图2。15种氨基酸线性方程相关系数均大于0.999 4,平均回收率为96.9%~103.2%,RSD均小于3.0%;精密度、稳定性及重复性结果均符合规定,相应的RSD均小于3.0%。分别取50批不同规格的鹿茸饮片粉末各0.20 g,精密称定,按参考文献[17]中的方法进行水解和衍生,利用标准曲线法分别计算15种氨基酸的含量及15种氨基酸的总量。
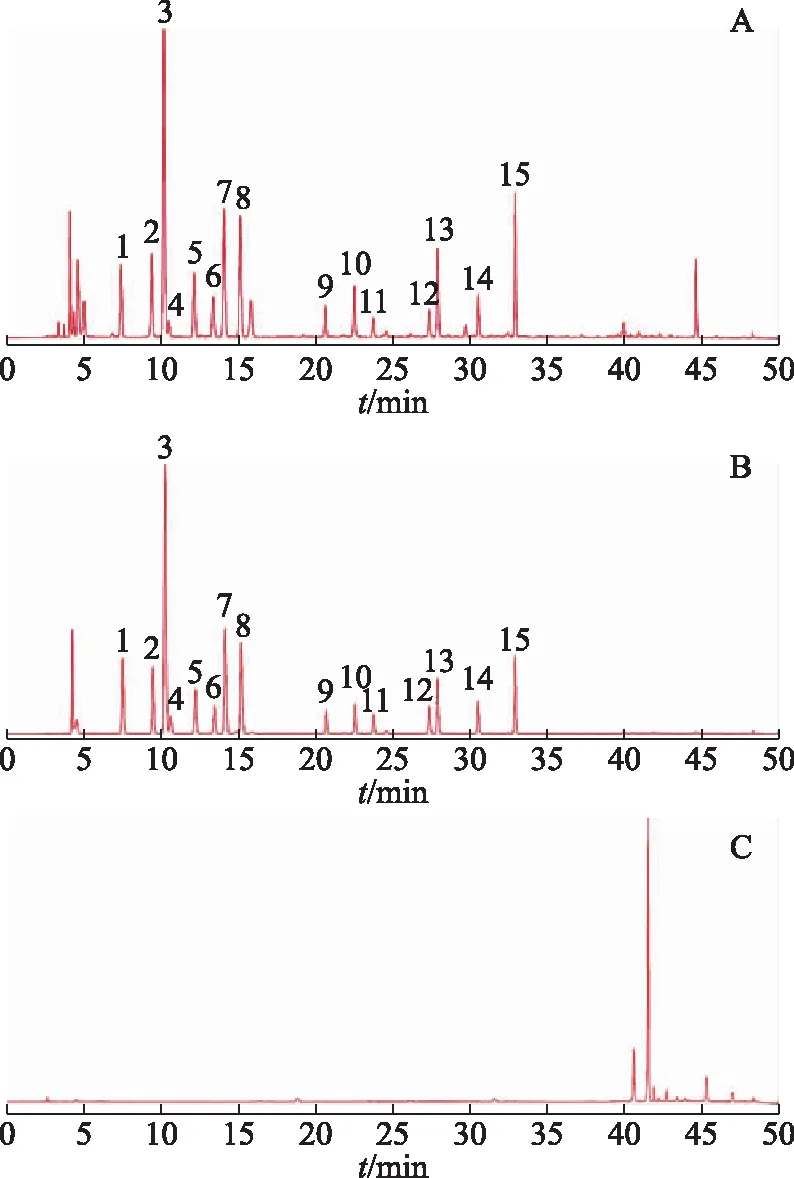
注:A.供试品;B.混合对照品溶液;C.空白溶液;1.羟脯氨酸;2.丝氨酸;3.甘氨酸;4.组氨酸;5.精氨酸;6.苏氨酸;7.丙氨酸;8.脯氨酸;9.酪氨酸;10.缬氨酸;11.甲硫氨酸;12.异亮氨酸;13.亮氨酸;14.苯丙氨酸;15.赖氨酸。图2 鹿茸供试品、混合对照品溶液和空白溶液的高效液相色谱图
3 结果
3.1 不同规格鹿茸饮片的总灰分、浸出物的含量测定
取其中40批鹿茸饮片进行总灰分检测,测定结果见表1。蜡片:3.5%~4.2%,平均总灰分为3.76%;粉片:31.9%~37.7%,平均总灰分为35.68%;血片:26.3%~37.4%,平均总灰分为31.23%;骨片:37.2%~46.6%,平均总灰分为43.83%。4种鹿茸饮片规格中,蜡片总灰分最低,骨片最高,具有明显差异;血片和粉片的总灰分有所交叉,不易区别。
以稀乙醇为提取溶剂,对鹿茸饮片分别进行冷浸和热浸,浸出物的含量测定结果见表2。冷浸条件下,蜡片:13.4%~14.5%;粉片:6.5%~7.9%;血片:5.7%~6.5%;骨片:1.6%~3.1%。热浸条件下,蜡片:19.8%~22.9%;粉片:9.2%~12.5%;血片:8.0%~9.0%;骨片:4.0%~5.8%。鹿茸饮片随着骨化程度的加重,醇溶性浸出物呈降低趋势,依次为蜡片>粉片>血片>骨片。
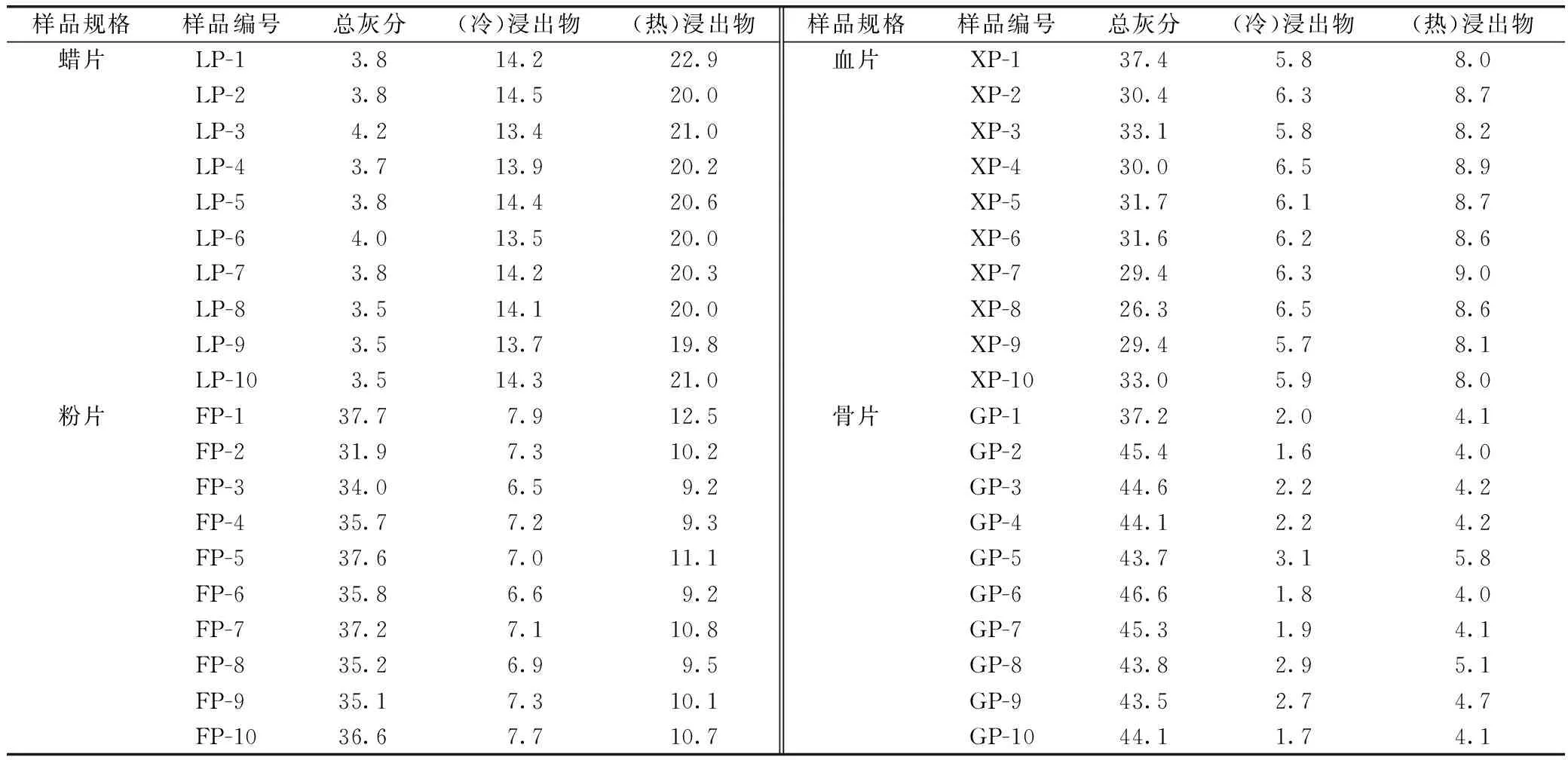
表2 不同规格鹿茸饮片的总灰分、浸出物的含量测定 %
3.2 不同规格鹿茸饮片的总氮含量测定
取其中46批鹿茸饮片进行总氮测定,其质量分数为6.79%~14.03%。其中蜡片总氮含量(12.25%~14.03%)最高,平均质量分数为13.52%;粉片(9.31%~10.51%)和血片(9.29%~9.97%)两者总氮含量相差不大,平均质量分数分别为9.65%和9.77%;骨片总氮含量最低(6.79%~7.09%),平均质量分数为6.95%,结果见表3。
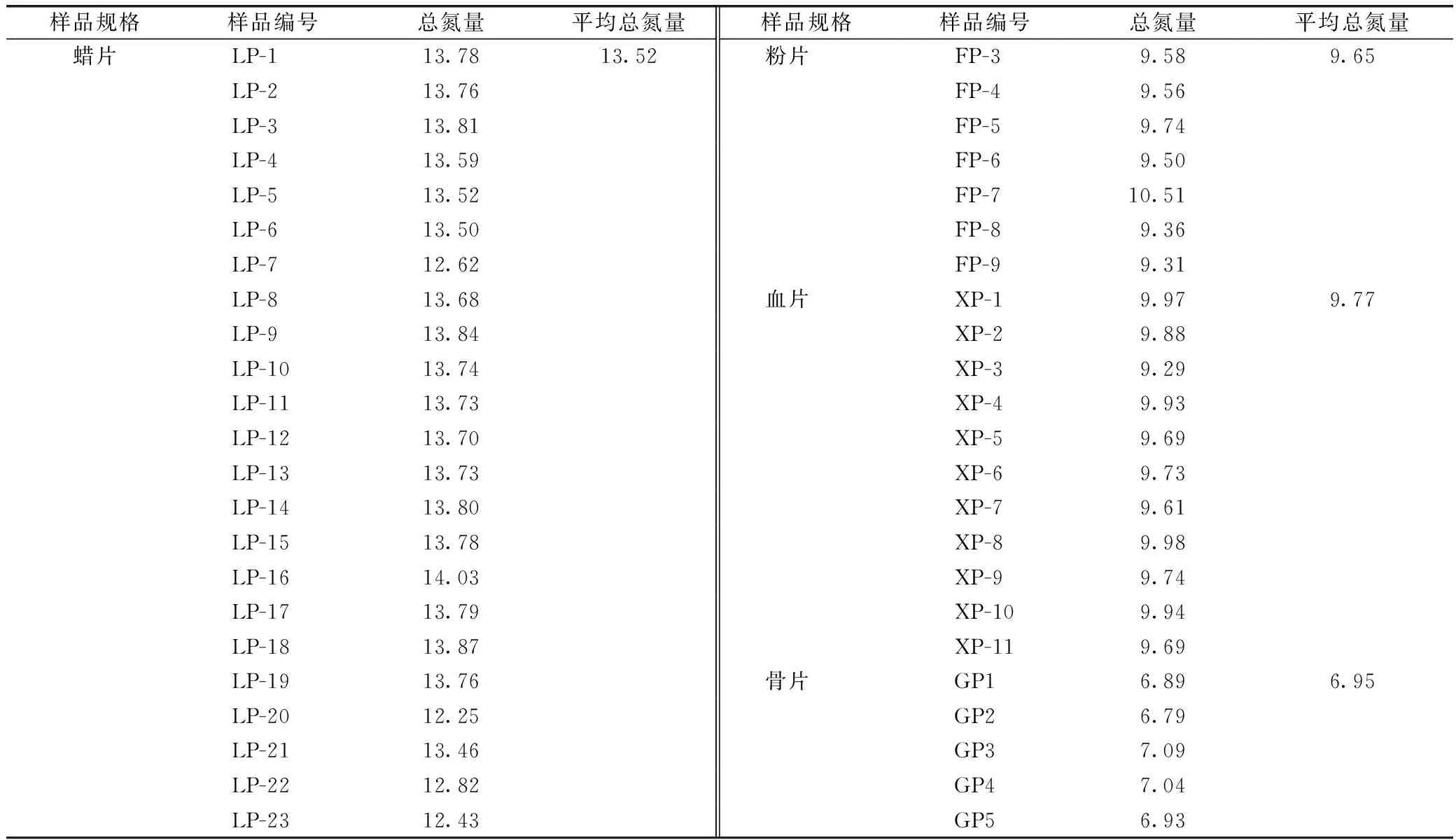
表3 不同规格鹿茸饮片的总氮含量测定 %
3.3 不同规格鹿茸饮片的氨基酸含量测定
50批不同规格鹿茸饮片氨基酸的含量测定结果显示,15种氨基酸的总量为29.53%~54.09%。其中甘氨酸含量最高,约占6.43%~10.44%,脯氨酸、丙氨酸和精氨酸次之。蜡片(44.56%~54.09%)平均质量分数为49.84%;粉片(40.00%~45.33%)平均质量分数为41.31%;血片(32.88%~39.96%)平均质量分数为38.10%;骨片(29.53%~33.95%)平均质量分数为31.45%。由上述比较分析可知,鹿茸饮片随着骨化程度的加重,氨基酸平均含量呈降低趋势,与浸出物变化趋势保持一致,呈现蜡片>粉片>血片>骨片的趋势。
3.4 指纹图谱分析
利用Chem.Pattern软件对4种规格鹿茸饮片的氨基酸HPLC图谱进行处理,对图谱的保留时间进行校正,指纹图谱图结果见图3。经Chem Pattern软件相似度评价系统对HPLC指纹图谱相似度分析,50批不同规格的鹿茸饮片指纹图谱中检测到15个共有峰,4种商品规格的鹿茸饮片的相似度均大于0.985,说明以氨基酸为分析指标,4种规格的鹿茸饮片具有较高的均一性。
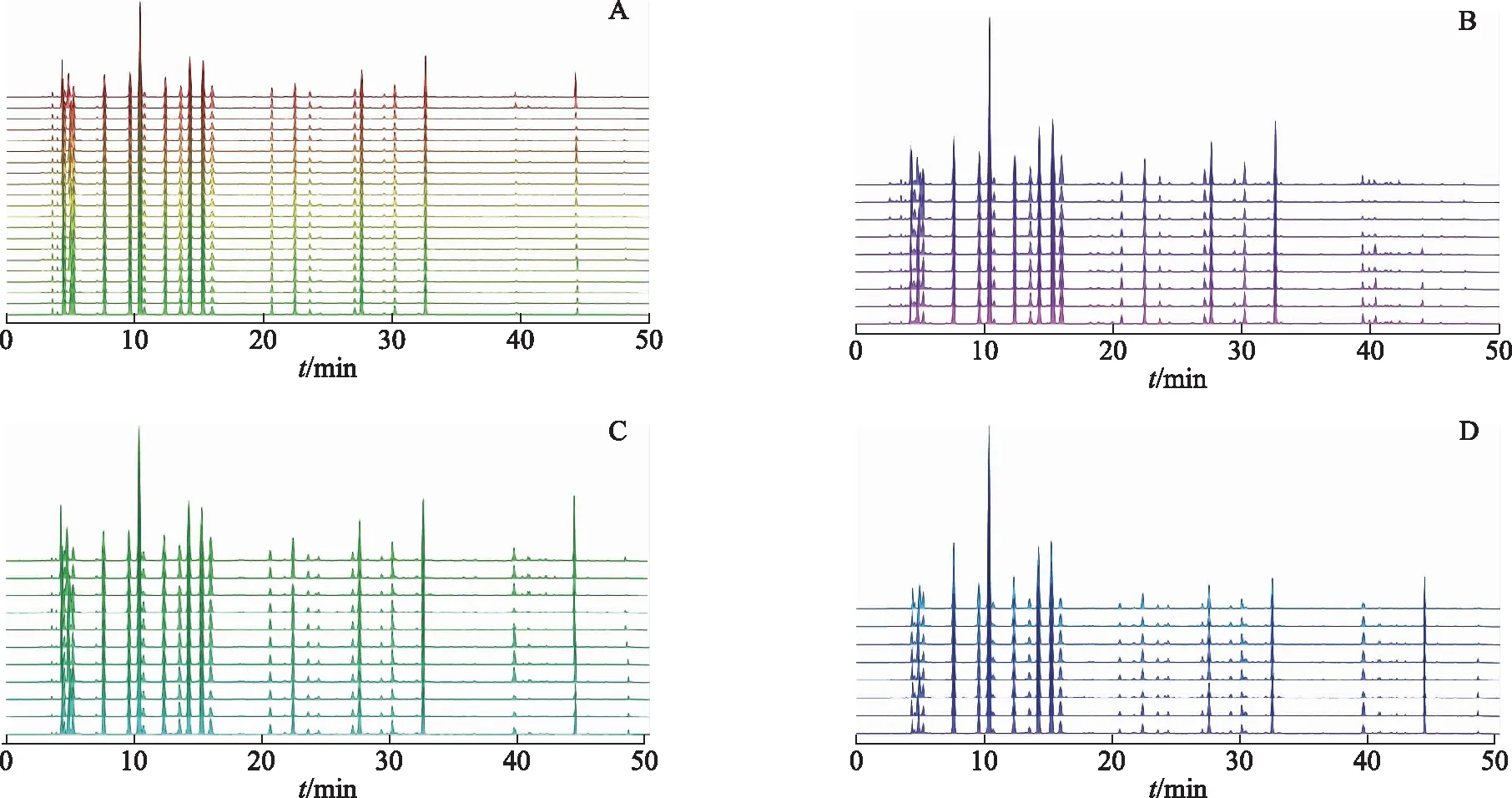
注:A.蜡片;B.粉片;C.血片;D.骨片。图3 鹿茸蜡片、粉片、血片、骨片高效液相色谱指纹图谱
3.5 鹿茸饮片质量分级量表
根据上述不同商品规格鹿茸饮片的总灰分、稀乙醇浸出物、总氮、氨基酸含量,进行分析比较,最终,将鹿茸蜡片定为一等品;粉片与血片的各含量测定指标均有所交叉,无法较为明确区分,因此将两者归为一类,定为二等品;骨片定为三等品,结果见表4。
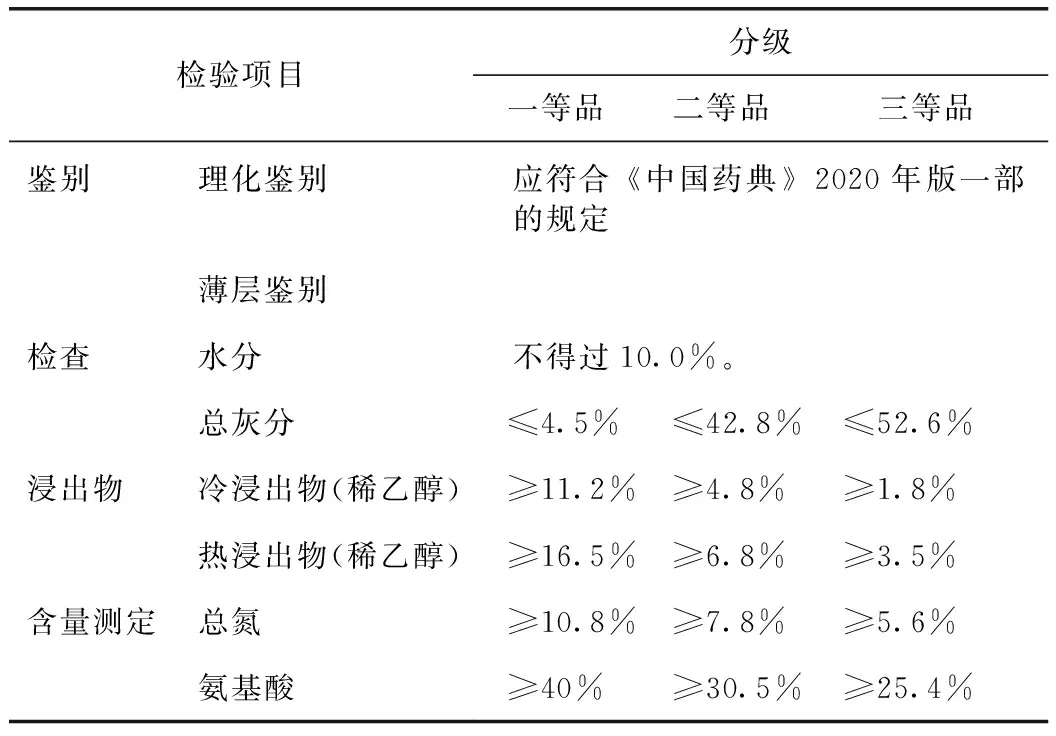
表4 鹿茸饮片质量分级
4 讨论
4.1 实验条件的优化与注意事项
浸出物含量测定时,由于鹿茸饮片的主要成分是蛋白质,在浸出物过滤时要使用干燥滤器趁热尽快过滤,否则溶液会变黏稠甚至凝固,导致浸出物含量测定结果偏低。由于不同的人员在操作时实验操作上的差别,容易出现测定结果重复性较差的情况。因此,本实验采用抽滤装置迅速抽滤并用稀乙醇清洗滤器,最后定容。
氨基酸的含量测定采用柱前衍生化法,可使衍生化与高效液相色谱分离系统相隔离,防止彼此干扰。衍生化试剂选择异硫氰酸苯酯(PITC),衍生化产物单一稳定、灵敏度高;同时,为保证衍生化反应完全,所加PITC需过量;最后加入正己烷进行萃取,防止衍生化试剂色谱峰的干扰,避免色谱柱柱效的降低。通过对色谱柱的考察,最终确定使用Agilent TC C18色谱柱(250 mm×4.6 mm,5 μm),使得异亮氨酸和亮氨酸的色谱峰得到较好的分离。此外,考虑到羟脯氨酸是胶原蛋白特有的氨基酸,特意考虑对其进行考察。
4.2 不同规格鹿茸饮片质量等级评价
本研究通过对鹿茸蜡片、粉片、血片、骨片的总灰分、醇溶性浸出物、总氮、氨基酸的含量测定结果进行分析比较,其总灰分呈升高趋势,其中蜡片平均总灰分含量最高,骨片平均总灰分含量最低,粉片和血片两者总灰分相差不大。冷浸及热浸条件下的醇溶性浸出物、总氮含量、氨基酸含量均呈现蜡片>粉片>血片>骨片的降低趋势,其中粉片和血片两者各指标含量相差不大,有所交叉。综上,鹿茸血片与粉片无法明显区分,这与两者被切割的部位比较接近有关,且不同的厂家与产地的炮制工艺有所不同,因此,部分鹿茸粉片和血片的相应指标含量会有所交叉。因此,如表4所示,在对鹿茸饮片性状的初步判断的基础上,根据鹿茸饮片的多指标含量测定结果,将鹿茸饮片依次划分为鹿茸蜡片(一等品)、粉片与血片(二等品)、骨片(三等品)3个等级,由此可在一定程度上规范鹿茸饮片等级混乱、以次充好的现象。
根据鹿茸饮片的化学成分及传统使用特点,鹿茸饮片的指纹图谱及多指标的含量测定可以较全面地对其进行质量评价,从而将不同商品规格的鹿茸饮片进行质量等级划分,这不仅可以规范鹿茸饮片市场,维护消费者的利益,更是对中药材及饮片质量等级评价新模式的有益尝试和探索[18]。
