中药中多环芳烃污染风险控制研究进展△
2021-06-11杜晓娟曾利娜苏畅王铁杰金红宇魏锋马双成王淑红
杜晓娟,曾利娜,苏畅,王铁杰,金红宇,魏锋,马双成,王淑红*
1.深圳市药品检验研究院,广东 深圳 518057;2.中国食品药品检定研究院,北京 100050
环境污染、中药种植过程中农药的使用、中药饮片违规炮制加工等都可能造成中药外源性有害物质(包括重金属及有害元素、农药、生物毒素、二氧化硫、环境污染物等)残留。2019年12月16日,国家中医药管理局网站发布《〈中共中央 国务院关于促进中医药传承创新发展的意见〉重点任务分工方案》,要求农业农村部、国家药品监督管理局、国家中医药管理局负责严格农药、化肥、植物生长调节剂等使用管理,分区域、分品种完善中药材农药残留、重金属限量标准[1],这意味着对中药安全性风险控制工作提出了更高的要求。对此,以中国食品药品检定研究院为代表的各级药品检验机构做了大量工作。2019年8月16日,国家药典委员会网站公示了中药中有害残留物限量制定指导原则修订草案、药材和饮片检定通则草案、农药残留量测定法修订草案[2]。多环芳烃(polycyclic aromatic hydrocarbons,PAHs)作为重要的环境污染物,对人类健康危害很大,已成为中药外源性有害残留物研究新的关注点。本文对中药中PAHs的来源、危害、检测分析方法等国内外研究情况进行总结,以期为进一步加强中药质量安全控制提供参考。
1 PAHs的定义和研究范围
PAHs是一类有机化合物,分子结构含有2个或2个以上苯环并以稠环形式连接,大多为无色、白色或淡黄色固体,迄今已发现200多种PAHs。PAHs的稠合芳环小于6个被称为“轻”PAHs,含有6个及以上被称为“重”PAHs[3-4]。PAHs多具有高熔点、高沸点、低蒸汽压和低溶解度的特性。蒸气压和溶解度随着相对分子质量的增加而减小。同时,由于PAHs具有很强的亲油性,所以极易溶于有机溶剂[5]。
1976年,美国环境保护署(USEPA)确定了16种PAHs(以下简称“USEPA-PAH16”)为需要优先控制的污染物,这是目前研究最广泛深入的PAHs种类(表1)[5]。USEPA-PAH16均属于“轻”PAHs。根据其持久性、生物累积性及对人体或环境产生不可逆作用的特性,其中,蒽、苯并[a]芘、苯并[a]蒽、苯并[k]荧蒽、苯并[G,H,I]苝、1,2-苯并菲、荧蒽、菲、芘9种PAHs被列入欧盟化学品管理局《关于化学品注册、评估、许可和限制的法规》(以下简称“REACH法规”)高关注度物质清单(SVHC)。
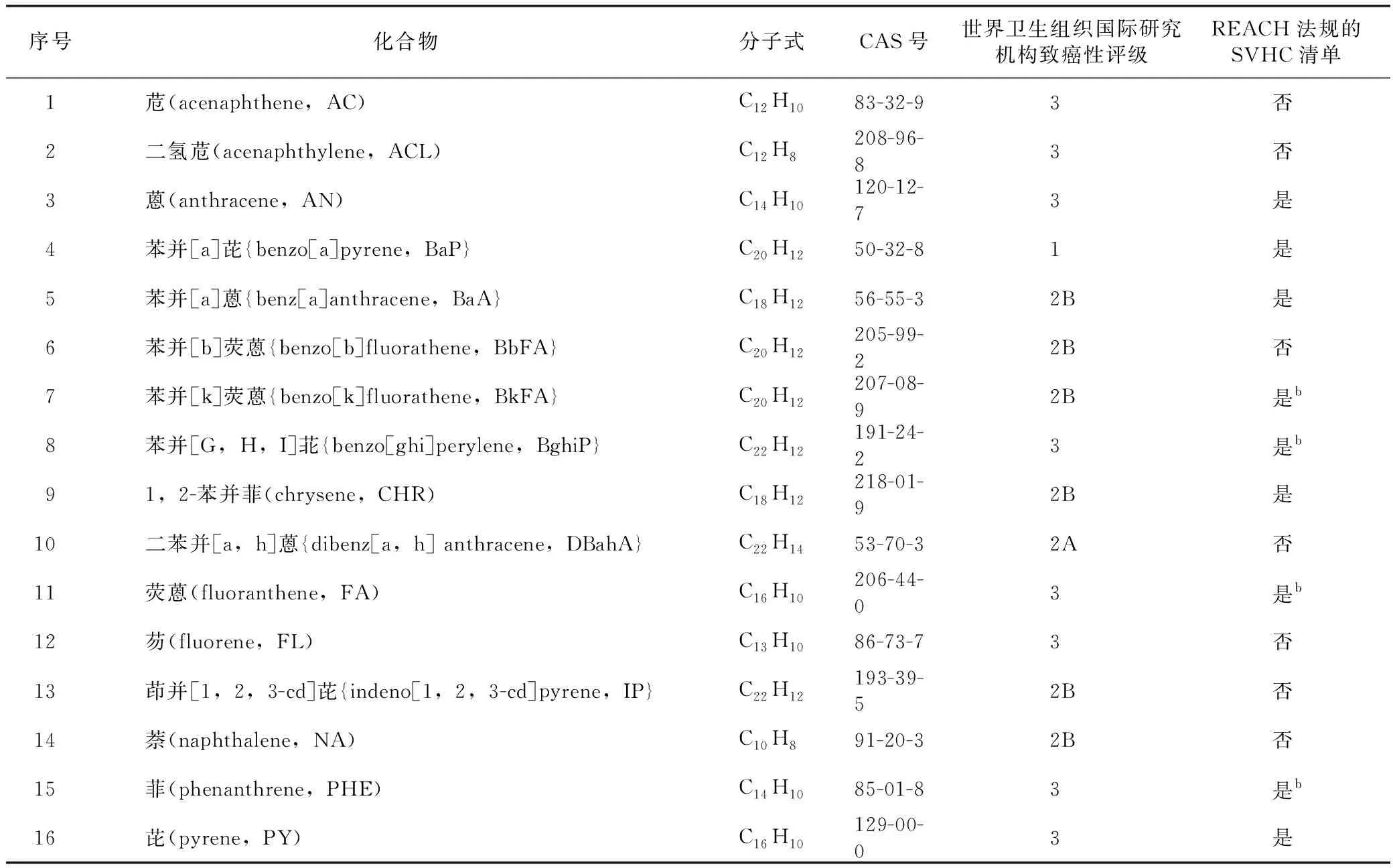
表1 USEPA-PAH16基本信息
此外,苯并[a]芘被世界卫生组织国际癌症研究机构(IARC)确定为1类致癌物,该物质是目前研究最广泛的PAHs之一[4]。2008年,韩国发布《草药中苯并芘的规格和检验方法提案》(G/TBT/N/KOR/197),该提案规定苯并芘在2种草药中(生地黄和熟地黄)的最大容许量为5 μg·kg-1[6]。2015年10月27日,欧盟委员会针对食品中PAHs最大使用量公布了(EU)2015/1933号法规,修订(EC)1881/2006号法规,新法规增加了干草药中PAHs的最大使用量[7]。2019年,韩国公布了《中医药-加工的天然产品中苯并芘含量的测定》国际标准化组织(ISO)新项目提案,建议建立标准化的苯并芘含量测定方法,并提出最大限量[8]。综上所述,由于对中药安全性的关注及中药国际化发展,已使得PAHs作为中药外源性有害残留物的研究成为国际热点。
2 PAHs的健康风险
2.1 对人体健康的短期影响(急性)
暴露于高浓度的PAHs环境中会导致眼睛刺激、恶心、呕吐、腹泻和意识模糊等症状[9]。
2.2 对人体健康的长期影响(慢性)
长期接触PAHs可导致免疫功能下降,引发白内障,肾脏、肝脏损害(如黄疸),呼吸系统疾病,皮肤炎症等。大量摄入萘,会导致体内红细胞的分解[10]。
2.3 致癌性
PAHs是众所周知的致癌物,对人类健康构成严重威胁。世界卫生组织国际癌症研究机构按照PAHs对人类致癌性进行评级,分为1、2A、2B、3、4。USEPA-PAH16致癌性等级见表1,吸入过多的PAHs会导致患肺癌的风险升高[11]。
2.4 致畸性
研究表明,大鼠怀孕期间摄入高剂量的苯并芘会导致后代先天缺陷及体质量减轻[12]。
3 中药PAHs污染
3.1 自然环境中PAHs的产生途径
自然环境中PAHs来源主要有2种形式:一是有机物在低氧或无氧条件下暴露在高温环境中时形成的热源PAHs。如煤燃烧成煤焦油、石油残渣热裂解成较轻的碳氢化合物、机动车尾气排放、森林火灾、木材燃烧不完全及供暖系统中燃料燃烧不完全等,都会产生热源PAHs。二是原油形成和类似原油形成的过程中产生的PAHs,在原油及相关产品运输时产生泄露及在储存和使用过程中造成的积累[13-15]。
3.2 中药材对PAHs的主动吸收
工业生产和加工、木材煤炭等不完全燃烧产生的PAHs无法通过环境介质的自净作用消除。PAHs转移和转化过程中,在土壤和水源中持续富集。因此,植物类中药材生长过程中,根系可以从土壤、水源中吸收PAHs,并有可能伴随蒸腾作用沿木质部向茎叶传输[16-19]。
3.3 中药材PAHs被动污染
3.3.1雾霾天气中PAHs对植物源中药材的污染 雾霾在我国尤其是华北平原地区较严重,给当地居民健康带来极大威胁。雾霾受到高密度人口的经济及社会活动中大量排放细颗粒物(PM2.5)影响。辽宁、上海等地大气PM2.5中USEPA-PAH16污染严重,且冬季最高、夏季最低[20]。空气中存在的PAHs常吸附于药材表面,因此中药材原植物的地上部分(花、果实、茎、叶等)应成为重点关注对象。有研究检测32种中药材的16种PAHs,其中菲、芴、荧蒽污染严重,依据中药材不同入药部位分类,各污染物在叶中含量最高[16]。
3.3.2中药饮片炮制加工过程中的PAHs污染 植物类中药材经过炮制后得到中药饮片,才可以直接用于临床进行调剂,中药饮片也是中成药及中药配方颗粒的主要原料[21]。中药材炮制过程包括炒、蒸等,其中“炒”是“雷公炮制十七法”之一,属火制法,“炒爆”如麦芽等,“炒焦”如五灵脂、干漆等,“炒碳”如荆芥、地榆、菊花、乌梅等[22],中药材经过高温炮制可能会导致PAHs的生成[23-24]。有研究显示,检测市售的生地黄与熟地黄的苯并芘含量,6批熟地黄中有3批检出苯并芘,质量分数最高为9.2 μg·kg-1,4批生地黄中有1批检出苯并芘,质量分数为 4.0 μg·kg-1[25]。叶定江等[26]研究了20种中药炒碳前后苯并芘的含量变化,炒碳后苯并芘含量增高者6种,占总量的30%,苯并芘含量降低者14种,占总量的70%,提示炒碳可能对PAHs残留量有影响。
此外,硫黄熏蒸养护作为药材养护加工方法,应用历史悠久。硫黄燃烧产生的二氧化硫气体具有杀虫、抑菌、漂白等作用[27],市场上硫黄多为石油裂解加工的副产品,中药材以硫黄熏蒸的过程与硫黄的不完全燃烧类似。有研究模拟白芍、党参的硫黄熏蒸养护方式,并讨论硫黄熏蒸前后中药材中16种PAHs的变化,结果表明,未见PAHs残留量明显增加[28]。硫黄熏蒸与PAHs残留量关联性研究较少,有待深入研究。
4 中药PAHs检测的前处理方法
开展中药PAHs残留检测和样品筛查,是风险评估的基础工作。中药PAHs残留测定属于痕量检测范畴,对检测灵敏度要求很高,技术较为复杂。同时,由于PAHs种类很多,理化性质有一定差异,给残留检测增加了更多难度。中药药用部位多样,基质复杂,对PAHs检测有较大干扰,需要一定的提取、纯化手段排除干扰和基质效应。
4.1 提取
超声提取法是USEPA推荐的PAHs提取方法之一。中药基质复杂,有研究基于中药材的不同药用部位建立分类分析方法,检测其中USEPA-PAH16残留量,32种中药中根茎类以二氯甲烷为溶剂,种子类以乙腈-丙酮(3∶2)混合液为溶剂,均采用超声提取。结果表明,超声提取效率高,平均回收率较高[16,28-29]。另有研究对葛根、天花粉、硫黄熏蒸后的党参、白芍等药材中USEPA-PAH16的残留量进行测定,以乙酸乙酯为溶剂进行超声提取[18-19,30-31]。Shi等[32]研究证明,在超声提取过程中,以乙酸乙酯为溶剂提取USEPA-PAH16,提取效率更高。
4.2 纯化
目前针对中药PAHs前处理纯化方法主要有加速溶剂萃取法、固相萃取法(solid-phase extraction,SPE)、固相微萃取法、凝胶渗透色谱法、浊点萃取法。由于中药基质复杂,最佳方案应是纯化和富集同时完成,且操作要简便,对不同中药基质最好具有普遍适用性。SPE与传统的液液萃取法相比,可以提高分析物的回收率,可以根据基质特性选择内部填料,如C18、C8、氨基、硅胶。
许玮仪[28]研究了硫黄熏蒸对白芍、党参中PAHs残留量的影响,样品经乙酸乙酯超声提取后,采用C18固相萃取小柱净化,结果显示,方法灵敏、准确、可靠。金红宇等[31]测定天花粉中PAHs的残留量,也采用了乙酸乙酯超声提取、C18固相萃取小柱净化的方法。赵胜萍[30]基于中药不同药用部位采用了不同的纯化方法,种子类中药先通过C18柱吸附提取液中的色素或脂肪油,再用硅胶柱色谱纯化,叶、果实、花等其他药用部位中药则使用硅胶柱色谱进行纯化,结果表明,USEPA-PAH16的回收率为66.7%~108.2%,准确度良好。
SPE常与在净化含脂类、色素等大分子杂质的样品方面广泛应用的凝胶渗透色谱法(gel permeation chromatography,GPC)结合,广泛应用于中药PAHs净化及富集。以振荡提取、GPC-SPE进行净化富集,检测人参、路路通、甘草、桑枝、决明子、杜仲等28种中药USEPA-PAH16残留量,方法具有良好的准确度和精密度,可满足中药PAHs定量分析的要求[15-18]。崔宗岩等[24]采用GPC-SPE对79种市售植物源中药材的USEPA-PAH16进行净化富集,回收率为81.4%~108%,RSD均小于15%,说明方法稳定可靠。
固相微萃取法(solid-phase microextraction,SPME)是在SPE基础上发展起来的一种新型无溶剂样品分离技术。有研究对葛根药材中USEPA-PAH16残留量进行测定,采用SPME分离,并对萃取头涂层进行考察,结果表明,聚丙烯酸酯萃取头提取效果理想[18-19]。压力流体萃取法(pressurized fluid extraction,PFE)[25]、浊点萃取法(cloud point extraction,CPE)[32-33]也应用于中药中PAHs的研究,PFE的优点是有机溶剂用量少、快速、基质影响小,已被USEPA收录为标准方法[34]。
5 中药中PAHs的检测技术
在USEPA发布的Method 610(1984年)中,气相色谱和高效液相色谱为PAHs推荐检测方法。PAHs分子结构中含有2个或2个以上苯环以稠环形式连接,具有典型的紫外吸收光谱,大多数PAHs被激发时会发出特征波长的光,所以早期的PAHs检测分析中,使用高效液相色谱串联荧光检测器和紫外吸收检测器进行检测较为常见,见表2。
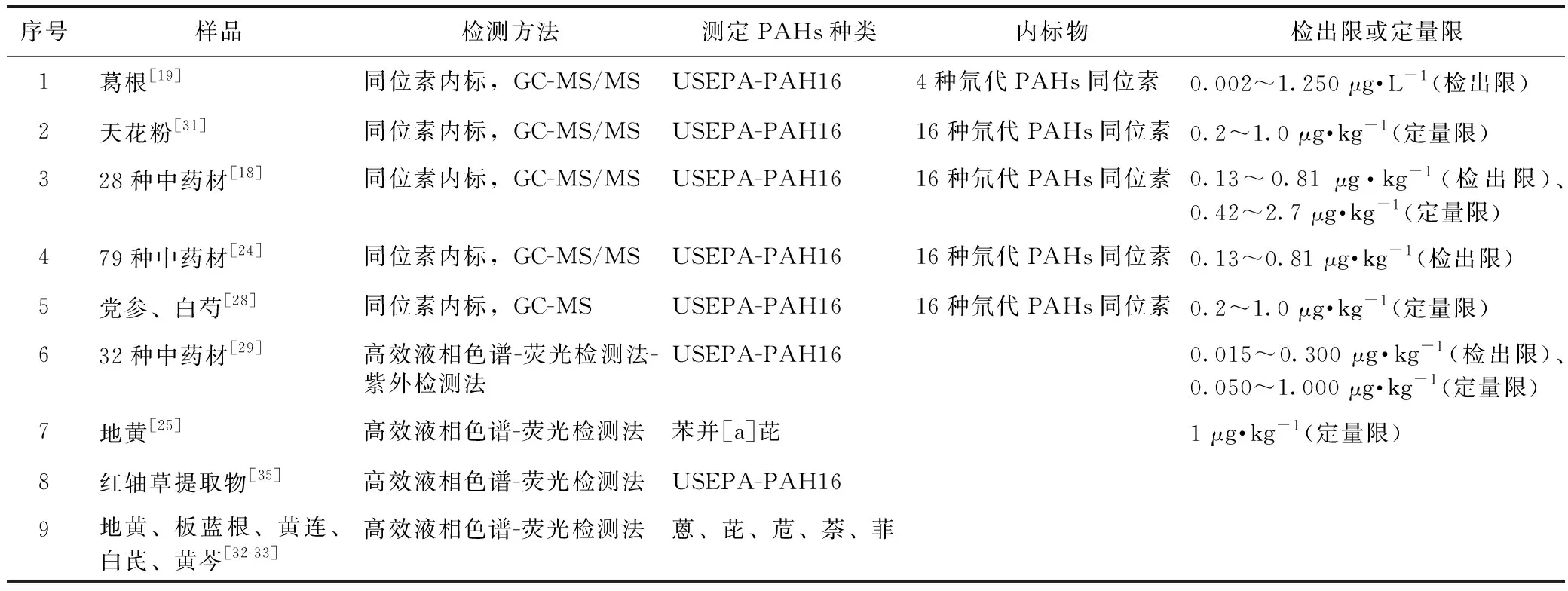
表2 中药PAHs检测方法
随着科技的进步以及各领域待分析物质的复杂程度加剧,PAHs的检测技术也在不断发展。色谱-质谱联用技术的高分辨率、高灵敏度、高选择性等特性,使其在食品、环境、药物分析等领域得到广泛应用。但是,对于不同类分析物,基质效应的制约和不适合的前处理方式都会影响分析结果。PAHs的检测分析中,气相色谱串联质谱的检测方法已普遍应用,其中气相色谱-三重四极杆串联质谱法(GC-MS/MS)与GC-MS一级质谱图相比,得到的二级质谱图排除了大部分基质干扰,提高了选择性和灵敏度,增强了结构解析和定性能力[36]。
同时,同位素内标法-气相色谱-质谱结合,采用与待测物具有相同分子结构的稳定同位素(13C、15N、2H等)标记的有机物作为内标,通过分别对同位素丰度的精确质谱测量和加入内标的准确称量,得出样品中待测有机物的绝对量,消除定量过程中基质效应影响,可以提高检测灵敏度[37]。同位素稀释-气相色谱-串联质谱法成为目前食品、环境、中药等领域检测PAHs中常见的分析方法。
液相色谱-串联质谱联用法(LC-MS/MS)与GC-MS/MS比较,具有更高的灵敏度。中药中PAHs检测中,LC-MS/MS尚未见报道。由于LC-MS/MS技术中大气压化学电离源(APCI)更适用于化合物分子中不含酸、碱性基团的化合物,如含苯环结构的碳氢化合物、醇类、酯类等,电离效率更高。目前,LC-APCI-MS/MS在环境、生物代谢等领域PAHs的定性、定量方面有广泛应用,Grosse等[38]使用LC-APCI-MS/MS分析环境中氧化PAHs。Lung等[39]使用LC-APCI-MS/MS分析水库沉积物中的12种PAHs。中药中PAHs的LC-MS/MS检测方法有待开发。
6 结语
综上所述,研究中药中PAHs含量水平对于规范中药材种植和生产,降低用药安全风险,具有重要的意义。目前,我国尚没有相关法律、标准规定中药中PAHs的残留量,应该引起业界的重视。随着环境污染日益严重,中药材种植地域环境指标的选择应尽早纳入中药材生产质量管理规范(GAP)管理规范。
对中药中PAHs为代表的持久性有机污染物残留情况,首先要有一个客观的认识和科学的评价。目前,亟须建立高效、可行的检测技术平台,开展样品普查,掌握基础本底数据,明确污染程度,避免仓促制定一致性限量标准而束缚中药产业发展。一旦明确了高风险药材品种,则有必要区分食药两用和单纯药用的不同目的,客观评价药用价值和安全风险的效益/成本比,拟定合理的残留限量,并尝试通过产地选择、清洗加工、优化炮制工艺等手段,达到减毒增效的目的。
