近红外诱导PLGA纳米粒子用于US/MR成像和乳腺癌治疗
2021-06-11左凤梅卢佳慧刘雅文倪晨时梅林胡俊峰
左凤梅 卢佳慧 刘雅文 倪晨 时梅林 胡俊峰
近年来,以多功能纳米颗粒为基础,将诊断与治疗整合为一个系统,可以提高临床疗效,减少治疗的副作用,为癌症的精确诊疗提供了新的思路[1-3]。目前,乳腺癌的治疗包括手术切除、化疗、放疗等[4-6]。然而,这些方法也会对健康组织造成严重损害。因此,一种新型的肿瘤治疗方法-光热疗法(Photothermal therapy,PTT)被提出[7]。PTT疗法是利用光敏剂将光转化为热,在激发光照射下,肿瘤部分迅速升温杀伤肿瘤细胞[8]。本研究使用吲哚菁绿(Indocyanine green,ICG)作为光敏剂,ICG 是一种近红外荧光染料,在激光照射后具有良好的光热转换效率和较高的生物安全性,但游离情况下稳定性差,血液循环寿命短。
1 材料与方法
1.1 主要仪器与试剂
透射电子显微镜(Tecnai G2 F20,美国),马尔文粒径分析仪(Nano ZS90,英国),紫外分光光度计(Uvmini-1240,日本),808 激光仪(MDL-N-808-8W,中国),多功能酶标仪(Biotek,美国),超声波破碎仪(JY92-IIDN,中国),超声成像仪(Philip,荷兰),荧光倒置显微镜(DMI3000B,美国),3.0T磁共振成像设备(GE Discovery 750w,美国);聚乳酸-羟基乙酸共聚物(PLGA,分子量10 000,聚合比50∶50,Evonik,德国),氯化锰(Manganese(II)chloride,MnCl2,北陆药业,中国),全氟戊烷(Perfluoropen-tane,PFP,阿拉丁,中国),吲哚菁绿(ICG,麦克林,中国),聚乙烯醇(PVA,Sigma,美国);MDA-MB-231,NIH-3T3 细胞株(中科院上海细胞库,中国),细胞计数试剂盒(CCK-8,美仑,中国)。
1.2 PMINPs 的制备
将100 mg 的PLGA 加入4 mL 的二氯甲烷,待充分溶解后加入200 μL 的PFP,2 mg ICG,200 μL MnCl2冰浴下超声破碎2 min 分钟(100 W),得到的初乳液缓慢滴入20 mL 2%PVA 溶液,超声破碎5 min(50 W)制成复乳,冰浴下搅拌8 h 挥发二氯甲烷,转速10 000 r/min 洗涤离心,重复三次后冻干备用,制备全程避光低温。
1.3 PMINPs 一般性质检测
使用透射电子显微镜观察材料的形貌和结构;使用马尔文粒径仪分析PMINPs 的粒径大小、PDI 及电位。采用紫外分光光度法计算ICG 的标准曲线,根据标准曲线来计算PMINPs 中ICG 的包封率。
1.4 细胞毒性检测和PMINPs 的摄入
MDA-MB-231 和NIH-3T3 细胞在96 孔板中孵育,37℃条件下,每孔培养1×104个细胞,孵育12 h。实验组每孔加入100 μL 含有不同浓度PMINPs 的培养基。孵育6 h,采用细胞计数试剂盒(CCK-8)检测PMINPs 的细胞毒性。将荧光标记物香豆素-6 装入PMINPs 中,细胞孵育1、2、3 h 后,采用DAPI(4′,6-diamidino-2-phenylindole)对细胞核进行染色,制片后使用倒置荧光显微镜进行观察。
1.5 光热性能检测
给予808 nm 激光辐照(1.5 w/cm2,5 min),用红外热成像仪记录各组温度变化。随后游离的ICG 和PMINPs 根据ICG 浓度配制成25 μg/mL 的溶液,取100 μL 置于96 孔板中,由808 nm 激光开-关循环辐照重复4 次(开1 min,关2 min),用红外热成像仪记录各组温度变化。
取对数生长期的MDA-MB-231 细胞与材料孵育6 h 后分组处理,用CCK-8 评价各组的细胞毒性。材料与细胞孵育6 h 后处理四个分组,激光照射后分别用钙黄绿素-AM(Calcein-AM)和碘化丙啶(PI)处理细胞,采用活死细胞染色法定性考察光热效果。
1.6 超声/磁共振双模成像
1.6.1 超声(Ultrasound,US)
显微镜下观察激光照射(1.5 w/cm2)下PMINPs的变化。将软管浸入水中,采用808 激光照射(1.5 w/cm2),使用超声成像仪观察是否成像。
1.6.2 磁共振(Magnetic Resonance,MR)
在3.0 T Discovery 750 W MR系统上对PMINPs进行T1 加权成像研究。用自旋回波序列对稀释后的样品进行MRI 扫描。此外,利用MDA-MB-231细胞的体外MR 成像试验评价其对乳腺癌细胞的磁共振成像能力。MDA-MB-231 细胞与不同浓度PMINPs 孵育6 h。将细胞消化离心收集并用PBS洗涤,使用前面描述的磁共振成像系统进行磁共振成像。磁共振扫描参数:重复时间=16 ms,回波时间=3.2 ms,视野=8 cm×8 cm,层厚=0.4 mm,层间距=0.5 mm,矩阵=320×288。
1.7 统计学分析
采用IBM SPSS Statistics 24 软件处理分析数据,计量资料以()形式表示,采用t检验和单因素方差分析,以P<0.05 表示差异有统计学意义。
2 结果
2.1 PMINPs 一般性质
所制备的纳米粒子具有明显的核/壳结构,粒径均匀,分散性强(图1A)。如图1B 所示,PMINPs的尺寸为(211.10±2.66)nm,PDI 为0.12。Zeta 电位为(-17.50±0.65)mV。图1C 中可以看出,PFP/MnCl2@PLGA NPs 的吸收光谱没有明显的吸收峰,而自由ICG 的吸收光谱在770~790 nm 左右达到峰值。PMINPs 的吸收光谱在790~810 nm 处出现峰值通过紫外吸收光谱确定ICG 标准曲线为y=0.247 5x-0.072 5(r=0.999)(图1D)。在此基础上计算ICG 的平均包封率为(76.38±0.32)%,平均载药量为(6.99±3.98)%。

图1 PMINPs 的表征Figure 1 Characterizations of PMINPs
2.2 细胞毒性检测和摄入
CCK-8试验结果显示当浓度到达160 μg/mL时,PMINPs 对MDA-MB-231和NIH-3T3细胞均无明显细胞毒性,不同浓度吸光度值差异无统计学意义,且细胞活力都在90%以上(图2A)。从图2B 中可以看出,随着时间的推移,MDA-MB-231细胞中出现代表PMINPs的绿色荧光且随着时间的增加而变量。

图2 PMINPs 的体外细胞毒性和细胞摄取Figure 2 In vitro cytotoxicity and cellular uptake of PMINPs
2.3 光热性能检测
经过808 nm 激光辐照后,PMINPs 升温显著,与ICG 的浓度呈正相关(图3A)。经过4 个激光开-关循环后,PMINPs 仍可以较稳定的产热,升温峰值只降低了3.3℃,而游离ICG 产热能力则明显下降关(图3B)。
如图3C 所示,不同浓度的PMINPs 在没有激光照射的情况下细胞活性没有明显下降。在近红外激光照射下,随着PMINPs 浓度的增加,癌细胞的消融作用增强。对于PFP/MnCl2@PLGA NPs,由于光敏剂ICG 的缺乏,激光照射后的加热效果不明显,对肿瘤细胞的损伤也很难观察到。如图3D 所示,仅激光照射,PMINPs 处理对细胞无明显杀伤作用。
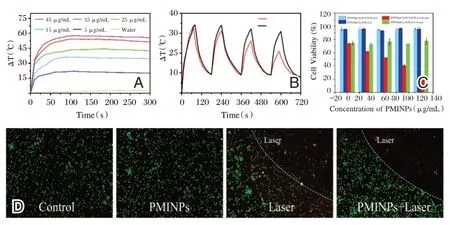
图3 PMINPs 光热性能检测Figure 3 PMINPs photothermal performance test
2.4 超声/磁共振双模成像
2.4.1 超声
随着辐照时间的延长,微泡膨胀到一定体积后开始破裂(图4A)。相应的,在808 nm 近红外激光照射前,透明塑胶软管中PMINPs 的超声成像效果没有增强。当激光照射后,PFP 气化,产生气泡,并发生明显的超声成像增强(图4B)。

图4 超声成像Figure 4 US imaging
2.4.2 磁共振
PMINPs 的磁共振信号强度随着Mn 浓度的增加而增强,见图5A。PMINPs 在细胞中具有很好的磁共振成像能力,并且是浓度依赖性的,见图5B。
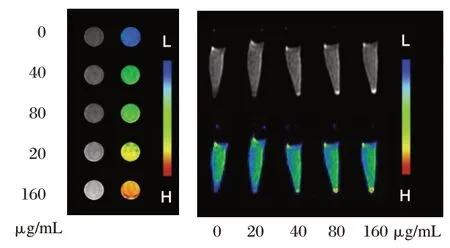
图5 磁共振成像Figure 5 MR imaging
3 讨论
根据已有研究可知,锰离子可以增强T1 信号,能显著提高病灶与周围良性组织的对比度。本研究中选用MnCl2作为磁共振造影剂。制备的纳米粒子将MnCl2包裹在内,由于MnCl2将会随着纳米载体在机体血液及组织内流通循环,会大大提高其在机体内的循环时间,从而给磁共振成像诊断提供充足的时间。磁共振成像是一种具有精细软组织对比和多平面成像能力的无创成像工具,但通常需要较长的采集时间,不能提供实时图像[9]。相比之下,超声可以提供实时图像,但在组织识别方面能力与磁共振相比略差[10]。在许多临床应用中,超声和磁共振是互补的,以区别可能的病理改变组织[11]。已有许多前人开发了相应造影剂,可以达到超声/磁共振共同成像的目的[12-13]。在这项工作中,笔者用了第三代造影剂全氟戊烷,在室温下以液体形式存在,而在注射进入人体以后,当达到相变温度,发生液气相变变为气态,达到超声显影增强目的[14]。
所研制的纳米粒子具有粒径适宜、稳定性高的特点。粒径在200 nm 左右的PMINPs 可通过实体瘤的高通透性和滞留效应在肿瘤部位富集。因此,在近红外激光照射下,富集在肿瘤部位的光敏剂ICG 迅速升温杀伤肿瘤而对正常组织的杀伤作用较小。重要的是,由于温度迅速上升,PFP 转变为气泡增强超声成像。同时,纳米颗粒释放出MnCl2,其体积小,可以更好地穿透肿瘤,获得更均匀的磁共振成像结果。通过一系列的表征,证实PMINPs具有良好的肿瘤吸收能力,可用于乳腺癌超声/磁共振双模成像及治疗。在以后的研究工作中,还有以下几个方面的工作需要完善:可尝试在纳米微球表面修饰靶向物如适配体,叶酸等,增加其靶向性;进一步研究纳米微球在动物体内的成像与治疗效果等,为临床应用奠定试验基础。
