耐碳青霉烯类肠杆菌科细菌的耐药基因及同源性分析
2021-06-11陈晨周俊英李一荣杨京冬
陈晨 周俊英 李一荣 杨京冬
近年来由于抗菌药物的不合理使用,使得临床分离的细菌对抗菌药物的敏感性逐渐降低,给临床抗感染治疗带来困难。目前临床上最受重视的是产超广谱β-内酰胺酶的革兰阴性杆菌,其中以肺炎克雷伯菌、大肠埃希菌等多重耐药的肠杆菌科细菌与人们的生活紧密相关[1-2],碳青霉烯类药物不合理使用导致出现了耐碳青霉烯类肠杆菌科细菌(Carbap-enem resistant Enterobacteriaceae,CRE)[3-4]。肠杆菌基因间重复序列(enterobacterial repetitive intergen-ic consensus sequence,ERIC)广泛存在于肠道细菌中,长约124~127 bp[5],其中存在高度保守长约40 bp 的核心序列,两个重复序列在肠道细菌基因组中存在着属、种、株水平上的分布和拷贝数量的差异,这些重复序列本身在进化过程中具有较强的保守性,ERIC-PCR 具有快速、简单、分辨率高和使用设备简单等优点[6],使得它在细菌分类、分子微生物生态学研究中有着广阔的应用前景。本研究采取微生物鉴定药敏系统进行CRE 的判定,挑选对亚胺培南不敏感的肠杆菌科细菌,改良Hodge 实验进行表型筛选,PCR 检测CRE 菌株的五种常见耐药基因(KPC、VIM、IMP、NDM和OXA)。选取17株分离自ICU 的基因型均为KPC 的耐碳青霉烯类肺炎克雷伯菌(Carbapenem resistant Enterobacteria-ceaeKlebsiella pneumoniae,CRKP)进行ERIC-PCR和同源性分析,判断重症医学科室内的CRKP 菌株是否为同一亚型或同一克隆株,从而了解细菌的流行病学特征。
1 材料与方法
1.1 材料
1.1.1 菌株来源
通过法国梅里埃VITEK 2 COMPACT 对本院2017年2月至2017年11月间60 株耐碳青霉烯类肠杆菌科细菌(CRE)进行鉴定,药敏结果参照CLSIM100(2017),且改良Hodge 实验[7]初筛结果为阳性;细菌经鉴定后置-40℃恒温冰箱中保存,改良Hodge 实验以大肠埃希菌ATCC25922为质控菌株。
1.1.2 试剂和仪器
美罗培南、亚胺培南、厄他培南由英国OXOID公司提供,细菌基因组DNA 提取试剂盒(离心柱型)DP302,Taq 酶、dNTPs、MgCl2、10x buffer(Mg+2 plus/free)DNA 100 bp/DS5000 Marker,由天根生化科技(北京)有限公司提供,PCR 引物序列由北京擎科新业生物技术有限公司合成。Bio-Rad 普通PCR 仪(Bio-Rad 公司/美国),NanoDrop 2000(Thermo Scientific/美国),电泳仪(PAC3000)和紫外凝胶成像及分析系统仪(Bio-Rad 公司/美国)。
1.2 方法
1.2.1 细菌的选取
选取60 株Hodge 实验为阳性的CRE 菌株,标本的分离培养与鉴定操作依据《全国临床检验操作流程》(第四版)[8]进行。
1.2.2 改良Hodge 实验
以厄他培南为底物纸片进行改良Hodge 实验,阴性结果再用美罗培南与亚胺培南纸片。以大肠埃希菌ATCC25922 为阴性对照,若任一药敏纸片被测菌株与大肠埃希菌ATCC25922 抑菌圈交汇处出现大肠埃希菌生长增强的现象,即可记录为改良Hodge 实验结果阳性。
1.2.3 细菌DNA 提取
按照天根细菌基因组DNA 提取试剂盒说明书进行,实验方法可见天根生化科技(北京)有限公司生产的细菌基因组DNA 提取试剂盒(离心柱型),DP302 型号说明书。
将DNA 收集到离心管中,按照NanoDrop 2000 微量紫外分光光度计中文操作手册检测DNA 浓度、纯度并记录。并将提取DNA 作为后续PCR 反应模板于-40℃冰箱中保存备用。
1.2.4 PCR 引物合成序列
KPC、IMP、OXA-48、VIM、NDM 5 种PCR 引物序列见表1。

表1 碳青霉烯酶基因所用的PCR 引物序列Table 1 PCR primer sequence of carbapenase gene
1.2.5 耐药基因扩增
扩增体系:Buffer 2.5 μL,Mg2+2.5 μL,dNTPs 1 μL,引物F 和R 各1 μL,Taq(5 U/μL)1.5 μL,DNA 2 μL,H2O214.5 μL。IMP 的反应条件为:94℃变性10 min;94℃30 s,55℃40 s,72℃50 s,36个循环;72℃延伸5 min;KPC 的反应条件为:94℃变性10 min;94℃30 s,56℃40 s,72℃50 s,36 个循环;72℃延伸5 min;OXA、VIM 及NDM 的反应条件为:94℃变性10 min;94℃30 s,58℃40 s,72℃50 s,36个循环;72℃延伸5 min。电泳参数为90 V,20 min。
1.2.6 肠杆菌基因间重复序列PCR 与同源性分析
采用肠杆菌基因间重复一致序列PCR(Enterobacterial repetitive intergenic consensus PCR,ERIC-PCR)进行基因扩增,ERIC-2 单引物序列为AAGTAAGTGACTGGGGTGAGCG(5′-3′)[9]。
反应体系:Buffer 2 μL,Mg2+1.25 μL,dNTPs 1.6 μL,引物1 μL,Taq(5 U/μL)0.6 μL,DNA 1 μL,H2O212.55 μL;反应条件为:94℃变性5 min;94℃30 s,44.5℃45 s,72℃2 min,35 个循环;72℃延伸10 min。选取17 株基因型为KPC 的耐碳青霉烯类肺炎克雷伯菌(CRKP)进行同源性分析,采用生物信息分析软件(Bionumerics)图像分析软件对其进行聚类分析,判断标准:按照Tenover[10]的判断标准,①图谱完全相同为一个型;②相差一个带为同一型的不同亚型;③相差2~3 个带为紧密相关;④相差4~6 个带为可能相关;⑤相差7 个以上条带为无亲缘关系。
2 结果
2.1 细菌的种类与临床分布
60 株CRE 中包括肺炎克雷伯菌53 株(88.33%),大肠埃希菌3 株(5%),阴沟肠杆菌3 株(5%),弗氏柠檬酸杆1 株(1.67%);标本以痰和纤支镜灌洗液为主,痰和灌洗液分离出28 株,构成比为46.67%,其次是尿液为16 株,构成比为26.67%,伤口分泌物和血液为4 株,构成比为6.67%、导管尖端和引流液,为3 株,构成比为5.00%;科室分布主要是重症医学科,为21 株,其次新生儿科检出7 株,呼吸及危重症医学科检出8 株,血液科检出5 株,泌尿外科检出3 株,其他科室检出16 株。
2.2 不同底物的改良Hodge 实验结果
以厄他培南(10 μg/片)纸片为底物对60 株CRE 菌株做改良Hodge 实验,检出57 株厄他培南改良Hodge 实验阳性株。改良Hodge 试验结果。见图1。

图1 改良Hodge 试验结果Figure 1 Modified Hodge test results
再对剩余3 株未检测出厄他培南底物纸片改良Hodge 实验阳性菌株,分别同时进行亚胺培南与美罗培南改良Hodge 实验检测,结果见表2。

表2 3 株改良Hodge 实验阴性的菌株结果Table 2 Results of 3 strains of modified Hodge negative
综合3 种底物纸片结果,厄他培南改良Hodge实验对产KPC型A 类碳青霉烯酶的菌株阳性率为100%(50 株/50 株),33.3%(3 株/9 株)的产NDM型B 类金属β-内酰胺酶的菌株在厄他培南改良Hodge 实验中结果为阴性,但补充亚胺培南与美罗培南改良Hodge 实验后仍可鉴定为阳性株。
2.3 耐药基因扩增结果
60株CRE中有58株扩增出相关耐药基因。KPC有50 株占86.21%,NDM 有9 株占15.52%,IMP 有2株占3.45%。同时扩增出KPC和IMP的有2 株占3.45%,同时扩增出KPC和NDM的有1 株占1.72%,其中60株均未扩增出OXA-48、VIM。见图2。
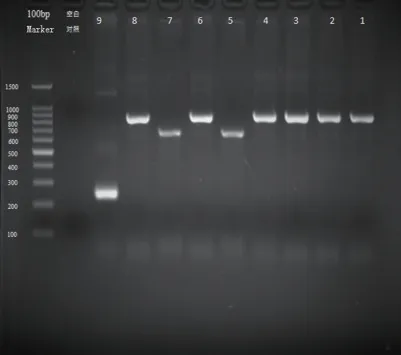
图2 五种耐药基因扩增结果Figure 2 PCR results of five drug-resistant genes
2.4 ERIC-PCR 同源性分析
应用bionumerics 软件进行聚类分析,结果如图3所示。以相关系数(±0.50~±0.80)为显著相关,相关系数(±0.80~±1.00)为高度相关。17 株CRKP 的扩增结果可聚为3 类。菌株14、16、10、13、17、8 可聚为一大类:其中菌株8 和17 亲缘关系最近,相关系数最高达到了0.76,菌株14 和16 相关系数达到了0.75,菌株10 和16 相关系数达到了0.71,这3 对菌株表现出较高的同源性;菌株11、15聚为一类:相关系数为0.57,显著相关;菌株2、4、12、1、5、6、3、9、7 另聚为一大类:其中菌株1 和12相关系数达到0.72,表现出较高的同源性。见图3。

图3 CRKP 的同源性分析Figure 3 Romology analysis of CRKP
3 结论
60 株CRE 菌株中,以肺炎克雷伯菌为主占88.33%;标本类型主要为呼吸道标本(痰及支气管灌洗液)占46.67%,尿液、血液等样本均有分离,这提示可能存在多部位感染;科室以重症监护室为主占35%,广谱抗菌素的使用及支气管镜等侵入性操作是感染CRE 的主要高危因素[11],医院应加强院内感染管理工作,通过隔离感染者、对细菌耐药进行网报监管、手卫生、以及加强病区环境与器材的消毒等措施控制院内感染的发生。
CRE 的耐药基因型以KPC(86.21%)和NDM(15.52%)为主,这与陆[12]等的以KPC和IMP结论有所不同,推测可能与地域有关。本研究发现CRE 菌株存在一定的多重耐药基因情况,58 株CRE 菌株中,有3 株同时存在2 种耐药基因占5.17%,CRE 菌株的多重耐药将给临床用药治疗带来更大困难与风险,临床医生在治疗时应慎重使用抗菌药物。另有两株菌株未检出KPC、NDM、IMP、VIM与OXA这五种基因型中的任何一种,可能属于少见的耐药基因型,有待进一步研究。
自ICU 分离的17 株CRKP 表现出较高的同源性,相关系数最高的2 菌株达到0.76,但未见同一克隆株的暴发流行,这提示医院仍要继续加强院内感染的监测与防护,加强医护人员的培训管理,一旦发现患者有耐碳青霉烯类肠杆菌科细菌感染或定植,应将该患者进行隔离,规范抗菌药物的合理使用,同时对CRKP 的流行趋势进行长期监控从而避免多重耐药菌株所产生的“无药可用”的严重后果。
