多模态心脏磁共振成像在急性病毒性心肌炎中的临床价值
2021-06-11徐梓毓谢尚煌袁海涛李彭文君
陈 蕾, 徐梓毓, 谢尚煌, 袁海涛李 博, 彭文君, 陈 新
(广东省深圳市龙岗中心医院, 1. 医学影像科, 2. 心血管内科, 广东 深圳, 518000;3. 吉林大学白求恩第一医院 医学影像科, 吉林 长春, 130000)
病毒性心肌炎(VMC)是由病毒感染所致的局限性或弥漫性心肌炎病变,临床表现轻重不一,轻者可无自觉症状,重者表现为心律失常、心源性休克或(和)心力衰竭,甚至猝死[1-2]。多模态心脏磁共振成像(CMR)是一种操作安全、可重复性高的无创检查手段,提高了VMC诊断的准确度和安全性,但影像学特征与实验室指标尚缺乏横向研究结果[3]。本研究对急性病毒性心肌炎(AVM)进行多模态CMR检查, AVM早期诊断方面的研究与心肌损伤程度的影像学定量检测的结合分析为本病提供更多诊断信息,有助于临床构建具有更高敏感性和特异性的检查方案。
1 资料与方法
1.1 一般资料
选择2014年1月—2020年7月广东省深圳市龙岗中心医院收治的60例AVM患者为观察组,另选取40例健康志愿者为对照组。观察组男33例,女27例; 年龄25~45岁,平均(35.66±8.57)岁。对照组男21例,女19例,年龄24~45岁,平均(35.72±8.64)岁,均无心血管疾病,体格检查无异常,心电图及超声心动图正常。2组受检者性别、年龄比较,差异无统计学意义(P>0.05)。纳入标准: ① 符合AVM诊断标准,经心电图、超声心动图及心肌酶学、心内膜心肌活检等手段确诊,且表现出新发(14 d内)心肌炎症状(胸痛、心悸、疲劳、乏力、气促等)者; ② 心肌炎症状出现前1~3周内有上呼吸道感染、肠道病毒感染史者; ③ 心率低于100次/min者; ④ 冠状动脉造影、CT冠状动脉成像检查结果呈阴性者。
排除标准: ① 有CMR检查禁忌证或难以配合完成检查者; ② 合并二尖瓣脱垂综合征,甲状腺、β受体功能亢进和克山病、结缔组织病、冠心病、代谢性疾病等影响心肌功能疾病以及药物、毒物诱发的心脏损伤等患者; ③ 恶性肿瘤者; ④ 严重心、肝、肺、肾功能障碍者; ⑤ 幽闭恐惧症者; ⑥ 对比剂过敏者; ⑦ 妊娠、哺乳期妇女; ⑧ 合并除AVM外其他感染性、炎性疾病者。
1.2 方法
采用3.0T超导型磁共振成像仪(Verio, 德国西门子公司)对心脏进行扫描,最大梯度场45 mT/m, 最大梯度切换率200 mT/(m·ms), 采用12通道表面相控阵线圈,心电门控采用磁共振兼容的无线矢量心电门控板。扫描方案: ① 心脏形态功能成像,常规心脏定位、心脏形态和心脏电影扫描。采用平衡稳态自由进动序列,扫描参数为层厚8 mm, 层间隔为0 mm, 矩阵为 256 × 256, 扫描野为350 mm×350 mm, 采集两腔心、四腔心及左室短轴位。② T1 Mapping成像。于注入对比剂前和对比增强15 min内扫描,扫描序列采用运动自动矫正True FISP序列,采集层面包括四腔心和左室短轴切面(基底段、中央段及心尖段), TR=RR间期, TE 1.1 ms, 反转角35 °, 层厚6 mm, GRAPPA加速因子2。③ 定量T2 Mapping使用饱和度准备, T2准备射频扰相梯度回波序列,并应用3D、自由呼吸扫描模式。参数设置T2准备时间为0 ms、25 ms、45 ms, 重复时间为3.3 ms, 回波时间为1.0 ms, 矩阵为256×256, 反转角为 18 °, 采集层面同T1 Mapping成像。④ 首过灌注成像。高压注射器静脉团注细胞外造影剂钆喷酸葡胺注射液Gd-DTPA, 注射速度5.0 mL/s, 注射剂量0.1 mmol/kg, 采集层面同T1 Mapping成像。⑤ 延迟增强扫描。采用二维Segment Turbo-FLASH序列,剂量为0.2 mmol/kg, 注射速率为2.0 mL/s, 延迟10~15 min收集两腔心及四腔心、左室短轴位。此后随访中均采用同一设备及扫描序列、参数。
采集3 mL受试者清晨空腹静脉血, 3 000转/min离心15 min, 取上层血清-80 ℃冷存待检。采用酶联免疫吸附法(ELISA)检测待测样本中白细胞介素-6(IL-6)、肿瘤坏死因子-α(TNF-α)水平,试剂盒购自北京科杰生物技术有限公司,由专业人员严格参照试剂盒说明书进行操作。
1.3 图像分析、定量测量
1.3.1 心脏形态功能分析: 采用设备自备的Syngo. Via软件包对心功能进行分析,载入自基底段到心尖段左心室所有电影图像并浏览,调整软件的默认期相为最大收缩末期及舒张末期,如有需要进行手动调整。软件自动描记左心室内膜与心外膜,手动调整软件识别错误的地方。根据美国心脏病协会17节段分析法,测量各节段室壁厚度。软件自动将左室收缩末容积(LVESV)、左室舒张末容积(LVEDV)、射血分数(EF)、心输出量(CO)和心肌质量(MM)等心功能参数输出。
1.3.2 心肌首过灌注分析: 依据美国心脏病协会心肌17段分型方法,绘制除心尖外的心尖部侧壁、间壁、前壁、下壁,基底部,中间部前侧壁、下壁、前间壁、前壁、下间壁、下侧壁等16个节段心肌及左心室血池层面时间-信号强度的心肌灌注曲线,并记录心肌灌注曲线下面积比、相对峰值信号强度和达峰时间等灌注参数。根据曲线下面积比值所代表的各节段心肌灌注情况,将观察组异常灌注曲线分成灌注减低区(总体灌注曲线下面积比31%~44%)和灌注缺损区(总体灌注曲线下面积比<31%),对照组灌注正常区为总体灌注曲线下面积比>44%[4]。
1.3.3 磁共振成像参数成像图像分析: 将图像载入离线工作站,采用商业化软件包(Syngo Verio 3.0)分别对图像进行分析,依据美国心脏病协会心肌17段分型方法,描记并测量每一段心肌平均T1、T2值。测量时,尽量避开可能出现部分容积效应接近心内、心外膜区域及左心室血池。
1.3.4 延迟增强图像分析: 将延迟增强图像载入离线工作站,应用商业化软件包进行分析,以平均左室信号强度及6SD值作为阈值。依据美国心脏病协会心肌17节段分型方法,定性判断并记录每一节段心肌是否存在延迟强化病灶,并自动计算磁共振成像延迟强化成像(LGE)体积及LGE占左心室质量百分比。
1.4 统计学方法
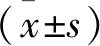
2 结 果
2.1 2组受检者CMR参数及炎性因子水平比较
观察组LVEDV、LVESV、MM、平均T1值、平均T2值、LGE体积、LGE占左心室质量百分比、IL-6、TNF-α水平均高于对照组,达峰时间长于对照组,而EF、CO、心肌灌注曲线下面积比、相对峰值信号强度均低于对照组,差异有统计学意义(P<0.05), 见表1。

表1 2组受检者CMR参数及炎性因子水平比较
2.2 CMR参数与炎性因子关系
Pearson相关分析结果显示, LVEDV、LVESV、MM、达峰时间、平均T1值、平均T2值、LGE体积、LGE占左心室质量百分比均与IL-6、TNF-α呈正相关,而EF、CO、心肌灌注曲线下面积比、相对峰值信号强度均与IL-6、TNF-α呈负相关(P<0.05), 见表2。

表2 CMR参数与炎性因子相关性分析
2.3 CMR参数单项及联合检测对AVM的诊断效能
ROC曲线显示, EF、LVEDV、LVESV、CO、MM、心肌灌注曲线下面积比、相对峰值信号强度、达峰时间、平均T1值、平均T2值、LGE体积、LGE占左心室质量百分比诊断AVM的AUC分别为0.747、0.740、0.823、0.750、0.743、0.815、0.796、0.728、0.851、0.840、0.750、0.752,具有一定准确性。
将CMR各参数放入Logistic回归模型中,以回归系数计算联合检测数值。联合检测=EF+LVEDV×(-0.029/0.103)+LVESV×(-0.093/0.103)+CO×(1.290/0.103)+MM×(-0.016/0.103)+心肌灌注曲线下面积比×(0.374/0.103)+相对峰值信号强度×(0.318/0.103)+达峰时间×(-0.134/0.103)+平均T1值×(-0.030/0.103)+平均T2值×(-0.224/0.103)+LGE体积×(-0.581/0.103)+LGE占左心室质量百分比×(-6.230/0.103)。ROC曲线显示,联合检测AUC为0.943, 敏感度、特异度分别为86.70%、100.00%, 均高于CMR各参数单项检测,提示联合检测的诊断价值较高,见图1、表3。


A: LVEDV、LVESV、MM、达峰时间、平均T1值、平均T2值、LGE体积、LGE占左心室质量百分比诊断AVM的ROC曲线图; B: EF、CO、心肌灌注曲线下面积比、相对峰值信号强度及联合检测诊断AVM的ROC曲线图。图1 CMR参数单项及联合检测诊断AVM的ROC曲线

表3 CMR参数单项及联合检测对AVM的诊断效能
3 讨 论
AVM临床表现缺乏特异性,临床中多采用肌钙蛋白(cTnI)和心肌酶谱来评估心肌损伤程度,是VMC诊断、病情发展、预后评估的重要手段,但该类指标易受其他因素影响,持续时间短,且特异性低,给临床诊断和治疗带来一定困难[5]。因此,寻找一种简单、无创、准确度高的检查方式对AVM的早期诊断尤为重要[6]。
3.0 T磁共振成像的广泛应用、梯度场切换率提升和多通道技术日趋完善扩展了CMR检查的临床运用范畴[7]。多模态CMR具有多方位成像、良好软组织对比和高空间分布率等特点,除了常用的心脏形态、功能、心肌延迟强化等成像技术外,还增加了首过灌注成像(MPI)及磁共振参数成像(T1/T2 Mapping), 使得CMR检查不但能评估心功能,而且还能定量反映心肌纤维化范围、程度及心肌出血水肿情况,在心肌活性、心肌损伤危险区域评估方面显示出极大优势[8-9]。
MR延迟强化成像(LGE)可以显示纤维化位置、范围,定性评估心肌情况,利用后处理软件可以对局灶纤维化体积及左心室占比进行定量测量。磁共振参数T1/T2 Mapping成像在心肌水肿诊断、可逆性心肌损伤鉴别诊断、急性VMC的早期诊断及治疗中意义重大[10]。T1 Mapping为多心动周期时相相同而反转时间(T1)不同下采集图像,借助心肌各个体素T1值进行定量测定,反映心肌T1值的差异,与常规T1W1比较, T1 Mapping无需与正常心肌信号进行对比,心脏T1 Mapping平扫T1值>5 SD即提示AVM。T2 Mapping成像通过T2时间稳态自由进动序列(SSFP)的设定,以不同T2时间产生不同T2W1, 并依据拟合参数方程获知各图像像素,以高低信号反映回波时间差异,实现量化分析T2值[11-12]。
本研究结果显示, AVM患者的LVEDV、LVESV、MM、达峰时间、平均T1值、平均T2值、LGE体积、LGE占左心室质量百分比、IL-6、TNF-α水平等指标均高于健康人群, EF、CO、心肌灌注曲线下面积比、相对峰值信号强度均低于健康人群,原因为病毒感染心肌细胞并大量增殖,损伤心肌,宿主免疫反应过程中,病毒特异T细胞攻击心肌细胞,加剧心肌细胞损伤,对心脏收缩、舒张功能造成影响[13], 而EF、LVEDV、LVESV、CO、MM、心肌灌注曲线下面积比、相对峰值信号强度、达峰时间、平均T1值、平均T2值、LGE体积、LGE占左心室质量百分比等均与IL-6、TNF-α水平相关,而IL-6、TNF-α水平变化与病情严重程度及不良预后相关[14], 提示多模态CMR能用于评估AVM患者病情严重程度及预后情况。此外, ROC曲线显示, CMR各参数对AVM均具有一定诊断价值,且各参数联合检测的诊断价值更高(AUC=0.943, 敏感度、特异度为86.70%、100.00%), 提示多模态CMR检查可用于AVM的早期诊断。综上所述,多模态CMR可快速、准确地诊断出AVM, 临床价值较高。
