慢性乙型肝炎进展为肝细胞癌危险因素的Meta分析
2021-06-11雷莎文国容金海庹必光
雷莎,文国容,金海,庹必光
遵义医科大学附属医院消化内科,贵州 遵义 563000
原发性肝癌(primary liver cancer,PLC)是起源于肝脏上皮细胞或间叶组织的一类恶性肿瘤,具有起病隐匿、进展快、病死率高等特点,是全球第四大常见肿瘤和第二大常见癌症死亡原因[1],而肝细胞癌(hepatocellular carcinoma,HCC)是最常见的PLC,占肝癌的75%~85%[2]。到目前为止其致病原因尚不明确,据临床研究显示,乙型肝炎病毒(hepatitis B virus,HBV)感染是导致HCC发生的重要因素[3]。虽有大量的研究表明应用核苷(酸)类似物(nucleoside analogues,NAs)抗病毒治疗能有效的降低CHB进展为HCC的风险[4],但其并不能完全阻止HCC的发生[5-6],可见慢性乙型肝炎(chronic hepatitis B,CHB)进展为HCC除病毒因素影响外,还存在其他相关危险因素,本研究对CHB进展为HCC的危险因素进行Meta分析,希望能为预防CHB进展为HCC提供一定的理论依据。
1 资料与方法
1.1 检索方法 (1)中文检索式:主题=“(慢性乙型肝炎”+“慢性乙型病毒性肝炎”+“慢性乙肝”+“慢性病毒性乙型肝炎”+“乙型肝炎,慢性”)*主题=“(肝脏肿瘤”+“肝部肿瘤”+“肝癌”+“原发性肝癌”+“肝恶性肿瘤”+“原发性肝细胞癌”+“肝脏恶性肿瘤”+“肝细胞癌”+“肝肿瘤”)。(2)外文检索式:TS=(Hepatitis B,Chronic or Chronic Hepatitis B Virus Infection or Chronic Hepatitis B or Hepatitis B Virus Infection,Chronic)*TS=(Liver Neoplasms or Neoplasms,Hepatic or Neoplasms,Liver or Liver Neoplasm or Neoplasm,Liver or Hepatic Neoplasms or Hepatic Neoplasm or Neoplasm,Hepatic or Cancer of Liver or Hepatocellular Cancer or Cancers,Hepatocellular or Hepatocellular Cancers or Hepatic Cancer or Cancer,Hepatic or Cancers,Hepatic or Hepatic Cancers or Liver Cancer or Cancer,Liver or Cancers,Liver or Liver Cancers or Cancer of the Liver or Cancer,Hepatocellular)。计算机检索CNKI、WANGFNAG、CBM、VIP、pubmed、EMBASE、Cochrane、Web of Science数据库,检索时间为建库至2020年8月,无语种限制,未检索灰色文献。
1.2 纳入标准 (1)研究对象:病例组为明确诊断为CHB相关的HCC患者,对照组为明确诊断为未发生HCC的CHB患者。(2)暴露因素:研究的危险因素。(3)研究类型:病例对照研究。
1.3 排除标准 (1)排除重复发表、无关文献、会议摘要、信息不全。(2)综述、病例报道、会议摘要、动物研究、非原始研究。
1.4 筛选及质量评价标准 由两名独立研究员依据病例对照研究基本特征,采用New-castle-Ottawa Score评分量表对病例对照研究进行独立筛选文献及质量评价,对存在分歧难以确定的文献通过第三方讨论解决,质量评价内容如下:研究对象选择(4分),组间可比性(2分),结果测量(3分),总分9分,总分越高说明纳入文献质量越高,一般认为≥6分为高质量研究。
1.5 统计学方法 将原始研究中数据录入EXCEL表格中,其主要内容包括:文献内容及年份、国籍、研究类型、研究对象、暴露因素、文献质量。采用Cochrane协作网提供的RevMan 5.3软件进行Meta分析,以比值比OR作为合并指标,采用χ2检验分析纳入研究结果间的异质性(检验水准为α=0.1),同时结合I2定量判断异质性大小。若P>0.10,I2<50%表示各研究结果间差异性较小,则采用固定效应模型(FE)分析;若P≤0.10,I2≥50%表明各研究结果间存在统计学异质性,则进一步分析异质性来源并对该异质性进行合理解释,在排除明显异质性的影响后采用随机效应模型(RE)分析。根据所合并的效应量绘制相应的漏斗图,通过漏斗图来检验是否存在发表偏移,如该图对称则表明可能不存在发表偏移,如不对称则表示可能存在发表偏移。通过比较固定效应模型和随机效应模型结果分析检测Meta分析结果的稳定性。以P<0.05为差异有统计学意义。
2 结果
2.1 文献检索结果 总共检索文献1 016篇,电脑去重120篇,手动去重54篇,仔细阅读题目及摘要剔除810篇,通读全文不符合纳入标准46篇,最终纳入11篇病例对照研究进行Meta分析,总人数为13 240例,病例组1 311例,对照组11 929例。
2.2 纳入文献一般特征 共纳入研究11篇,8篇来自中国,1篇来自韩国,2篇来自美国,提取CHB患者进展为HCC的危险因素19个,见表1。
2.3 CHB进展为HCC的危险因素Meta分析 见表2。
2.3.1 肝癌家族史 纳入文献7篇,应用固定效应模型进行Meta分析(P=0.14,I2=37%),病例组发生HCC的危险比是对照组的3.08倍,两组间差异具有统计学意义(OR=3.08,95%CI:2.75~3.47,P=0.00),通过漏斗图可知,该研究无发表偏移,对7篇文献进行敏感性分析,表明该研究稳定性较好(图1、图2)。
2.3.2 HBV DNA>104UI/mL 纳入文献6篇,Meta分析示(P=0.09,I2=47%)故采用固定效应模型分析,病例组发生HCC的危险比是对照组的4.23倍,两组间差异有统计学意义(OR=4.23,95%CI:3.55~5.04,P=0.00),漏斗图对称表示无发表偏移,通过敏感性分析证实,研究稳定性良好。
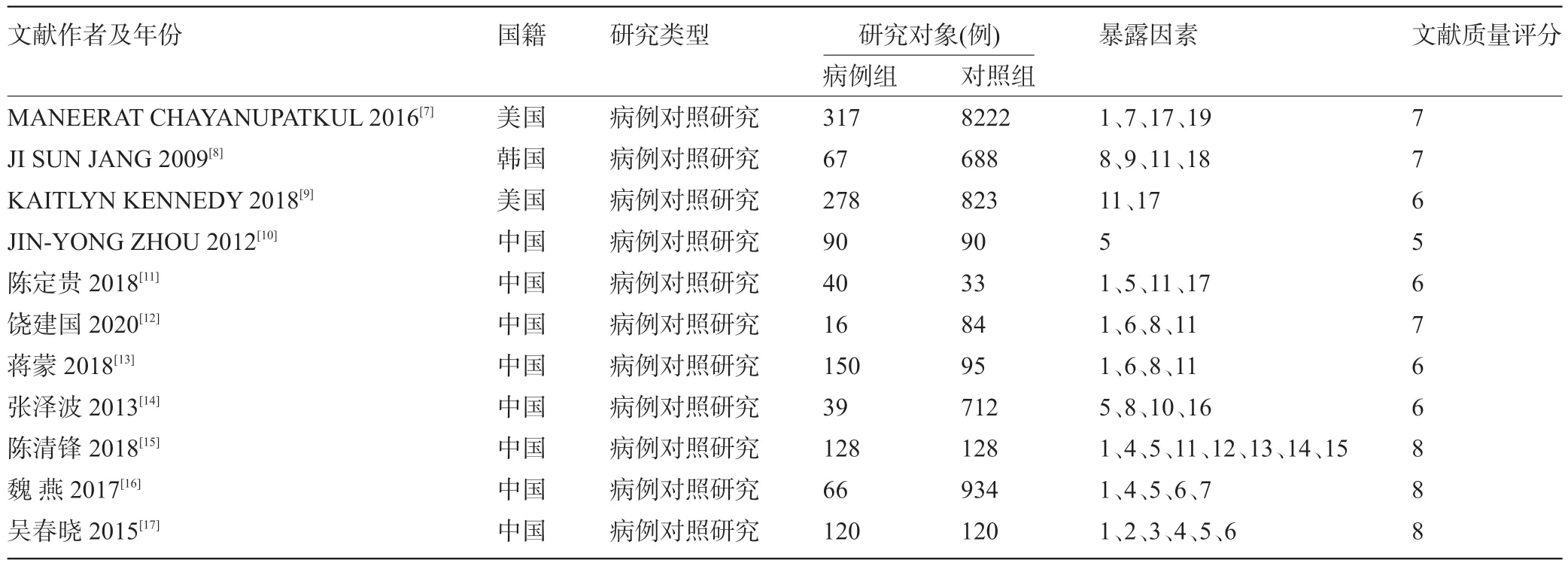
表1 纳入研究的基本特征
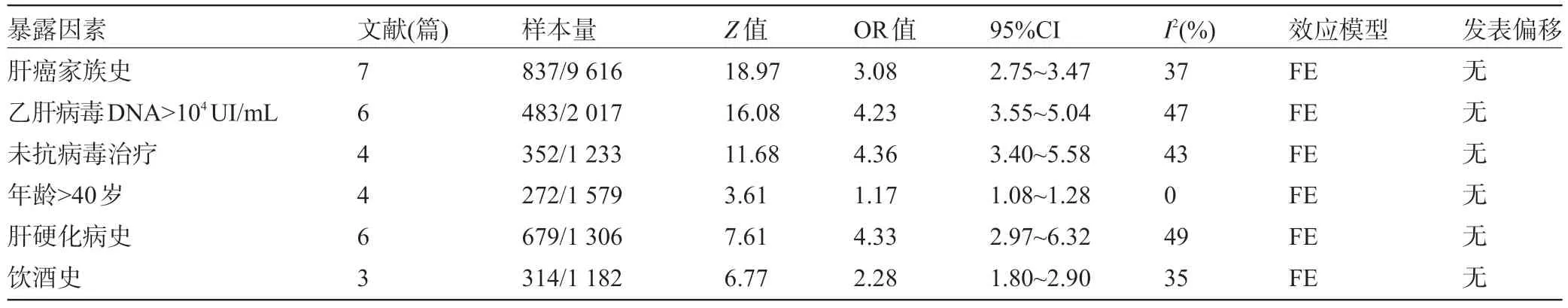
表2 CHB进展为HCC的危险因素Meta分析
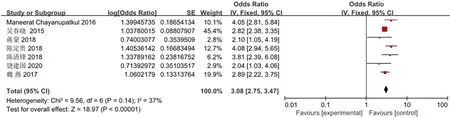
图1 肝癌家族史对于CHB进展为HCC的危险因素Meta分析森林图
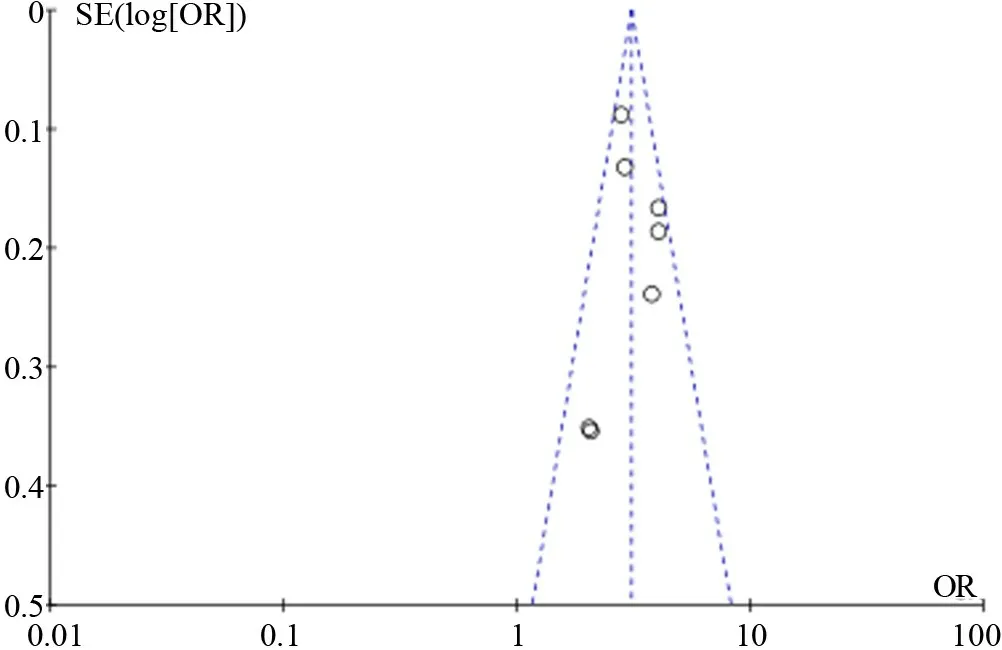
图2 肝癌家族史对于CHB进展为肝细胞癌的危险因素Meta分析漏斗图
2.3.3 未抗病毒治疗 纳入文献4篇,通过森林图可知P=0.15,I2=43%,因此采用固定效应模型进行数据的合并,两组间差异具有统计学意义(OR=4.36,95%CI:3.40~5.58,P=0.00),漏斗图对称无发表偏移,敏感性分析提示本研究稳定性好,病例组发生HCC的危险性是对照组的4.36倍。
2.3.4 年龄>40岁 纳入文献4篇,应用固定效应模型进行Meta分析(P=0.05,I2=0%),病例组发生HCC的危险比是对照组的1.17倍,两组间差异具有统计学意义(OR=1.17,95%CI:1.08~1.28,P=0.00),通过漏斗图可知,提示该研究无发表偏移,对4篇文献进行敏感性分析,表明该研究稳定性较好。
2.3.5 肝硬化史 纳入文献6篇,森林图显示P=0.00,I2=84%,选择随机效应模型进行分析,但剔除Kaitlyn Kennedy的文献后,通过森林图可知(P=0.10,I2=49%),故仍采用固定效应模型进行数据合并,两组间差异具有统计学意义(OR=4.33,95%CI:2.97~6.32,P=0.00),无发表偏移,稳定较好,病例组发生HCC的危险性是对照组的4.33倍。
2.3.6 饮酒史 纳入文献3篇,应用固定效应模型进行Meta分析(P=0.22,I2=35%),病例组发生HCC的危险比是对照组的2.63倍,两组间差异具有统计学意义(OR=2.63,95%CI:1.67~4.15,P=0.00),通过漏斗图可知,提示该研究无发表偏移,对3篇文献进行敏感性分析,表明该研究稳定性较好。
3 讨论
慢性HBV感染是严重的全球公共卫生事件,据相关卫生统计全球约有2.5亿人感染HBV[18],其中中国约有1.2亿HBV携带者,据世界卫生组织估计2015—2030年全球HBV相关HCC的死亡人数将达到500万,而HBV是所有致HCC因素中最重要的危险因素[19],近年来随着乙型肝炎疫苗的普遍接种、各种高效价抗病毒药物的相继使用,使得CHB患者发生HCC的发病率逐年下降,极大的改善了CHB患者的预后,有相关研究表明即使病毒因素得以控制,但仍有大部分CHB患者进展为了HCC[20],这提示还存在其他因素影响CHB进展为HCC,故本研究通过Meta分析合并效应量,希望探讨出CHB患者进展为HCC的可能危险因素,旨为临床医师进一步阻止CHB相关HCC的发生提供一定的理论依据。本系统评价提示,CHB患者进展为HCC的危险因素有19个,现对6个主要的危险因素进行简要分析。
3.1 未抗病毒治疗 在CHB患者的肝脏中,HBV的持续性感染可导致肝细胞炎症和损伤,随之而来的是肝细胞的再生、纤维形成和肝硬化的出现。在这一过程中,HBV DNA不断复制并整合到宿主基因组中,进而导致遗传不稳定、细胞生长和凋亡耐受信号失衡,同时伴有代谢紊乱、氧化损伤,这些都是HBV感染者向HCC发展的生物驱动力因子[21],如果HBV慢性感染者未予抗病毒治疗,体内HBV复制活跃,会使患HCC的风险增加。长期抗病毒治疗可以抑制人体内HBV的复制,降低表面抗原滴度并可使E抗原发生血清学转换,改善肝脏炎症,逆转肝纤维化与肝硬化,从而降低HCC的发生风险[22]。NGUYEN等[18]回顾性分析了6 914例CHB患者随访8年的结果,其中774名CHB接受抗病毒治疗,对照组为6 140例未接受抗病毒治疗的CHB患者,该研究显示,抗病毒治疗可大幅度降低肝硬化患者发生HCC的风险,也可降低非肝硬化患者发生HCC的风险。因此临床上对具有抗病毒指针的CHB患者,应做到早期发现并及时启动抗病毒治疗,积极寻找抗病毒依据,从而降低HCC的发生风险。
3.2 肝硬化病史 由慢性炎症和肝损伤介导的肝硬化是引起HCC发生的主要危险因素。据统计,80%~90%的HCC患者是在肝硬化的基础上发展而来的[23],相关的研究表明,HBV相关性肝硬化进展为HCC的年发病率为3.23%,且因肝硬化状态的不同,呈现出各异的发病率。针对西方人群的研究发现,HBV携带者、非肝硬化CHB患者、代偿性肝硬化CHB患者,其HCC年发生率分别为0.02%、0.3%和2.2%[24]。相关文献报道,即使有效的抗病毒治疗后,肝硬化仍然是CHB患者发生HCC的重要危险因素(HR 24.651,95%CI:3.018~201.365,P=0.003)[25]。肝炎后肝硬化加速肝纤维化的进展,改变了患者的免疫状态,导致抗肿瘤因子的异常表达,促进HCC的发生。
3.3 HBV DNA>104IU/mL 血浆或血清中HBV DNA的测定是HBV复制的一个具有重要临床意义的标志物,也是评估HBV感染者是否需要抗病毒治疗的一项重要参考指标,HBV DNA载量越高意味着发生HCC的风险可能越高。王艳巧等[26]人进行的一项回顾性研究表明,与HBV DNA阴性CHB患者相比HBV DNA阳性CHB患者患HCC的风险增加了4.162倍(95%CI 1.884~9.196,P<0.001)。中国台湾涉及3 653例CHB患者的前瞻性队列研究表明,HBV DNA>104IU/mL是此类患者进展为HCC的强烈预测因子,并独立于HBeAg、血清丙氨酸转氨酶水平和肝硬化[27]。HBV DNA反映的是患者体内病毒的复制情况,载量越高提示患者体内病毒复制越活跃,其致癌机理可能为病毒DNA整合到患者染色体上致使抑癌基因p53等位基因发生缺失和点突变,而抑癌基因p53的突变往往与HCC的发生密切相关。
3.4 肝癌家族史 本研究提示有肝癌家族史的患者相比于非肝癌家族史的患者患癌的风险高3.08倍,这与LIU等[28]研究结论较为一致,其患病一方面可能与饮食习惯有关,比如喜食腌制类食物、高脂饮食、霉变食物,一项以社区人群为研究对象的病例对照研究发现暴露于黄曲霉素B1的CHB患者发生HCC的危险比是未暴露组患者的5.39倍(P=0.0 368,95%CI=1.11~26.18),并呈现出剂量关系[29]。另一方面也可能与基因的表达相关,家庭成员中相互传染的HBV大多为同一基因型,肝癌的发生可能与HBV的基因型有关。在另一项以社区为基础的长期随访队列研究中,共有33 847例CHB患者参与研究,共发生153例HCC病例,在HBV基因型B或C感染患者中,每10万人1年的HCC发病率分别为305.6(95%CI=236.9~388.1)和785.8(95%CI=626.8~972.9)[30],肝 癌的发生与家族史之间的关联性尚未清楚,具体发病机理有待进一步的研究加以确认。
3.5 饮酒史 长期大量饮酒会引起肝脏代谢的改变,与其他饮食习惯和遗传因素一起,逐渐导致肝脏脂肪变性、酒精性肝炎、肝纤维化,最后是肝硬化,每年有1%~2%的肝硬化患者进展为肝癌[31]。一项汇总了19项队列研究结果的荟萃分析显示,酗酒者比不饮酒者患肝癌的风险更高[32]。与不饮酒相比,中度饮酒的相对危险度为0.91(95%CI 0.81~1.02),重度饮酒的相对危险度为1.16(95%CI 1.01~1.34)。即使在控制了其他危险因素情况下,这些关联也是显著的。大量饮酒会增加HBV感染、HCV感染和糖尿病患者发生肝癌的风险。在无肝硬化的长期大量饮酒患者中,肝癌的发病率为0.01/100人年,在酒精性肝硬化患者中的发病率为0.2/100人年。肝脏是酒精代谢、降解的主要场所,乙醇本身具有致癌性和致突变特性,长期大量饮酒引起肝脏解毒功能下降、营养素摄入量减少、机体免疫功能下降会诱发和促进肝癌的发生,同时大量的乙醇代谢产物蓄积在肝脏可能导致产生大量的自由基[33],加重HBV导致的肝损伤、肝纤维化及肝硬化,最终使患者发生HCC。
3.6 年龄>40岁 肝癌与年龄的关系非常密切。肝癌很少在40~50岁之前确诊。其发病率往往随年龄增长而增加,先达高峰后下降。肝癌的年龄分布因地区和国家不同而不同。在中国,肝癌确诊的平均年龄间隔为55~59岁;在欧洲和北美,平均年龄间隔为63~65岁;在低危人群中,平均年龄间隔为75岁或以上。男性的发病率上升到45岁,女性上升到60岁[34]。相关的研究表明,感染HBV的年龄越小,就越容易慢性化[35]。我国90%以上的围产期感染的婴儿有慢性HBV感染,年龄越大HCC发生风险越大,不仅与感染年龄有关,也可能是因为衰老伴随着肝细胞中端粒的缩短和异常DNA甲基化这些变化可能导致肝癌的发生,而且年龄在所有危险因素中属于不可调控的因素。本研究通过合并效应量后发现年龄>40岁与肝癌的发生显著相关,因此对于年龄大于40岁的HBV感染人群在临床中应该更加进行关注。
本研究存在一定局限性,首先是样本量较小,其次各危险因素所用数据相对较为欠缺,最后不同研究之间存在着一定的异质性。尽管如此,按照NOS的质量评价,均为高质量并符合科研原则的研究类文献,且通过比较固定效应模型和随机效应模型结果表明此次Meta分析结果的稳定性较好,故所得结论仍有一定临床价值,为了更好探索CHB患者进展为HCC的危险因素,从而为CHB患者的治疗提供策略,仍需要大样本、随机、前瞻性的研究。
综上所述,CHB进展为HCC的危险因素纷繁复杂,病死率高,通过此次Meta分析发现未抗病毒治疗、有肝硬化病史、HBV DNA>104IU/mL、肝癌家族史、大量饮酒史、年龄>40岁为CHB进展为HCC的危险因素,临床上对这部分人群应重点进行定期监测及治疗随访,早期发现肝脏不良结局并及时干预,进而改善长期预后。
