CT多期增强对预测小肠间质瘤危险度分级的诊断价值研究
2021-06-11陆方方陆静瑜
陆方方,陆静瑜
(1.洛阳市中心医院放射科,河南 洛阳 471000;2.苏州大学附属第一医院放射科,江苏 苏州 215006)
胃肠道间质瘤(gastrointestinal stromal tumor,GIST)是目前临床上最多见的消化道独立的间叶性肿瘤性病变,小肠GIST几乎占所有GIST的30%[1]。手术切除被认为是治疗局部GIST的主要方式。但是术后仍然有40%~80%的高复发率[2]。美国国立卫生组织(NIH)等指南推荐根据术后病理标本的肿瘤大小、原发部位、核分裂象以及肿瘤是否破裂来对GIST进行危险度分级[3]。在临床实践中,对于还未接受手术切除或无法手术切除的病灶,准确评估肿瘤的危险度存在较大的困难。因此,术前影像学评估对小肠GIST的治疗选择和预后评估都具有重大意义。本研究通过回顾经病理证实的小肠GIST,对其增强CT影像学特征进行定性及定量分析,旨在探讨增强CT对不同危险度等级的GIST的诊断价值。
1 资料与方法
1.1 临床资料 收集2013年1月—2019年12月经病理证实为小肠GIST且病灶最大径小于10 cm的患者84 例,男性47 例,女性37 例,平均年龄53 岁(26~71 岁)。
1.2 影像学检查方法 检查前患者禁食6~8 h,检查前1 h常规喝水1 500 mL。采用美国GE公司的Discovery CT750HD宝石能谱CT扫描仪进行扫描。扫描参数:管电压100 kV,管电流120~250 mA(careDose4D),准直器16.0 mm×1.2 mm,单圈旋转时间0.6 s,螺距0.984,重建层厚1.25 mm。增强对比剂采用非离子型造影剂优维显(370 mgI/mL)注射液(拜耳医药保健有限公司),用量1.5 mL/kg,注射速度为3.5 mL/s。采用膈顶水平主动脉CT阈值触发扫描,设定动脉期阈值120 HU,动脉期扫描延迟时间25~30 s,门脉期扫描延迟时间55~60 s。
1.3 图像定量分析方法 由两名具有5 年以上腹部影像诊断经验的医师独立回顾分析入组病例的CT图像,采用后处理软件CT Kinetics(GE Healthcare,China)对入组图像进行分析处理。两名医师各自于动脉期和静脉期图像上逐层沿肿瘤边缘勾画感兴趣区(ROI),最终得到整个瘤体的平均CT值(取两名观察者测量值的平均数)。
1.4 病理检查 术后组织送病理,行HE染色和免疫组化染色,根据肿瘤大小、原发部位、核分裂象以及肿瘤是否破裂将病灶分为高危、中危、低危及极低危4级[3]。
1.5 统计学方法 采用SPSS 20.0统计软件进行处理,采用单因素方差分析计算3组不同危险度的小肠GIST的容积CT值的平均值差异。若组间存在差异,再进行两两比较,方差齐性者采用LSD法;若方差不齐,则采用Tamhane's T2检验,以P<0.05为差异有统计学意义。
2 结果
最终,84 例小肠GIST患者中纳入高危组的有20 例,中危组13 例,低危组46 例,极低危组5例,由于极低危组病例数较少,本研究将极低危组并入低危组进行分析讨论。各组小肠GIST患者的基本信息及病灶部位、最大径、是否存在出血或坏死及病灶强化方式等信息如表1所示。
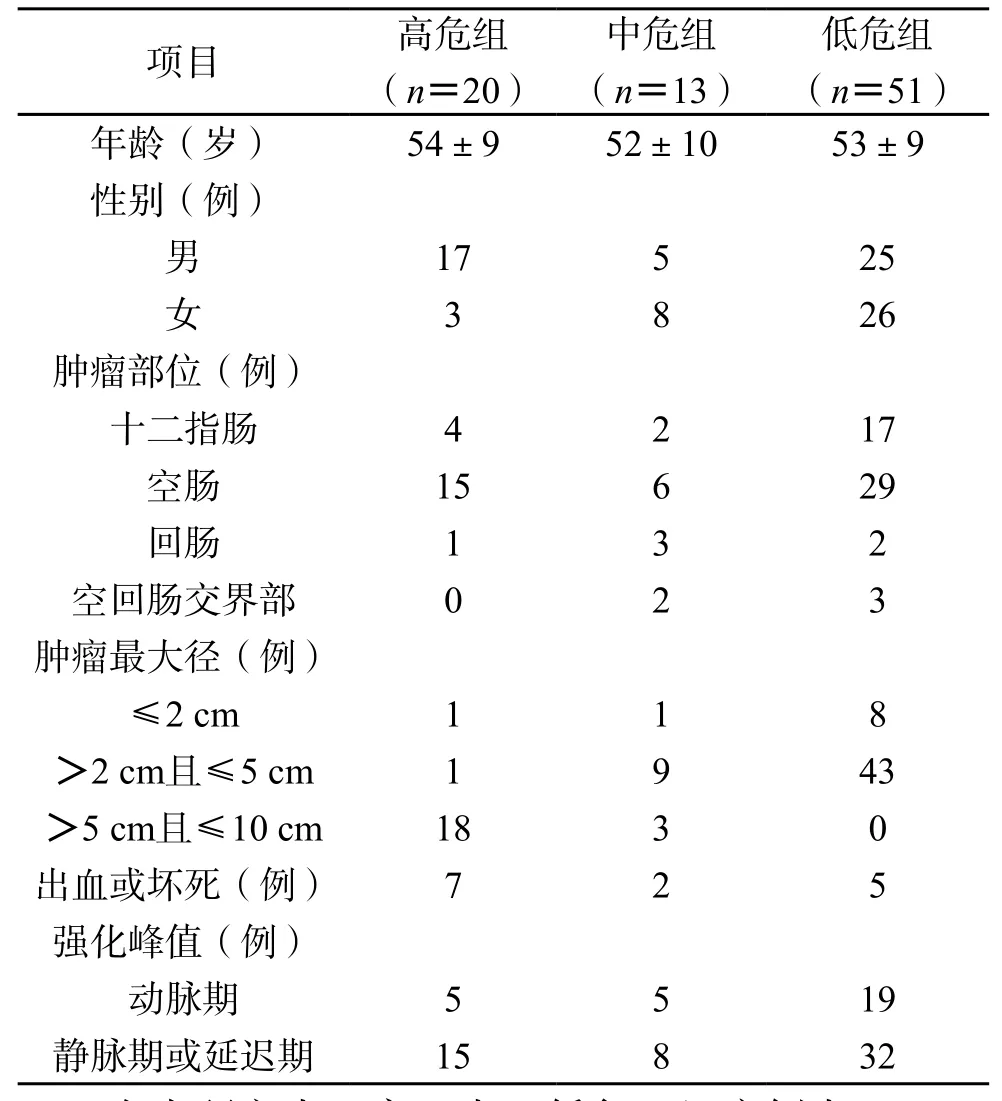
表1 不同危险度小肠GIST基本信息及定性CT特征比较
在本研究中,高、中、低危三组病例中,GIST位于空肠的发病率较其他部位高(高危:75%;中危:46%;低危:57%)。在病灶最大径≤2 cm的10 例病灶中,8 例为低危险度(80%);在>2 cm且≤5 cm范围内的53 例病灶中,43 例为低危险度(84%);在>5 cm且≤10 cm范围内的21 例病灶中,18 例为高危险度(86%)。在高危组中,肿瘤发生出血或坏死的有7 例(35%),中危组中有2 例(15%),低危组有5 例(10%)。在不同危险度组别中,增强扫描的强化峰值均更多地出现在静脉期或延迟期(高危:75%;中危:62%;低危:63%)。
容积CT值定量分析显示,无论是在动脉期还是静脉期,高、中、低三组间的容积平均CT值差异具有统计学意义(P<0.001),且肿瘤的容积平均CT值随着危险度的增高而减低。两组间比较发现,无论是在动脉期还是静脉期,高危组的平均CT值显著低于低危组(P<0.001)。在静脉期,中危组的平均CT值显著低于低危组(P=0.030)。见图1~图3,表2。

图1 男性,51 岁,十二指肠GIST(*),低危险度,肿瘤最大径2.5 cm,动脉期(1A)平均CT值121.75 HU,静脉期(1B)平均CT值137.75 HU。图2 男性,50 岁,回肠GIST(*),中危险度,肿瘤最大径6 cm,动脉期(2A)平均CT值66.25 HU,静脉期(2B)平均CT值63.88 HU。图3 男性,69 岁,空回肠交界区GIST(*),高危险度,肿瘤最大径7.5 cm,动脉期(3A)平均CT值61.25 HU,静脉期(3B)平均CT值54.77 HU。
表2 不同危险度小肠GIST动静脉期平均CT值比较(±s)

表2 不同危险度小肠GIST动静脉期平均CT值比较(±s)
时相 高危组(n=20) 中危组(n=13) 低危组(n=51) P值高vs中 高vs低 中vs低动脉期 64.01±16.25 78.69±25.12 92.25±25.22 0.084 <0.001 0.064静脉期 68.98±17.45 80.16±19.60 94.28±21.96 0.134 <0.001 0.030
3 讨论
GIST可以发生在消化道自食管到肛门的任何部,其中又以胃和小肠最为多见[4]。CT增强扫描是术前诊断GIST的首选成像方法,可清晰显示肿瘤的位置、大小、形态、边缘、生长方式、密度以及瘤内和瘤周血管,以及评价邻近脏器有无侵犯及远处是否转移[5]。在增强CT图像上,GIST具有一定的影像学特征,常表现为较大的腹部肿块(>5 cm),呈圆形、类圆形、哑铃形、分叶状或不规则形状,强化方式为不均匀强化,肿瘤易发生坏死。其他影像学表现还包括肿瘤囊变、钙化及溃疡形成[6-8]。
尽管GIST的定性诊断不难,但GIST的生物学行为复杂难测,目前并不采用良恶性来对肿瘤进行分类,因为即便肿瘤很小,高倍镜下的核分裂象计数很低,仍然有发生转移的可能。因此,目前国际上普遍采用危险度分级的方法评估肿瘤的预后。根据NIH的指南[3],对于最大径大于10 cm的肿瘤,无论其原发部位及高倍镜下的核分裂计数大小,都被归为高危险度。原发于胃的GIST与非胃原发的GIST危险度分级的高倍镜下核分裂象计数标准有所不同。研究[9]显示原发于胃的GIST预后相对优于原发于小肠GIST,而在小肠GIST中,原发于空回肠的GIST预后相对较十二指肠GIST差。
一般认为,GIST的异质性越高,其危险度越高[10],肿瘤体积不规则,边界不清晰,以及其他一些提高肿瘤异质性的因素包括肿瘤出血、坏死、病灶内出现空洞、囊变等,都能够提升肿瘤的危险度分级,提示预后不良。增强扫描中强化不均匀的病灶相对均匀强化的病灶危险度更高。而GIST是否为多发、病灶内是否出现钙化则与肿瘤危险度及预后没有明确的联系[11-12]。Zhou等[13]研究发现,肿瘤体积越大、外生型生长方式及肿瘤周边存在粗大动脉或引流静脉,则提示肿瘤的危险度分级较高。Wei等[14]通过测量肿瘤最大径及最小径形成的夹角发现,相对于肿瘤大最大径,肿瘤形态的不规则性是更好的危险度分级的预测指标。
本次对小肠GIST的CT值定量研究发现,随着GIST危险度的升高,肿瘤的容积平均CT值减低,无论是在动脉期还是静脉期,高危组的平均CT值显著低于低危组(P<0.001)。在静脉期,中危组与低危组的平均CT值差异具有统计学意义(P=0.030)。提示动、静脉双期增强,尤其静脉增强图像对鉴别低危与中高危GIST有较高的诊断价值。本研究采用容积测量的方法,减小了CT值测量时ROI选择的主观性,提高了实验的可重复性。由于CT值测量时将整个肿瘤的体素信息纳入计算,肿瘤坏死区也包含在内,而GIST的危险程度越高,越容易出现坏死和囊变,这也解释了在本研究中高危险度GIST的容积CT值相对较低。
综上,多期CT增强扫描有助于在术前对小肠GIST的危险度进行预测,综合分析CT定性特征及定量特征能够提高预测的准确性,对预后评估及临床治疗决策有重要的意义。
