非小细胞肺癌患者肿瘤组织PD-1和PD-L1与临床病理参数和预后的关系
2021-06-10马群马磊
马群 马磊
(新乡医学院附属南阳市第一人民医院,河南 南阳 473010)
肺癌是目前世界上最为常见的肿瘤之一,全球每年因肺癌死亡人数超过100万人[1]。在我国,肺癌发病率和病死率逐年升高,并居于恶性肿瘤首位。放化疗虽能提高患者生存率,但毒副作用严重,轻则损伤患者细胞免疫功能,导致放化疗失败,增加并发症等,严重影响患者生存时间及生活质量[2]。研究显示,患者免疫功能低下或受抑制时,肺癌的发病率明显增高[3];同时体内肿瘤进行性生长进一步导致患者的免疫功能受抑制,两者互为因果。研究证实程序性死亡受体1(Programmed death protein-1,PD-1)及程序性死亡受体配体1(Programmed death ligand-1,PD-L1)可维持和诱导外周组织的免疫耐受,并在病理情况下下调T细胞免疫刺激性细胞因子分泌,促进免疫抑制性细胞因子分泌,从而抑制T细胞的免疫反应[4]。
本文运用免疫组化法检测非小细胞肺癌患者肿瘤组织中程序性死亡受体PD-1及其配体PDL1的阳性表达,分析二者与临床病理参数和预后的关系,为肺癌的免疫治疗提供一定的支撑。
1 资料与方法
1.1 一般资料
选择我院2013年1月至2015年1月住院的非小细胞肺癌手术患者共85例,收集患者癌组织及癌旁组织(距癌灶>3 cm以上)石蜡标本。纳入标准:首次接受手术治疗;未接受化疗和放疗;患者均知情并签署知情同意书,并经院伦理委员会的批准。排除标准:合并其他肿瘤疾病的患者;自身免疫性疾病。其中男56例,女29例;年龄42-84岁,平均62.41±6.87岁;鳞癌45例,腺癌30例;组织学分极,G1期31例,G2期26例,G3期22例;临床分期:I期19例,II期17例,III期26例,IV期23例;发生淋巴结转移35例,未发生淋巴结转移50例。患者接受门诊或电话随访3~60 m。
1.2 PD-1和PD-L1在癌组织和癌旁组织的表达
脱蜡4 μm厚的组织切片,以含0.3%过氧化氢的甲醇溶液封闭15 min,经PBS冲洗后,以10%牛血清处理20 min。然后采用PD-1和PD-L1一抗(1:150)4℃孵育过夜。PBS冲洗后,将标本用过氧化物酶标记的抗兔免疫球蛋白处理30 min,DAB显色,苏木精复染,脱水、透明、镜检。以PBS代替一抗作为阴性对照。
由两位病理科医师结合阳性细胞比例和染色强度做出判断。阳性细胞比例评分:阳性细胞<1%为0分,1%-24%为1分,25%-49%为2分,50-74%为3分,75-100%为4分;染色强度记分:无染色细胞为0分,黄色为1分,棕黄色为2分,棕褐色为3分,两者相乘≥3分为阳性。总积分0-2分:-,3-4分:+,5-8分:++,9-12分:+++。-/+低表达,++/+++高表达。
1.3 统计学分析
采用SPSS21.0软件进行统计分析。计量资料以均数±标准差(±SD)表示,采用t检验,计数资料以百分率表示,采用χ2检验,应用Kaplan-Meier生存曲线和Log-rank检验进行生存分析,P<0.05为差异有统计学意义。
2 结果
2.1 PD-1和PD-L1在肺癌组织中的表达
PD-1主要表达于细胞膜,呈浅黄色到棕褐色,见图1A;85例癌组织中阳性表达69例(81.18%),癌旁组织阳性表达21例(24.71%)。而PD-L1主要表达于细胞质,呈浅黄色到棕褐色,见图1C,85例癌组织中阳性表达70例(82.35%),癌旁组织阳性表达23例(27.06%)。

图1 PD-1和PD-L1在肺癌组织中的表达(×200)
2.2 PD-1和PD-L1与肺癌病理、临床特征的关系
PD-1和PD-L1蛋白表达与肺癌的组织分类、淋巴结转移、组织学分级、临床分期相关(P<0.05),而与患者年龄、性别、肿瘤大小无关(P>0.05),见表1。
2.3 PD-1与PD-L1在肺癌中的相关性分析
在非小细胞肺癌组织中,PD-1与PD-L1蛋白表达成正相关,见表2。

表1 PD-1和PD-L1与肺癌病理、临床特征的关系

表2 PD-1与PD-L1在非小细胞肺癌中的相关性分析(例)
2.4 PD-1和PD-L1与肺癌患者生存的相关分析
在非小细胞肺癌中组织中,PD-1和PD-L1蛋白高表达患者总生存明显低于低表达患者(P<0.05),见图2。

图2 Kaplan-Meier生存曲线
2.5 多因素Cox回归分析
Cox逐步多因素分析显示,淋巴结转移、组织学分级、临床分期、PD-1和PD-L1均是非小细胞肺癌患者预后的独立影响指标。
3 讨论
肿瘤免疫逃逸是肿瘤生存的重要策略。肿瘤免疫逃逸的机制很多,包括免疫抑制,这已成为近年来的研究热点。PD-L1/PD-1信号通路是肿瘤免疫抑制的重要组成部分,可以抑制T淋巴细胞的活化并增强肿瘤细胞的免疫耐受性,从而实现肿瘤免疫逃逸[5]。
PD-1属于CD28家族成员,由268个氨基酸构成,在多种免疫细胞表面均有表达。PD-1结构分为胞外区,跨膜区和胞内区,其胞内区尾部的C端和N端含有两个独立的位点[6]。PD-L1和PDL2是目前已被证实的PD-1的两个配体,研究发现活化后的T细胞能释放细胞因子使PD-L1上调,而上调后的PD-L1会与PD-1结合抑制T细胞导致其凋亡,减轻T细胞对周围组织损伤[7]。另一方面,磷脂酰肌醇3-激酶(Phosphatidylinositol 3-kinase,PI3K)信号传导及转录激活因子(Signal transduction and activators of transcripttion 3,STAT)等信号通路可诱导肿瘤细胞产生PD-L1,与受体结合抑制T细胞活性,使得肿瘤细胞实现免疫逃逸[8]。
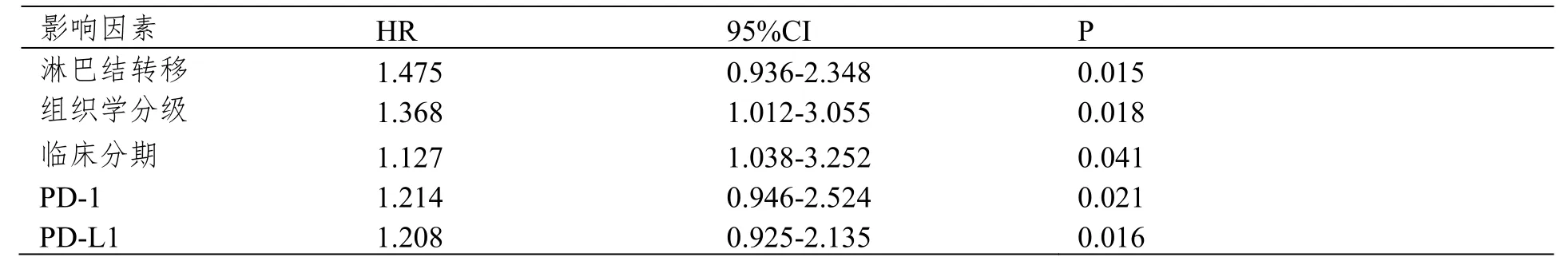
表2 多因素Cox回归分析
本研究发现,PD-1、PD-L1蛋白在非小细胞肺癌中的阳性表达率明显高于癌旁肺组织,且与肺癌的组织分类、淋巴结转移、组织学分级、临床分期相关。其中,淋巴结转移的患者肺癌组织PD-1、PD-L1蛋白水平相对增加,并伴随组织学分级、临床分期增加而增加,提示PD-1、PD-L1与非小细胞肺癌的发生、进展关系密切,是辅助诊断非小细胞肺癌的的有效的肿瘤标记物。随访结果提示,PD-1、PD-L1蛋白高表达患者与低表达患者相比总生存较差,说明PD-1、PD-L1蛋白是较好的诊断非小细胞肺癌患者预后的指标,这与其他组织肿瘤的预后比较类似。PD-L1和PD-1的表达均与非小细胞肺癌患者肿瘤细胞侵袭性肿瘤生物学特征相关,基质PD-1表达与基质PD-L1染色以及肿瘤内和基质CD8表达均显著相关[9],基质PD-1 / PD-L1的表达可能是非小细胞肺癌患者的预后指标。可见,PD-1、PD-L1是潜在的治疗非小细胞肺癌的靶点。
同时本研究发现,非小细胞肺癌组织PD-1蛋白水平与PD-L1蛋白表达水平呈正相关,淋巴结转移、组织学分级、临床分期、PD1和PDL1均是非小细胞肺癌患者预后的独立影响指标,其原因可能是PD-L1基因可通过与肿瘤细胞PD1结合,降低机体对肿瘤细胞的免疫应答,诱导肿瘤细胞转移和侵袭,从而导致肿瘤的发生和进展[10]。
综上所述,PD-1、PD-L1有望成为非小细胞肺癌治疗中一种新的预后工具和生物标记物。
