组蛋白去乙酰化酶抑制剂ACY1215对急性肝衰竭过程中人正常结肠上皮细胞NCM460损伤的保护作用及机制研究
2021-06-10裴茂华焦方舟石春霞龚作炯
裴茂华, 陈 倩, 王 瑶, 焦方舟, 石春霞, 龚作炯
武汉大学人民医院感染科,湖北 武汉 430060
急性肝衰竭在临床上多起病急,且死亡率极高[1]。目前有学者发现,除病毒和药物等因素诱发肝脏直接且迅速的损伤外,肠源性内毒素血症也是导致急性肝衰竭发生发展的重要原因[2]。在急性肝衰竭过程中,机体产生大量的炎性因子,且由于肝脏功能的损伤,对肠道产生的内毒素及炎性因子清除作用减弱,从而导致肠道的损伤。而肠道的损伤会致肠道菌群紊乱及细菌移位等进一步形成肠源性内毒素血症,继续加重肝脏的损伤[3]。内毒素的主要成分是脂多糖(LPS),为革兰氏阴性细菌细胞壁的主要成分。有研究发现,使用药物促进肝衰竭过程中肠道损伤的修复有助于减轻肝脏损伤[4]。
线粒体凋亡通路,即多种因素导致线粒体通透性转换孔开放,引起线粒体膜电位下降,线粒体内相关凋亡因子进入到细胞质内触发级联反应,导致细胞凋亡[5]。Bcl-2蛋白家族是调控线粒体途径的重要蛋白家族,主要位于线粒体的外膜上[6]。Bcl-2蛋白家族分为抗凋亡蛋白家族如Bcl-2和Bcl-xL及促凋亡蛋白家族如Bax和Bak等[7]。我们前期的动物实验结果已发现,线粒体凋亡通路的过度激活致肝细胞大量凋亡可能是导致急性肝衰竭发生发展的重要因素[8]。
目前,组蛋白去乙酰化酶抑制剂已在肿瘤治疗上取得突破性进展[9]。此外,组蛋白去乙酰化酶抑制剂也在非肿瘤疾病的治疗上取得良好的效果[10]。我们前期研究也证实了组蛋白去乙酰化酶抑制剂对急性肝衰竭动物模型中的损伤的肝脏有较好的保护作用[11]。本研究为进一步探讨组蛋白去乙酰化酶抑制剂对急性肝衰竭过程中的肠道保护作用,体外培养人正常结肠上皮细胞NCM460,使用LPS进行造模,模拟急性肝衰竭过程中的肠源性内毒素血症环境。用组蛋白去乙酰化抑制剂ACY1215作为干预剂,荧光显微镜检测细胞线粒体膜电位变化情况,检测调控线粒体凋亡通路中的Bcl-2和Bax蛋白和mRNA表达量,探讨ACY1215是否可通过肠上皮细胞的线粒体凋亡通路实现潜在的保护作用。
1 材料与方法
1.1 主要实验器材、药物与主要试剂荧光显微镜购自日本Olympus公司;多功能酶标仪购自芬兰PerkinElmer公司;RT-PCR购自美国Applied Biosystems公司;ACY1215购自美国Selleck公司;CO2恒温培养箱购自美国SANYO公司;LPS购自美国Sigma-Aldrich公司;抗-Bcl-2抗体、抗-Bax抗体、抗-β-actin抗体购自美国Cell Signaling Technology公司;线粒体膜电位检测试剂盒购自武汉碧云天公司;CCK8试剂盒购自日本Dojindo Laboratories公司;DMEM培养基购自美国Hyclone公司;胎牛血清购自杭州四季青公司;胰酶购自合肥Biosharp公司。
1.2 细胞培养人正常结肠上皮细胞NCM460购自中国典型培养物保藏中心,DMEM完全培养基(含质量浓度为100 g/L的胎牛血清,1%链-青霉素),于37 ℃,体积分数为5%的CO2恒温培养箱中,适当湿度环境中培养。显微镜下观察细胞生长情况,待细胞生长至对数生长期时用于进一步实验。
1.3 细胞造模将NCM460细胞均匀种于细胞6孔板中,待细胞生长致约每孔70%密度时,正常组细胞更换细胞培养液,不加任何其他药物处理。LPS组更换含10 μg/ml LPS细胞培养液。而ACY1215组则在加入10 μg/ml LPS细胞培养液前2 h加入含2 μmol/L ACY1215的细胞培养液进行处理。细胞培养箱内孵育24 h后检测相关线粒体凋亡通路中Bcl-2和Bax的mRNA和蛋白表达量,以及进行每组细胞线粒体膜电位的检测。
1.4 CCK8法检测细胞活性取对数生长期NCM460细胞,调整细胞密度为5×104个/ml,以每孔体积100 μl接种于96孔板中。培养箱培养24 h后,更换培养液,其中一组细胞中加入含2 μmol/L的ACY1215的100 μl DMEM完全培养基(含质量浓度为100 g/L的胎牛血清)为ACY1215组;2 h后,除正常组,ACY1215组及LPS组均加入含10 μg/ml的LPS的100 μl DMEM完全培养基(含质量浓度为100 g/L的胎牛血清),再过24 h后,完全吸去每孔液体,加入100 μl DMEM完全培养基(含质量浓度为100 g/L的胎牛血清),再每孔加入10 μl的CCK8溶液。于细胞培养箱孵育1 h后,用酶标仪测定450 nm处吸光度,再计算每组的细胞活性。
1.5 RT-PCR法检测细胞Bcl-2和Bax相对基因表达量每组细胞的总RNA通过PrimeScript RT试剂盒提取。cDNA通过RT-PCR仪进行定量聚合酶链反应,PCR程序设置为:初始95 ℃ 5 s;95 ℃ 5 s,60 ℃ 34 s,40个循环。Bcl-2引物序列:正义链5′-CTGCACCTGACGCCCTTCACC-3′;反义链5′-CACATGACCCCACCGAACTCAAAGA-3′;Bax引物序列:正义链5′-GGCCCACCAGCTCTGAGCAGA-3′;反义链5′-GCCACGTGGGCGTCCCAAAGT-3′;β-actin引物序列:正义链5′-GAGCTACGAGCTGCCTGACG-3′;反义链5′-CCT-AGAAGCATTTGCGGTGG-3′。Bcl-2和Bax的相对基因表达量通过2-△△CT计算。
1.6 蛋白免疫印迹法检测细胞Bcl-2和Bax蛋白表达量将每组细胞胰酶消化后置于4 ml EP管内,使用超声碎膜仪进行处理后,提取总蛋白,BCA法测定蛋白表达量。加样10 μg/孔,电泳后进行转膜,质量浓度为50 g/L的脱脂奶粉进行封闭1 h;加入一抗4 ℃摇床过夜,TBST进行洗膜,二抗室温下避光孵育1 h,洗膜后使用Odyssey系统扫描分析。检测每组细胞Bcl-2及Bax蛋白表达量。
1.7 JC-1法检测线粒体膜电位吸除6孔板中每孔细胞培养液后,使用PBS缓冲溶液洗涤1次,加入1 ml培养液。每孔继续加入1 ml JC-1染色工作液,充分混匀。细胞培养箱中37 ℃孵育20 min。配置JC-1染色缓冲液(1×),置于冰上。37 ℃孵育结束后,吸除上清,用JC-1染色缓冲液(1×)洗涤2次。荧光显微镜下观察每组细胞红色及绿色荧光表达情况。
1.8 统计学分析采用SPSS 16.0软件分析数据,两组间比较采用t检验,P<0.05为差异有统计学意义。采用Prism软件进行绘图。
2 结果
2.1 细胞活性CCK8法检测结果显示,与正常组细胞相比,LPS组NCM460细胞活性明显降低,差异有统计学意义(P<0.05)。采用ACY1215预处理后,ACY1215组的细胞活性较LPS组明显升高,差异有统计学意义(P<0.05)(见图1)。
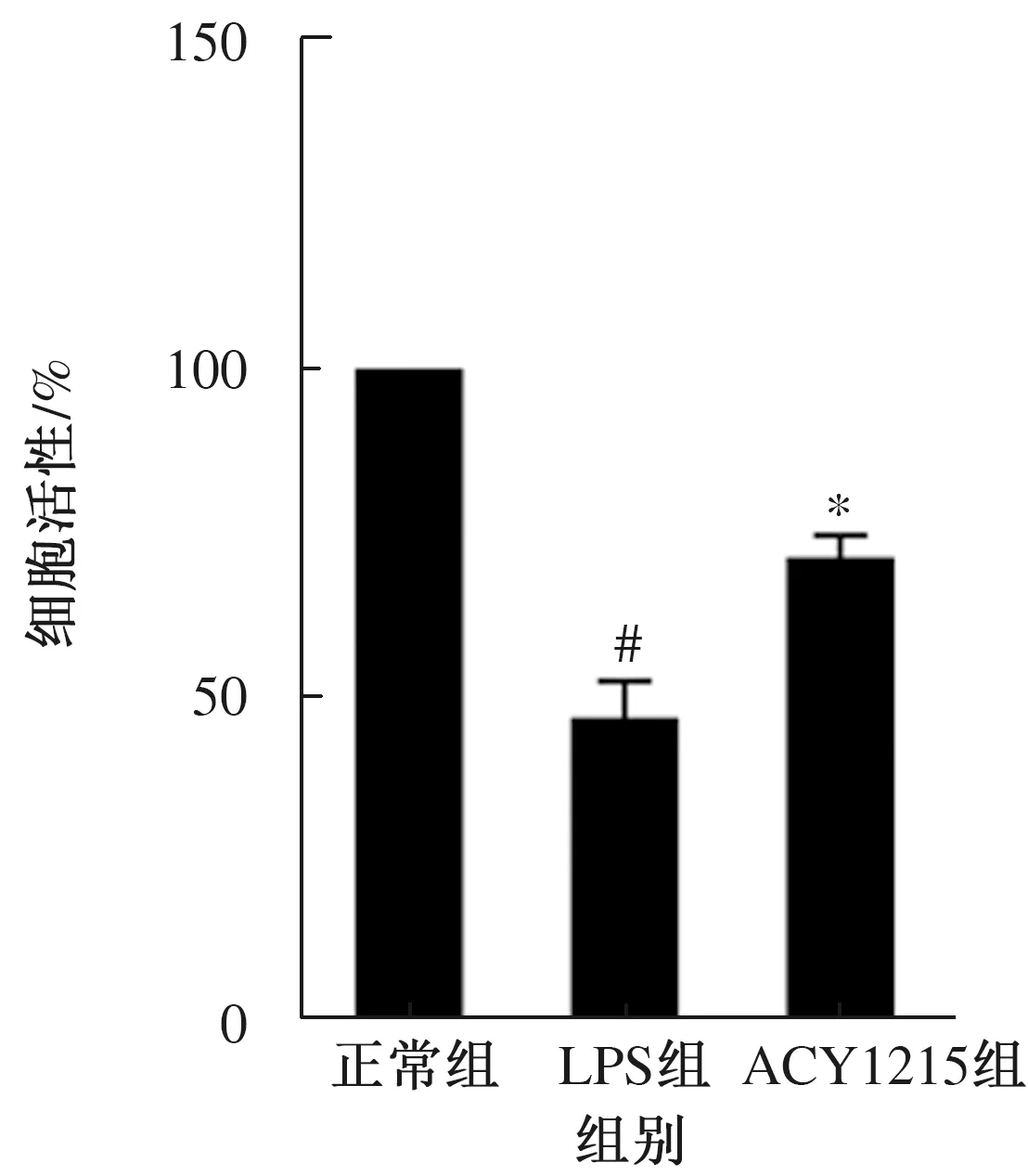
注:与正常组相比,#P<0.05;与LPS组相比,*P<0.05。
2.2 Bcl-2和Bax的mRNA及蛋白表达量LPS组的抗凋亡蛋白Bcl-2 mRNA和蛋白表达量较正常组明显降低,差异有统计学意义(P<0.05);与LPS组相比,ACY1215组Bcl-2的mRNA及蛋白表达量明显升高,差异有统计学意义(P<0.05)。LPS组的促凋亡蛋白Bax mRNA和蛋白水平较正常组明显升高,差异有统计学意义(P<0.05);与LPS组相比,ACY1215组显著抑制Bax的mRNA和蛋白表达,差异有统计学意义(P<0.05)(见图2~3)。
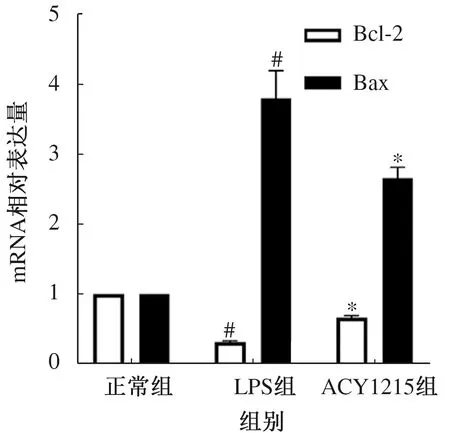
注:与正常组相比,#P<0.05;与LPS组相比,*P<0.05。
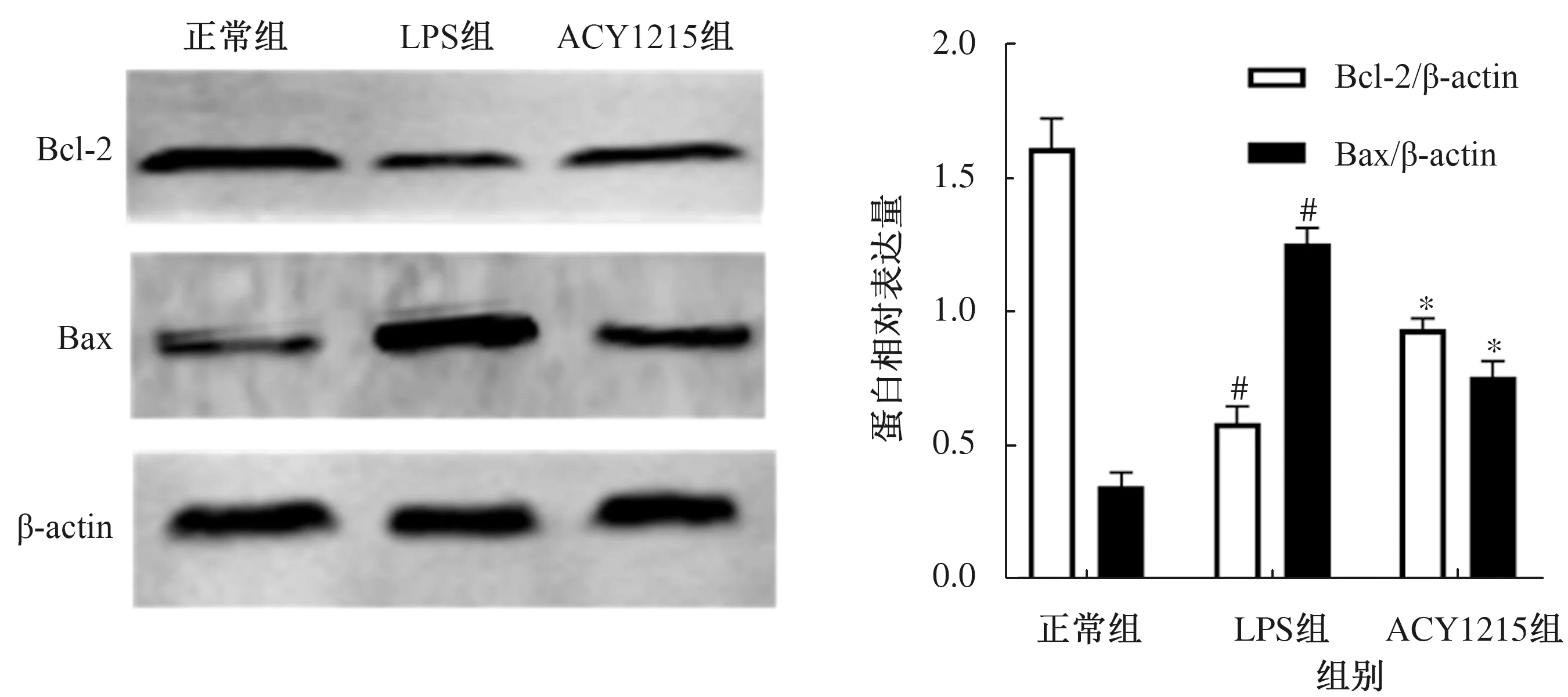
注:与正常组相比,#P<0.05;与LPS组相比,*P<0.05。
2.3 线粒体膜电位JC-1作为一种荧光探针,当线粒体膜电位较高时,聚集在线粒体内形成聚合物,产生红色荧光;线粒体膜电位较低时,JC-1不能聚集在线粒体内,此时为JC-1单体,产生绿色荧光。故可通过红绿荧光颜色检测线粒体膜电位变化情况。荧光显微镜结果显示:正常组NCM460细胞主要呈现红色荧光。而LPS组细胞主要呈现绿色荧光,提示LPS组NCM460细胞线粒体膜电位显著下降。ACY1215组绿色荧光则较LPS组明显减少,红色荧光增加,表明ACY1215预处理后可增加LPS干预后形成的线粒体膜电位下降趋势(见图4)。

图4 各组NMC460细胞线粒体膜电位(200×)Fig 4 Mitochondrial membrane potential of NMC460 cells in each group (200×)
3 讨论
在致肝脏的继发性损伤过程中,肠-肝轴扮演着重要的角色[12]。肠道内聚集着丰富的菌群及内毒素。当肠道受到损伤后,肠道内的菌群发生移位,菌群和内毒素通过门脉系统进入到肝脏。且当受损的肝脏的Kupffer细胞对内毒素的清除作用减弱时,大量的内毒素则会进一步进入到循环系统,导致全身多器官功能衰竭[13]。临床研究表明,在部分急性肝炎、慢性肝炎及重型肝炎、肝硬化等患者体内,有肠源性内毒素血症的发生[14]。此外,患者肝炎程度越重,体内的内毒素含量常越高。
有研究显示,线粒体凋亡通路是多种肝病发生发展的重要原因[15]。Bcl-2蛋白表达增加可降低线粒体膜电位,减少线粒体内凋亡因子的表达,从而抑制线粒体凋亡。而Bax蛋白则可促进线粒体内细胞色素c进入到细胞质内,进一步触发线粒体凋亡过程[16]。
我们前期动物实验发现,多种组蛋白去乙酰化酶抑制剂对急性肝衰竭中损伤的肝脏具有保护作用。组蛋白去乙酰化酶抑制剂曲古抑菌素A可通过调控组蛋白H3和H4的乙酰化水平,抑制炎症反应达到肝脏保护作用[3]。而组蛋白去乙酰化酶抑制剂MS-275可通过调控非组蛋白的乙酰化达到肝脏保护作用[17]。此外,我们前期研究还发现,ACY1215可通过抑制肝细胞的线粒体凋亡途径达到对肝脏的保护作用[18]。而本实验研究采用LPS模拟急性肝衰竭过程中的内毒素环境,干预NCM460细胞,观察ACY1215潜在的肠保护作用。实验结果发现,ACY1215可通过抑制LPS刺激NCM460细胞Bax的mRNA和蛋白表达,促进Bcl-2的mRNA和蛋白及提高线粒体膜电位从而达到保护作用。进一步表明ACY1215在急性肝衰竭过程中还可对损伤的肠道具有保护作用,其潜在的机制可能是通过抑制肠上皮细胞的线粒体凋亡通路来达到保护作用。
