PD-L1表达联合TMB预测免疫检查点抑制剂治疗NSCLC疗效的研究*
2021-06-09赵呈龙王玉波
赵呈龙,李 力,王玉波,韩 睿,何 勇
(陆军军医大学大坪医院呼吸与危重症医学科,重庆 400042)
肺癌位居我国恶性肿瘤发病首位,半数以上肺癌患者确诊时已经为晚期,非小细胞肺癌(NSCLC)约占其85%以上[1]。继化疗及靶向治疗后,以免疫检查点抑制剂(ICIs)为代表的新型肿瘤免疫治疗已成为NSCLC治疗的重要手段之一,但仅有20%的晚期NSCLC患者对免疫治疗有应答[2-3]。因此,发现有效的生物标志物指导应用ICIs显得尤为重要。程序性细胞死亡受体-配体1(PD-L1)是目前唯一被美国食品药品管理局(FDA)批准用于筛选NSCLC免疫治疗优势人群的生物标志物[4-6],肿瘤突变负荷(TMB)同样可成为ICIs的预测性生物标志物[7-8],二者联合应用或将有更强的ICIs疗效预测能力[9-10]。同时,关于ICIs单药和联合化疗方案的选择,已成为临床探索的新热点,能否通过PD-L1和TMB指导ICIs单药或联合治疗方案亦缺少研究报道。本文拟联合基线肺肿瘤组织PD-L1表达和下一代测序(NGS)大panel检测肺肿瘤组织TMB,寻找预测肺癌免疫疗效的获益因素,并指导ICIs单药或联合治疗方案在NSCLC患者中的应用。
1 资料与方法
1.1 一般资料
回顾性收集2017年8月至2020年6月在本院呼吸与危重症科接受免疫治疗的晚期肺癌患者。采集患者年龄、性别、肿瘤病理类型、转移部位、TNM分期、PD-L1表达及TMB水平等临床基本特征,以及免疫治疗的用药方式、疗效和预后。采用查阅病案资料、门诊复诊及电话随诊等方式进行随访。纳入标准:(1)临床信息完整,根据组织病理学符合NSCLC的诊断;(2)按照第八版国际肺癌TNM分期标准,诊断为Ⅲ期或Ⅳ期NSCLC;(3)一线或非一线接受ICIs(纳武单抗或派姆单抗)单药治疗或联合标准化疗;(4)免疫治疗前同时接受组织PD-L1检测及NGS大panel检测TMB水平;(5)美国东部肿瘤协作组(ECOG)体能状况(PS)评分0~2分;(6)除死亡导致随访截止外,随访时间均超过6个月以上。排除标准:(1)小细胞肺癌;(2)接受ICIs治疗少于2周期;(3)合并其他恶性肿瘤。本研究获得陆军军医大学大坪医院伦理委员会批准(2019-56)。最终纳入44例接受ICIs治疗的NSCLC患者,无失访病例,中位随访时间13.40个月,四分位数间距(IQR)为9.30~17.70个月。至随访结束时,23例患者出现疾病进展(PD),其中20例已死亡,余21例仍在接受免疫治疗。44例患者中31例接受派姆单抗,13例接受纳武单抗。44例NSCLC患者的基本临床特征,见表1。

表1 44例NSCLC患者的基本临床特征
1.2 方法
1.2.1PD-L1表达及TMB检测方法
在患者进行免疫治疗前1周,采用支气管镜活检、胸腔镜活检或经皮肺穿刺活检取得足量肿瘤组织,并由10%甲醛溶液保存待检测。(1)肿瘤组织PD-L1表达采用PD-L1免疫组化22C3试剂盒进行检测,肿瘤细胞比例分数(TPS)由两位病理医师进行判读得出,根据TPS将PD-L1表达分为PD-L1≥50%(A组,n=16),PD-L1 1%~<50%(B组,n=14),PD-L1<1%(C组,n=14)3个等级;(2)已有研究证实,基于NGS大panel检测的TMB可替代基于全外显子组测序(WES)检测的TMB[11-12]。本研究中,由思路迪®对肿瘤组织437个基因进行检测,覆盖基因捕获区域大于1百万碱基(Mb)。肿瘤组织TMB根据所测靶向编码区每Mb的体细胞突变数目,包括点突变和插入缺失,去除热点突变,包含同义突变进一步分析所得。思路迪®数据库对TMB做分瘤种排序,并按照四分位来划分cut-off值界定TMB高低,将TMB分为高低两组,位于0~50%为低TMB组(n=16),>50%~100%为高TMB组(n=28)。根据PD-L1表达联合TMB结果将患者分为4组:PD-L1≥50%高TMB组(Ⅰ组,n=11),PD-L1≥50%低TMB组(Ⅱ组,n=5),PD-L1<50%高TMB组(Ⅲ组,n=17),PD-L1<50%低TMB组(Ⅳ组,n=11)。患者年龄、临床分期、病理分型、治疗方式、治疗药物在PD-L1及TMB各组间比较,差异无统计学意义(P>0.05),见表2。

表2 患者基本临床特征在PD-L1及TMB各组间的均衡性分析[n(%)]
1.2.2观察指标
(1)参照实体肿瘤疗效评价标准(RECIST)1.1版评价疗效:完全缓解(CR)、部分缓解(PR)、疾病稳定(SD)、疾病进展(PD)。(2)客观有效率(ORR)=[(CR+PR)/总病例数]×100%,疾病控制率(DCR)=[(CR+PR+SD)/总病例数]×100%。(3)持续临床获益(DCB),为接受免疫治疗后大于或等于6个月未出现PD;非持续临床获益(NDB),为接受免疫治疗后6个月内出现PD[13]。(4)无进展生存期(PFS),为ICIs开始治疗至患者病情进展或任何原因导致死亡的时间;总生存期(OS),为自ICIs开始治疗至任何原因导致患者死亡的时间。
1.3 统计学处理
采用SPSS26.0统计软件及GraphPad Prism7软件进行数据分析并作图,计数资料以率表示,采用χ2检验或Fisher精确检验比较;采用Kaplan-Meier法进行单因素生存分析,log-rank检验比较组间生存差异,Cox回归模型进行多因素生存分析,以P<0.05为差异有统计学意义。
2 结 果
2.1 ICIs疗效的影响因素
Kaplan-Meier单因素分析显示,患者性别、年龄、临床分期、治疗方式、免疫治疗药物与PFS、OS不相关(P>0.05),PD-L1表达与PFS、OS呈正相关(P<0.05),TMB水平与PFS呈正相关(P<0.05),见表3。将PD-L1表达、TMB水平、TNM临床分期、治疗方式(ICIs单药或联合化疗)、免疫治疗药物纳入Cox多因素回归分析,结果显示PD-L1表达和TMB是PFS的独立影响因素,PD-L1≥50%患者的PD风险低于PD-L1<50%(P<0.05),高TMB组患者的PD风险低于低TMB组(P<0.05);PD-L1表达是OS的独立影响因素,PD-L1≥50%患者的死亡风险低于PD-L1<50%患者(P<0.05),见表4。
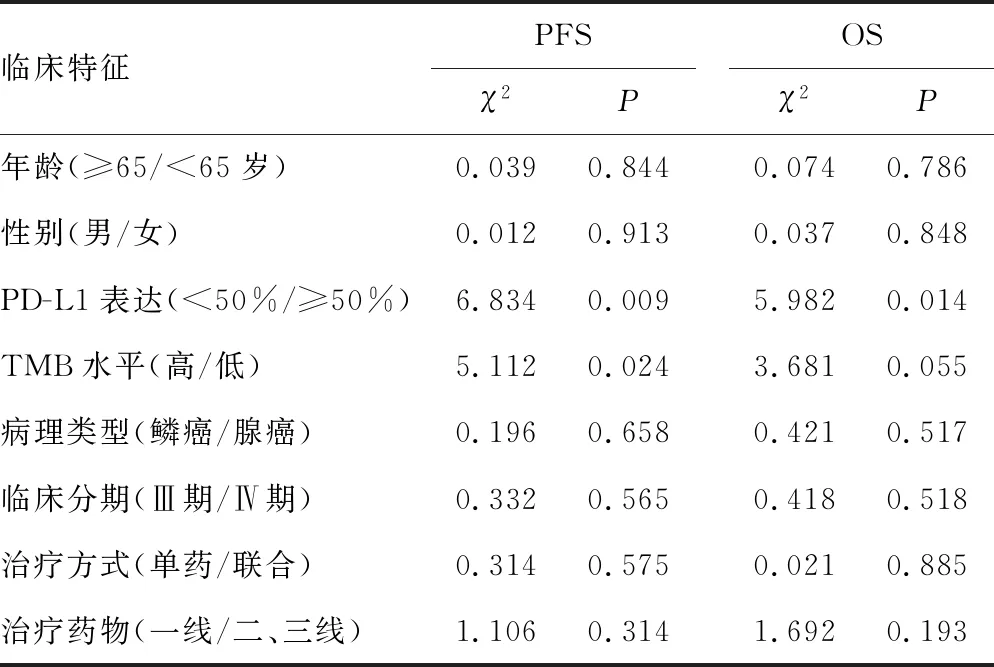
表3 Kaplan-Meier单因素分析ICIs疗效的影响因素

表4 Cox多因素回归分析ICIs疗效的影响因素
2.2 PD-L1表达与ICIs疗效的关系
A组患者ORR,DCR最高(81.3%,93.8%)。随着PD-L1表达的降低,3组患者的DCB占比逐渐减少,A组DCB率明显高于C组(87.5%vs. 42.9%,P<0.05)。生存分析结果显示,3组不同PD-L1表达患者的PFS及OS生存曲线不同,差异有统计学意义(PFS,χ2=9.511,P<0.05;OS,χ2=9.462,P<0.05),A组患者的PFS及OS生存曲线优于B、C组,见图1。

图1 PD-L1表达与ICIs疗效的关系
2.3 TMB与ICIs疗效的关系
高TMB组的ORR高于低TMB组(75.0%vs. 31.3%,P<0.05),高TMB组的DCB率高于低TMB组,但差异无统计学意义(75.0%vs. 56.3%,P>0.05)。生存分析结果显示,高TMB组的PFS生存曲线明显优于低TMB组(χ2=5.122,P<0.05);高TMB组的OS生存曲线优于低TMB组,但未见明显差异(χ2=3.798,P=0.051),见图2。

图2 TMB水平与ICIs疗效的关系
2.4 PD-L1表达联合TMB与ICIs疗效的关系
Ⅰ组的ORR、DCR及DCB率最高,分别为81.8%、100%、90.9%;Ⅱ组和Ⅲ组的ORR、DCR及DCB率略有下降;Ⅳ组的DCR及DCB率最低,分别为72.7%和45.5%,同时该组的ORR最低(9.1%),明显低于其他组(P<0.05)。生存分析结果显示,4组患者的PFS及OS生存曲线差异明显(PFS,χ2=12.350,P<0.05;OS,χ2=9.274,P<0.05),Ⅰ组的PFS及OS生存曲线最优,Ⅳ组的PFS及OS生存曲线最差,见图3。根据PD-L1联合TMB的分组,对ICIs单药组(单药组)与ICIs联合化疗组(联合组)做进一步分析。年龄、临床分期、病理分型、治疗药物在单药组与联合组比较,差异均无统计学意义(P>0.05),见表5。在全组人群中,单药组的ORR、DCR及DCB率与联合组相近(50.0%vs.64.3%,75.0%vs. 89.3%,56.3%vs. 75.0%,P>0.05),两组患者的PFS及OS生存曲线比较差异均无统计学意义(P>0.05),见图4。在Ⅳ组患者中,单药组的最佳疗效未见PR,其ORR及DCR均低于联合组(0vs. 16.7%;40%vs. 100%);单药组的DCB率明显低于联合组(0%vs. 83.3%,P<0.05);联合组的PFS及OS生存曲线明显优于单药组(PFS,χ2=9.744,P<0.05;OS,χ2=5.276,P<0.05),见图5。在Ⅰ组患者中,ICIs单药和ICIs联合化疗的ORR、DCR、DCB率、PFS及OS生存曲线比较差异均无统计学意义(P>0.05),见图6。

图3 PD-L1表达联合TMB水平与ICIs疗效的关系

表5 ICIs单药组与ICIs联合化疗组的均衡性分析
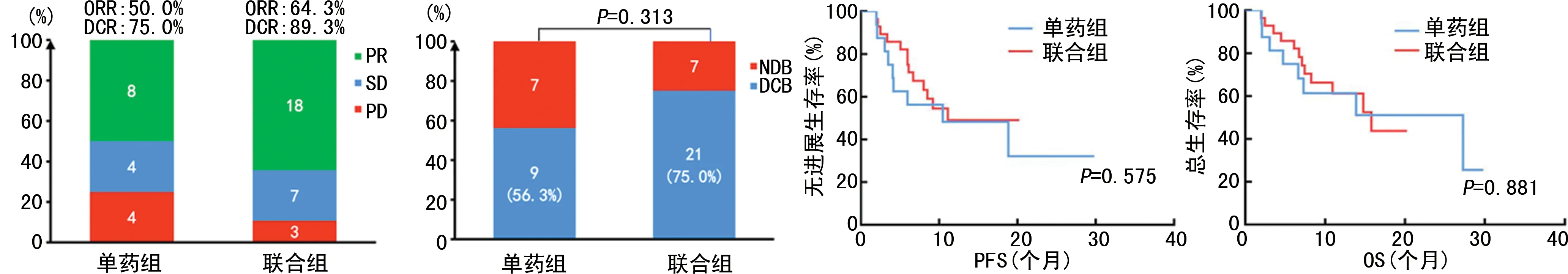
图4 不同用药方式与全组患者ICIs疗效的关系

图5 用药方式与Ⅳ组患者ICIs疗效及预后的关系
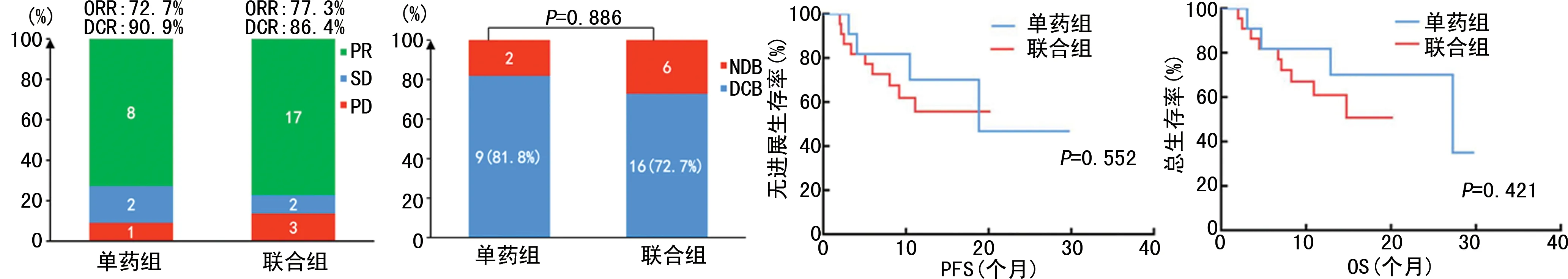
图6 用药方式与Ⅰ组患者ICIs疗效与患者预后的关系
3 讨 论
肿瘤免疫治疗发展的突飞猛进,开启了NSCLC治疗模式的新篇章。但是只有一小部分NSCLC患者能从免疫治疗中获益[2]。因此在精准医疗的时代,筛选出适宜人群是NSCLC免疫治疗的关键。
PD-L1是目前公认的用来预测肿瘤免疫治疗效果的生物标志物。KEYNOTE-024等诸多研究均证实PD-L1表达对免疫治疗疗效的预测效能,进而PD-L1免疫组化检测被FDA批准作为PD-1/PD-L1抑制剂的伴随诊断,并写入了美国国立综合癌症网络(NCCN)指南[4-5]。KEYNOTE-189、CheckMate-057、ATLANTIC、JAVELIN Lung 200等研究的结果均表明,随着PD-L1表达的不断增高,NSCLC患者更能从ICIs治疗中获益[14-17]。多项研究发现,TMB可作为预测NSCLC患者ICIs疗效的生物标志物[13,18-19]。一项前瞻性临床研究(CheckMate-227)结果显示,在接受ICIs联合治疗的患者中,高TMB组的PFS明显优于低TMB组,预示TMB可预测ICIs疗效[8]。CheckMate 568研究也证实了TMB对ICIs疗效的预测价值[20]。纪念斯隆-凯特林癌症中心报道了迄今为止最大的关于TMB预测免疫疗效的研究,首次在多癌种中证实高TMB人群接受ICIs具有更高的总存活率,进一步证实TMB是预测NSCLC免疫治疗效果的生物标志物[21]。本研究结果也验证了PD-L1表达和TMB可作为ICIs疗效的独立预测因素。
上述研究表明,PD-L1高表达或高TMB患者更能从免疫治疗中获益,但由于二者均有一定的局限性,单独依赖其中一种生物标志物不能完全有效地筛选出免疫治疗优势人群。因此,一些学者探索是否能协同PD-L1和TMB以提高ICIs疗效预测的效能。有研究结果提示,PD-L1表达联合TMB无法提高对ICIs疗效预测效能[8,20]。也有研究结果预示,二者联合应用具有更强的ICIs疗效预测能力,PD-L1和TMB是ICIs独立的预后生物标志物,PD-L1表达及TMB均高的患者临床疗效较好,而二者均低的患者临床疗效较差[22-23]。本研究结果显示,ICIs对PD-L1≥50%且高TMB患者的疗效较好,而对PD-L1<50%且低TMB患者的疗效较差,提示PD-L1联合TMB可更好有效预测ICIs疗效。
从现有的循证医学证据来看,采用ICIs单药还是ICIs联合化疗,尚缺乏头对头比较的临床研究证据。一项meta研究间接比较PD-L1≥50%患者ICIs单药或联合化疗的疗效后发现,ICIs联合化疗更能为该人群带来PFS的获益,但OS未能获益[24]。将近期更新的KEYNOTE-024和KEYNOTE-189研究结果间接比较发现,在PD-L1≥50%的人群中,ICIs联合化疗与ICIs单药中位PFS和2年OS率比较无明显差异,并未明显提升临床获益[25-26]。KEYNOTE-189和KEYNOTE-407研究结果显示,PD-L1<50%的NSCLC患者应用ICIs联合化疗明显优于化疗,无疑增加了一线应用ICIs的适用人群[14,27]。本研究对PD-L1联合TMB的4个亚组进一步分析,结果提示PD-L1表达联合TMB可指导ICIs用药方案,当PD-L1<50%同时TMB低时,ICIs联合化疗方案或将更优;PD-L1≥50%或者TMB高时,免疫联合化疗与ICIs单药效果接近。
本研究为回顾性研究,提供了实际临床应用ICIs的真实数据和经验。根据结果,提示PD-L1表达联合TMB可更好预测ICIs疗效,且可指导用药方案。PD-L1表达及TMB均低的患者,可考虑使用ICIs联合治疗;PD-L1高表达或高TMB的患者,ICIs联合化疗与ICIs单药疗效接近,考虑到化疗毒副作用较大,可考虑ICIs单药治疗。但本研究存在一定的偏倚和局限性:本研究回顾性单中心研究、样本量较小、部分患者未达研究观察终点等。因此,还需加大样本量,继续随访ICIs治疗患者,并进行更大规模多中心前瞻性研究,追踪病情转归,以进一步明确研究结论并验证其临床价值。
