基于网络药理学探讨金叶拜毒颗粒抗新冠病毒的作用机制
2021-06-08彭双凤田鑫王兴
彭双凤 田鑫 王兴

【摘 要】 目的:运用网络药理学分析金叶拜毒颗粒抗新型冠状病毒的有效成分、靶点和通路,探讨其抗新型冠状病毒的机制,为中医药治疗新型冠状病毒肺炎(COVID-2019)提供参考。方法:通过TCMSP、PubMed、Swiss Target Prediction等数据库及相关文献中筛选金叶拜毒颗粒方中中药的化学成分和作用靶点;通过Genecards、OMIMS数据库筛选出新型冠状病毒的疾病靶点;使用 Cytoscape3.7.2软件构建“药物-成分-靶点-疾病”网络和潜在靶点的相互作用关系,使用String数据库和Cytoscape3.7.2软件绘制蛋白相互作用网络;通过Matescape富集分析预测核心模块和作用机制。结果:挖掘出金叶拜毒颗粒中化合物46个,465个药物靶点,COVID-19相关疾病靶点465个,二者交集靶点71个,组方中主要化学成分23个,关键靶点涉及GAPDH、ALB、TNF、TP53、MAPK3、IL6、MAPK1、CASP3、MAPK8、FOS等,预测到4个核心板块。GO富集分析共得到1665个条目,KEGG通路富集筛选出条149信号通路。结论:金叶拜毒颗粒具有多成分、多靶点、多通路作用于新型冠状病毒。
【关键词】 金叶拜毒颗粒;网络药理学;新型冠状病毒肺炎;免疫和炎症反应
Abstract:Objective To analyze the effective components and target pathway of Jinye Baidu granule against novel coronavirus by means of network pharmacology, and to explore its mechanism of anti-novel coronavirus, so as to provide reference for the treatment of COVID-19 (COVID-2019) with traditional Chinese medicine.Methods The chemical constituents and action targets of Jinyebaidu granule were screened by TCMSP, PubMed, Swiss Target Prediction and related literatures, and the disease targets of novel coronavirus were screened by Genecards and OMIMS databases. The interaction relationship between drug-component-target-disease network and potential targets was constructed by Cytoscape3.7.2 software, the protein interaction network was drawn by String database and Cytoscape3.7.2 software, and the core modules and action mechanism were predicted by Matescape enrichment analysis.Results 46 compounds, 465 drug targets, 465 disease targets related to covid-19, 71 intersection targets and 23 main chemical components were found in Jinyebaidu granules. The key targets involved GAPDH, ALB, TNF, TP53, mapk3, IL6, mapk1, CASP3, mapk8, Fos and so on.A total of 1665 entries were obtained by go enrichment analysis, and 149 signal pathways were screened by KEGG pathway enrichment. Conclusion The novel coronavirus has many components, multiple targets and multipathways.
Keywords:Jinye Baidu Granule; Network Pharmacology; COVID-19; Immune and Inflammatory Reaction
2019年12月份以來,新型冠状病毒迅速蔓延,轻度患者出现发热、乏力、干咳等症状,严重者可出现呼吸困难、急性呼吸窘迫综合征、脓毒症休克、难以纠正的代谢性酸中毒和凝血功能障碍等[1]。
在本次抗新型冠状病毒肺炎的过程中,同济医院医护人员相继选用金叶拜毒颗粒作为新型冠状病毒肺炎的预防方,并取得较佳的防治疗效。因此金叶拜毒颗粒被作为一般患者隔离期的推荐用药,被载入《同济医院关于新型冠状病毒感染的肺炎中医诊疗方案及预防方案》,并得到了湖北省卫健委的肯定,金叶败毒颗粒也被列入新冠肺炎的防控药品之一[2]。
故本文运用网络药理学,分析金叶拜毒颗粒中药物化学成分的作用靶点及相关通路,预测金叶拜毒颗粒治疗新型冠状病毒肺炎的潜在机制,为中医药治疗新型冠状病毒肺炎提供一定的理论基础与科学依据。
1 材料与方法及结果
1.1 筛选金叶拜毒颗粒潜在活性化合物 在TCMSP(http://tcmspw.com/tcmsp.php)数据库中设定口服生物利用度(oralbioavailability,OB)≥30%,类药性(drug-likeness,DL)≥0.18,以金叶拜毒颗粒组成药物:金银花、大青叶、鱼腥草为关键词进行筛选,筛选后得到每味药材的有效成分。检索已报道的相关文献[3-6],收集蒲公英的有效成分和化合物。得到金叶拜毒颗粒主要活性化合物共23个,其中金银花14个,大青叶6个,鱼腥草2个,根据文献报道蒲公英收集其主要化合物6个。
1.2 筛选金叶拜毒颗粒作用靶点 基于TCMSP数据库,根据上述筛选出的金银花、大青叶、鱼腥草3味有效成分预测作用靶点。根据相关文献得到蒲公英的主要化合物,在PubMed(https://www.ncbi.nlm.nih.gov/pubmed/)搜索其化合物名称得到CAS号,下载其分子结构图,前往Swiss Target Prediction数据库(http://www.swisstargetp rediction.ch/)进行蒲公英靶点预测。得到作用靶点:金银花449个,大青叶83个,鱼腥草195个,蒲公英600个,去重后,共得到药物靶点465个。
1.3 获取疾病靶点 基于GeneCard(https://www.genecards.org)、OMIM(https://omim.org)和“Corona Virus Disease 2019、CoronaVirus”为关键词,选择物种为Homosapiens,检索得到COVID-19相关靶点465个。
1.4 潜在作用靶点的获取 利用Uniprot(https://www.uniprot.org/)数据库查询金叶拜毒颗粒可能的作用靶点蛋白对应的基因名,规范靶点蛋白。在Venny2.1在线软件作图工具平台(https://bioinfogp.cnb.csic.es/tools/venny/)分别录入金叶拜毒颗粒和新型冠状病毒肺炎靶点基因,绘制韦恩图(图1),两者取交集后获得共同靶点71个。
1.5 金叶拜毒颗粒化学成分-靶点网络的建立 将药物的化学成分,以及“1.4”所得的潜在作用靶点分别导入Cytoscape3.7.2软件,使用Network Analyzer 功能对药物中的主要化学成分进行分析,构建“药物-成分-靶点-疾病”相互作用网络(图2),其中金叶拜毒颗粒中有23个有效成分对新型冠状肺炎具有调节作用。根据节点度值(Degree)等网络拓扑学特征进行核心节点的筛选,Degree表示预测出该成分与作用靶点的关联个数,成分的Degree值越大说明该成分越重要,在与潜在靶点相互作用的化学成分中,Degree>8(2倍中位数)的化学成分有9种,Degree值从大到小分别为:槲皮素(quercetin,Degree=102)、山奈酚(kaempferol,Degree=39)、木犀草素(luteolin,Degree=33)、β-谷甾醇(beta-sitosterol,Degree=18)、蒲公英黄铜(3′-hydroxy flavanone,Degree=17)、蒲公英赛酮(Taraxerone,Degree=12)、靛玉红(indirubin,Degree=11)、绿原酸(Heriguard,Degree=11)、乙酰蒲公英萜醇(Taraxerol Acetate,Degree=11)。表明这9种化学成分可能是金叶拜毒颗粒干预COVID-19的主要中药成分。因潜在作用靶点与各成分关联较紧密,故以Degree值的2倍中位数(8)作为主要潜在靶点筛选的阈值,经筛选得到主要潜在靶点有9个,分别为:PTGS2、PTGS1、PPARG、PIK3CG、ACHE、NOS3、NOS2、CASP3、BCL2。上述一种成分与多个靶点作用,多种成分又可共同作用于同一个靶点,体现了金叶拜毒颗粒多成分、多靶点的综合干预特点。
1.6 构建金叶拜毒颗粒PPI网络图 在STRING(https://string-db.org/cgi/input.pl)数据库中录入71个潜在靶点,得到PPI网络关系信息,使用Cytoscape3.7.2软件对上述数据进行可视化分析,構建PPI网络图(图3)。根据节点度值(Degree)等网络拓扑学特征进行核心节点的筛选,Degree>27(中位数)的有GAPDH、ALB、TNF、TP53、MAPK3、IL6等31个靶点,与“药物-成分-靶点-疾病”网络图中的靶点相互映射,得到PTGS2、PPARG、NOS3、NOS2、CASP3等5个核心潜在靶点,推测金叶拜毒颗粒的有效成分可能通过作用于上述5个核心靶点进而干预COVID-19。
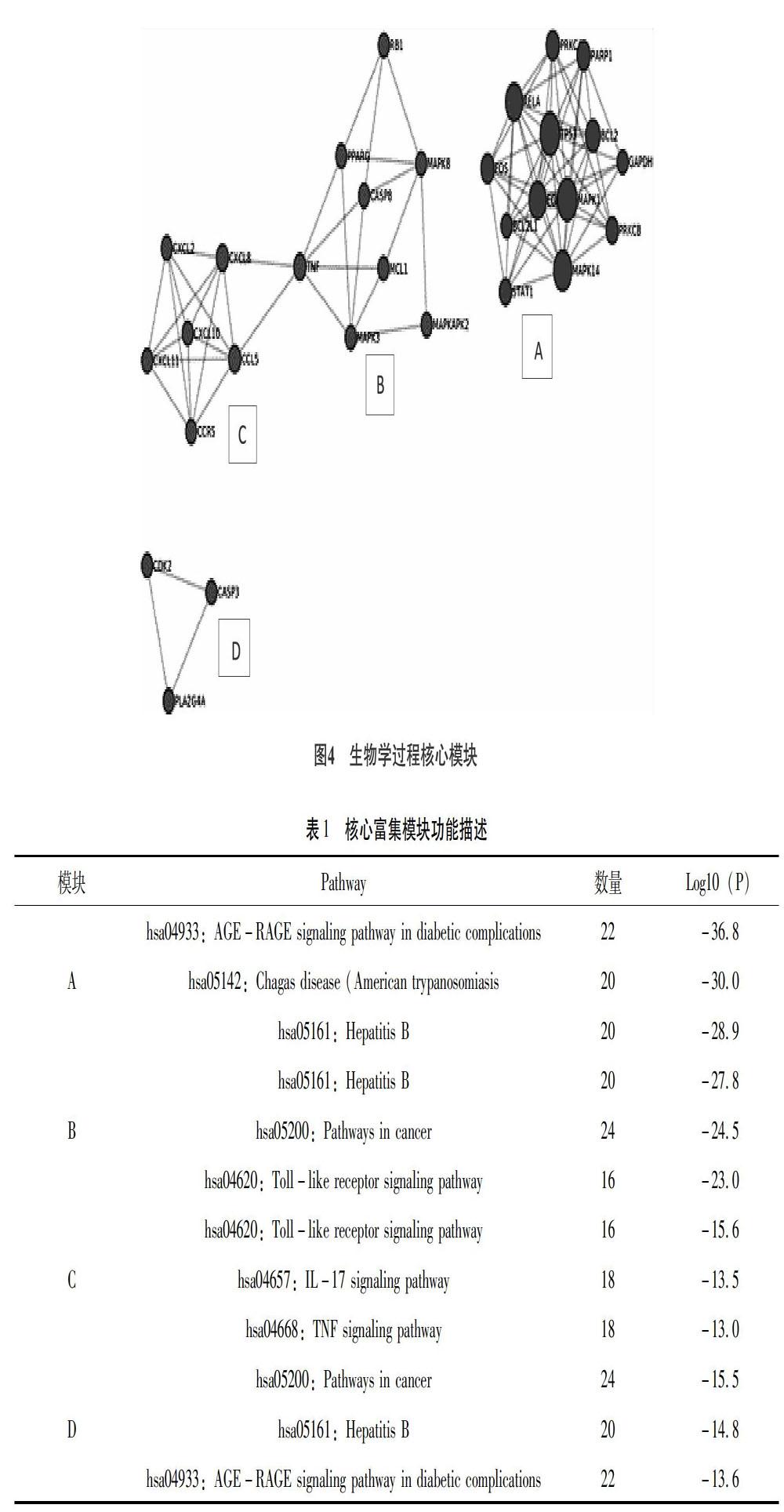
为了进一步探讨这些潜在靶点之间相互作用的生物过程,运用Metascape(https://metascape.org/)以MCODE算法识别靶点之间最密切的生物过程,收集P <0.01,最小计数为3和富集因子> 1.5的术语,并根据其成分靶点之间相互关系的密切程度得到前4个具有丰富生物过程的核心富集模块(图4A-4D),进行富集分析后按P值划分,选取4个最佳功能描述(表1),图4A核心富集模块主要涉及糖尿病并发症中的AGE-RAGE signaling pathway in diabetic complications、American trypanosomiasis,Hepatitis B,图4B核心富集模块主要涉及HepatitisB、Pathways in cancer, Toll-like receptor signaling pathway,图4C核心富集模块主要涉及Toll-like receptor signaling pathway,IL-17 signaling pathway、TNF signaling pathway,图4D核心富集模块主要涉及Pathways in cancer、Hepatitis B、AGE-RAGE signaling pathway in diabetic complications。
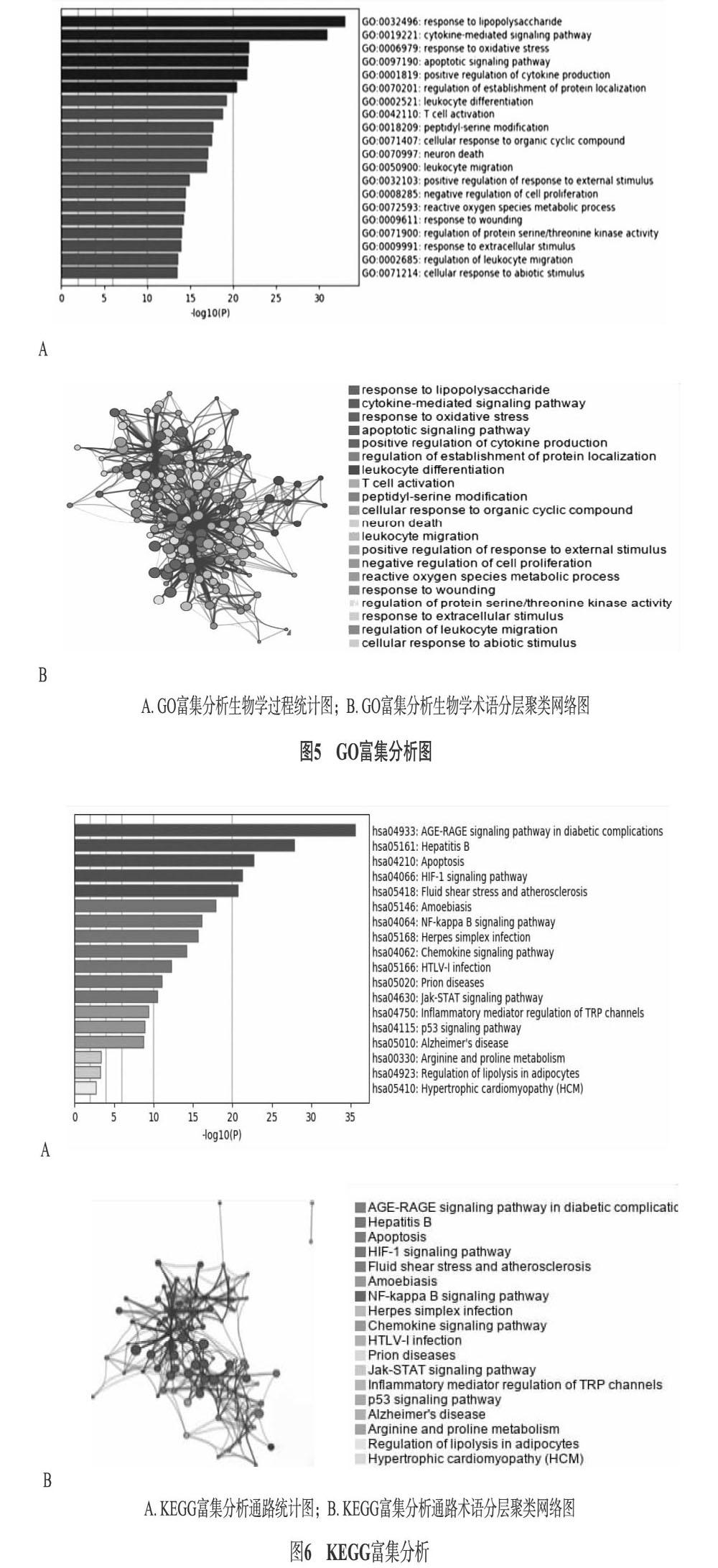
1.7 GO和KEGG富集分析 为探讨上述71个交集靶点在防疫COVID-19时的作用机制,运用Metascape3.7.2对71个的靶点进行GO和KEGG富集分析,并按相似度(Kappa)分数> 0.3对生物学过程进行分层聚类,每个节点代表一个聚类,选择集群中关系最密切的前20个生物学术语作为代表集群的术语,各集群按互相关系构建网络图,节点大小与属于集群的输入基因数量成正比,连线越粗,代表关系越密切。
GO分析得到1665条生物学过程(图5A-5B),KEGG分析得到149条通路途径(图6A-6B),均取结果前20条通路作为重点通路进行展示。按P值大小选择前20种生物学过程进行描述,主要涉及的GO生物过程有:response to lipopolysaccharide、cytokine-mediated signaling pathway、response to oxidative stress、apoptotic signaling pathway、positive regulation of cytokine production等。主要涉及的KEGG生物过程有AGE-RAGE signaling pathway in diabetic complications、Hepatitis B、Apoptosis、HIF-1 signaling pathway、Fluid shear stress and atherosclerosis等。
2 讨论
在2003年“非典”期间,同济医院推荐使用金叶拜毒颗粒作为抗SARS病毒的预防和治疗,并取得了显著的效果,得到广大医务人员和患者的信赖。在本次抗疫情中,武汉同济医院再次推荐使用金叶拜毒颗粒作为新型冠状病毒肺炎的防治方。金叶拜毒颗粒前身为同济医院研发的“抗炎6号”注射剂,源自《医宗金鉴》古方“五味消毒饮”,主要方药由金银花、大青叶、鱼腥草、蒲公英4味药组成,临床上主要治疗风温肺热在卫证。其中金银花性寒味甘,具有清热解毒、疏散风热的功效,既能疏风温在表之邪热,又能解热入气分、血分之热毒,是常用的清热解毒中药之一,是为君药;大青叶、鱼腥草、蒲公英三者共为臣药,三者共效增强清热解毒之功。其中金银花与大青叶合用,前者偏于疏散风热,后者擅长凉血消斑;金银花与鱼腥草相须使用,前者擅于清热解毒,后者偏于消痈排脓;金银花与蒲公英配伍使用,前者适偏于轻宣疏散,后者偏于消肿散结。全方配伍,共奏清热解毒、疏散外邪之功。
2.1 多成分-多靶点-多通路调控 “免疫-炎症反应”干预COVID-19当病毒侵入机体,机体在受到病毒感染后会激发自身保护性免疫应答,从而吞噬和隔离病毒,但是失调的、过度的免疫反应会引起免疫激化,从而引起患者体内炎症因子过度表达而出现“细胞因子风暴”[7-9]。细胞因子风暴可对机体造成严重的损害,如透明膜形成、弥漫性肺泡损伤、纤维蛋白渗出等,进而加速肺损伤,而严重的肺损伤以及循环系统中的细胞因子风暴会进一步引起全身多器官功能障碍及损伤[10]。目前认为,重症肺炎产生的原因往往并非是病毒本身,而是感染诱发了机体产生过度的免疫应答,体内失衡的细胞因子系统是造成肺炎及急性肺损伤的一个重要的原因[11]。因此,除了抗病毒治疗外,对 COVID-19免疫炎症治疗策略就显得尤为重要[12]。
本研究共筛选得到金叶拜毒颗粒防治疾病的9个核心潜在化学成分,分别为槲皮素、山奈酚、木犀草素、β-谷甾醇、蒲公英黄铜、蒲公英赛酮、靛玉红、绿原酸、乙酰蒲公英萜醇。
吴莎等[13]發现槲皮素及穿心莲内酯均能对已进入细胞内的甲型流感病毒H1N1,登革病毒 2 型,柯萨奇 B 病毒以及呼吸道合胞病毒起一定的抑制作用。此外槲皮素可以使用基于伪病毒的药物筛选系统抑制H5N1病毒的进入[14]。Zhang R等[15]发现,山奈酚通过抑制TLR4/MyD88介导NF-kB和MAPKs途径对H9N2病毒诱导的炎症表现出保护作用,并且山奈酚被认为是潜在治疗流感病毒诱导的急性肺损伤的有效药物。Wu S等[16]研究发现木犀草素可以剂量依赖性减少病毒后代的产生以及CVB3 RNA和蛋白质的合成,发现木犀草素介导的CNB3抑制在机械上是可能的,至少部分是通过抑制p38 MAPK和JNK MAPK的磷酸化,并抑制NF-kB核易位并随后减弱CVB3(科萨奇病毒B3)感染细胞中的炎性细胞的表达。Li H等[17]发现β-谷甾醇可有效防止由肺炎链球素引起的细胞裂解,使小鼠免受肺炎链球菌感染。侯京玲等[18]发现蒲公英黄酮对小鼠耳廓、足趾肿胀及大鼠棉球肉芽肿有明显抑制作用,结果表明蒲公英黄铜对急慢性炎症具有良好的抑制作用,高剂量的蒲公英黄酮抗炎效果最佳。现代研究显示蒲公英赛酮可抑制 LPS (脂多糖)诱导的多种炎症介质的释放[19]。赖金轮等[20]研究显示靛玉红对许多炎症性疾病都有抑制作用,推测其机理与抑制炎性细胞因子的表达及相关介质的释放、乃至对上皮细胞的修复的出色表现,预期靛玉红在炎性疾病的防治上或将扮演越来越重要的角色。抗晶晶等[21]发现绿原酸在小鼠体内体外均能有效降低脂多糖诱导的COX-2的蛋白表达,并能促进 COX-2蛋白的降解.降低脂多糖诱导的COX-2的蛋白水平是绿原酸抗炎的机制之一。Yao等[22]研究表明乙酰蒲公英萜醇通过干扰TAK1和AKt的激活来下调巨噬细胞中促炎性介质的表达,从而阻止NF-kB的激活。
中化学成分靶点与COVID-19有71个共同靶点,通过PPI网络分析与“药物-成分-靶点-疾病网络”相映射发现本方中化学成分主要可能通过调控PTGS2、PPARG、NOS3、NOS2、CASP3这5个核心靶点干预COVID-19。
前列素内环氧化物合成酶(prostaglandin endoperoxidesynthase,PTGS),又称环氧合酶 (cyclooxygenase,COX),是催化花生四烯酸产生前列腺素的关键限速酶[23]。在人体内,PTGS 主要存在两种亚型:结构型 PTGS1 和诱导型 PTGS2。前者表达于所有组织细胞,参与机体正常的生理功能;后者是一种诱导性即刻反应基因,在正常状态下低表达或不表达,但可在炎症介质、细胞因子、促 癌 剂、激素等多种体内外因素诱导下表达[24-25]。研究发现细胞色素P450(CYPs)/环氧合酶2(COX-2)途径中花生四烯酸代谢失调是导致脂多糖(LPS)异常的主要原因[26]。急性肺损伤(ALI)中炎症反应不受控制,COX-2和可溶性环氧化合物水解酶(sEH)双重抑制PTUPB通过抑制NLRP3炎性体的激活,在治疗急性肺损伤中发挥抗炎作用。PPARG属于核受体过氧化物酶体增生激活受体(PPAR)亚家族的成员,该基因编码的蛋白质是PPAR-γ, PPAR-γ参与了免疫、炎症等细胞过程[27],包括脂肪细胞的分化、炎症反应、凋亡、肥胖、动脉粥样硬化及癌症等。NOS2(诱导型一氧化氮合酶、eNOS)和NOS3(内皮型一氧化氮合酶、iNOS)是一组同工酶,反应产生的一氧化氮 (NO) 是生物体细胞内及细胞间的重要信号分子, 能调节细胞多种功能,参与炎症反应、心血管、外周、中枢神经以及免疫等系统生理过程和生物信号的调节[28]。半胱氨酸蛋白酶2(CASP3)是属于半胱氨酸蛋白酶家族中的重要成员,是细胞凋亡有序级联反应下游重要的效应因子[29]。当细胞受到损伤时,其主要表现为线粒体膜损伤,线粒体内的细胞色素释放到细胞外,激活CASP3从而诱导细胞凋亡[30]。
在对金叶拜毒颗粒作用靶点参与的生物学过程进行GO、KEGG富集分析以及核心模块分析发现,富集的疾病主要为类似SARS-CoV-2感染的感染性疾病,主要包括病毒、细菌、寄生虫的感染,例如Hepatitis B 、Chagas disease、Amoebiasis、Herpes simplex infection、HTLV-I infection、Prion diseases。对应的通路主要富集在免疫和炎症相关通路中,例如HIF-1 signaling pathway、NF-kappa B signaling pathway、Chemokine signaling pathway、Jak-STAT signaling pathway、Inflammatory mediator regulation of TRP channels、p53 signaling pathway。
2.2 金叶拜毒颗粒可能通过“HIF-1信号通路”干预COVID-19 HIF-1信号通路是调解机体缺氧的重要通路,金叶拜毒颗粒中涉及的靶点有BCL2、EGFR、GAPDH、HMOX1、IFNG、IL6、NOS2等,当机体发生缺氧相关反应时,机体会形成以HIF-1为核心,联合其上下游基因及产物组成复杂的缺氧调控网络。通过参与某些通路信号、调控相应靶基因的表达、调节细胞凋亡、细胞周期等途径,使缺氧的细胞和组织能保持氧稳定及耐受低氧状态[31]。COVID-19组织学检查显示双侧弥漫性肺泡损伤伴细胞纤维黏液样渗出物,肺细胞脱落、肺水肿及透明膜形成,两肺可见以淋巴细胞为主的间质单核炎性浸润[32]。不典型肺细胞增大的多核合胞体细胞肺泡腔内可见大核、双亲颗粒状细胞质和明显核仁,呈病毒性细胞病变样改变。临床则表现为进行性的呼吸困难,呼吸窘迫综合征,最终死于呼吸衰竭[33]。因此,金叶拜毒颗粒可能通过调控HIF-1信号通路,有助于改善COVID-19患者临床缺氧症状。
2.3 金叶拜毒颗粒可能通过“IL-17 信号通路”干预COVID-19 在KEGG富集分析中发现,金叶拜毒颗粒除了参与图6中的生物学过程,还参与了IL-17信号通路,Log10(P)= -27.80,Log10(q)=-25.71,参与的靶点主要有CASP3、CASP8、MAPK14、FOS、CXCL2、IFNG、IL6等。IL-17 信号通路是在宿主免疫学中起关键作用的通路,在细胞增殖分化、生物因子转录与表达及免疫调节方面发挥重要作用, 与肿瘤、器官移植、感染及多种炎症过程密切相关[34]。在呼吸系统中,IL-17 作为联系T细胞与中性粒细胞的重要介质, 通过刺激支氣管上皮细胞 、血管内皮细胞和成纤维细胞合成 、释放 IL-8,GCP-2, MIP-2 与粘附因子等生物因子参与炎症状态下中性粒细胞在气道的募集[35]。另外,IL-17 还刺激支气管上皮细胞和成纤维细胞合成 、释放中性粒细胞活化因子 IL-6,并增强 MPO 和弹性蛋白酶活性[36]。《新型冠状病毒肺炎诊疗方案(试行第七版)》[37]中首次提出,对于双肺广泛病变及重型COVID-19患 者,如 实 验 室 检 测 白 细 胞 介 素 -6(interleukin-6,IL-6)升高者,可试用托珠单抗治疗。推测托珠单抗有可能通过阻断“炎症风暴”进而阻止轻症COVID-19患者向重症或危重症患者转变,从而降低病死率[38]。因此,可能推测金叶拜毒颗粒可能通过“IL-17 信号通路”调节白细胞介素-6的释放从而阻断“炎症风暴”达到干预COVID-19的效果。
2.4 金叶拜毒颗粒可能通过“EVGF 信号通路”干预COVID-19 金叶拜毒颗粒除了参与图6中的生物学过程,还参与了EVGF信号通路,Log10(P)= -16.80,Log10(q)= -15.45,参与的靶点主要有MAPK14、HSPB1、NOS3、PIK3R1等。VEGF 信号通路参与到血管新生整个过程,发挥了不可或缺的作用。VEGF及其受体广泛分布在肺部,不仅存在于肺泡上皮细胞,而且在血管、气道平滑肌细胞及血管内皮细胞等都有VEGF及其受体的表达[39]。SARS-CoV-2主要通过 2 型肺泡上皮细胞上的血管紧张素转化酶2( angiotensin-converting enzyme 2,ACE2) 首先感染肺,其最常见的致命并发症是急性呼吸窘迫综合征( acute respiratory distress syndrome, ARDS )[40]。ARDS以肺泡上皮损伤和毛细血管通透性增加所致弥漫性肺泡肺水肿及透明膜的形成为主要病理特征,以呼吸窘迫和严重低氧血症为主要临床表现。发病机制复杂。肺毛细血管内皮细胞损伤是其重要环节之一[41]。Gullen等[42]研究提示,VEGF作用于肺血管内皮细胞使肌动蛋自发生排列改变,细胞间隙形成,血管内皮通透性增加并导致肺水肿和肺泡内蛋白含量增高。陈思峰等[43]认为肺泡上皮屏障和肺毛细血管内皮屏障通透性增高引起肺水肿,肺泡上皮屏障通透性增加不是 SARS-CoV-2 引起的ARDS的唯一主要机制,我们应该对肺毛细血管内皮屏障的破坏引起足够的重视。因此,推断金叶拜毒颗粒可能通过“EVGF”信通路减少“炎症风暴”对肺血管上皮细胞和毛细血管内皮通透性从而干预COVID-2019。
综上所述,本研究利用网络药理学对金叶拜毒颗粒防治COVID-19进行探索性研究,槲皮素、山奈酚、木犀草素、β-谷甾醇、蒲公英黄铜、蒲公英赛酮、靛玉红、绿原酸、乙酰蒲公英萜醇这些化学成分作用于PTGS2、PPARG、NOS3、NOS2、CASP3等靶点,参与细胞分化、凋亡、信号传导等途径,进而调控免疫和炎症反应等相关通路、HIF-1信号通路和IL-17信号通路和EVGF信号通路。
参考文献
[1]宗阳,丁美林,贾可可,等.基于网络药理学和分子对接法探寻达原饮治疗新型冠状病毒肺炎(COVID-19)活性化合物的研究[J].中草药,2020,51(4):836-844.
[2]医药卫生网网站. 抗疫前线,“同济咖啡”金叶败毒颗粒再现身[EB/OL].[2020-02-17].http://www.yywsb.com/list,1245115.html.
[3]丁惠,张馨方,纪文华,等.蒲公英药用研究进展[J].辽宁中医药大学学报,2018,20(9):156-159.
[4]蒋喜巧,苗明三.蒲公英现代研究特点及分析[J].中医学报,2015,30(7):1024-1026.
[5]刘婷,张继秀,李先哲,等.蒲公英的开发与利用[J].沈阳药科大学学报,2019,36(5):450-458.
[6]邹世辉.蒲公英生物活性物质的研究进展[J].黑龙江农业科学,2019(8):186-189.
[7]尹明星,曹艳,施春阳,等.中药防治细胞因子风暴的研究进展[J].中草药,2020,51(5):1089-1095.
[8]刘闰平,葛俊德,钟颖,等.基于干预细胞因子风暴文献挖掘的中医药治疗重症新型冠状病毒肺炎探讨[J].中草药,2020,51(5):1096-1105.
[9]DAVIDSON S,MAINI M K,WACK A.Disease-promoting effects of type I interferons in viral, bacterial, and coinfections[J].Journal of interferon & cytokine research : the official journal of the International Society for Interferon and Cytokine Research,2015,35(4):252-64.
[10]HEIKO H,YASMINE B,RALF B,et al.C5a Negatively Regulates Toll-like Receptor 4-Induced Immune Responses[J].Immunity,2005,22(4):415-26.
[11]KHI J.Anaphylatoxins and infectious and non-infectious inflammatory diseases[J].Molecular Immunology, 2001, 38(2-3):175-187.
[12]何黎黎,龚普阳,封玥,等.中药在抗新型冠状病毒肺炎(COVID-19)引起的细胞因子风暴中的应用分析[J].中草药,2020,51(6):1375-1385.
[13]吴莎,金晓晗,施珊,等.槲皮素和穿心莲内酯的体外抗病毒作用[J].中药材,2012,35(12):2003-2006.
[14]WU W,LI R,LI X,et al.Quercetin as an Antiviral Agent Inhibits Influenza A Virus (IAV) Entry[J]. Viruses,2015,8(1);6
[15]ZHANG R,AI X,DUAN Y,et al.Kaempferol ameliorates H9N2 swine influenza virus-induced acute lung injury by inactivation of TLR4/MyD88-mediated NF-κB and MAPK signaling pathways[J].Biomedicine & pharmacotherapy = Biomedecine & pharmacotherapie, 2017(89):660.
[16]WU S,WANG H Q,GUO T T,et al.Luteolin inhibits CVB3 replication through inhibiting inflammation[J].Journal of Asian Natural Products Research, 2019, 22(8):1-12.
[17]LI H,ZHAO X,WANG J,et al.β-sitosterol interacts with pneumolysin to prevent Streptococcus pneumoniae infection[J].Rep, 2015, 5(1):17668.
[18]侯京玲,周霄楠,冯沙沙,等.蒲公英不同提取物抗炎效果研究[J].中国兽医杂志,2017,53(3):64-66.
[19]王通,曾耀英,肇靜娴,等.靛蓝和靛玉红对小鼠T细胞活化与增殖的影响[J].中国药科大学学报,2005(5):444-447.
[20]赖金伦,刘玉辉,刘畅,等.中药靛玉红作用机理及其临床应用研究进展[J].中兽医医药杂志,2017,36(1):76-79.
[21]抗晶晶,张丽娟,刘晓宁,等.绿原酸对脂多糖致炎症小鼠体内体外COX-2的影响[J].河南师范大学学报(自然科学版),2017,45(5):49-52.
[22]YAO X,LI G,BAI Q,et al.Taraxerol inhibits LPS-induced inflammatory responses through suppression of TAK1 and Akt activation[J].International Immunopharmacology,2013,15(2):316-324.
[23]COUSSENS L M,WERB Z. Inflammation and cancer.[J].Nature,2002,420(6917):860
[24]TAZAWA R, XU X M,WU K K,et al.Characterization of the genomic structure, chromosomal location and promoter of human prostaglandin H synthase-2 gene.[J].Biochem Biophys Res Commun, 1994, 203(1):190-199.
[25]SZCZEKLIK W, SANAK M, SZCZEKLIK A.Functional effects and gender association of COX-2 gene polymorphism G-765C in bronchial asthma[J]. Journal of Allergy & Clinical Immunology, 2004, 114(2):248-253.
[26]YANG H H,DUAN J X,LIU S K,et al.A COX-2/sEH dual inhibitor PTUPB alleviates lipopolysaccharide-induced acute lung injury in mice by inhibiting NLRP3 inflammasome activation[J].Theranostics, 2020, 10(11):4749-4761.
[27]FAN A Z,YESUPRIYA A,CHANG M H,et al.Gene polymorphisms in association with emerging cardiovascular risk markers in adult women[J].BMC Med Genet,2010,11(6):6
[28]韓雨薇,张媛媛,赖秀英,等.中药对一氧化氮合酶/一氧化氮系统调节作用的研究进展[J].中国药科大学学报,2017,48(1):8-15.
[29]李讨讨,高建锋,马友记.临床型乳房炎绵羊乳腺组织中CASP3和TLR2基因的差异表达分析[C].//2018年全国养羊生产与学术研讨会论文集,中国畜牧兽医学会养羊学分会:中国畜牧兽医学会养羊学分会,2018:2.
[30]SAQUIB A L,ALI M,KEISUKE K,et al.Caspases 3 and 7: key mediators of mitochondrial events of apoptosis[J].Science (New York, N.Y.),2006,311(5762):847-851.
[31]滑雅娜,鲁芙爱,王永福.HIF-1相关信号通路及其在自身免疫性疾病中作用[J].中国免疫学杂志,2019,35(8):1013-1017.
[32]XU Z,SHI L,WANG Y,et al.Pathological findings of COVID-19 associated with acute respiratory distress syndrome[J]. The Lancet Respiratory Medicine, 2020, 8(4):420-422.
[33]詹艺,刘含秋,李克.SARS-CoV-2感染的临床及胸部CT表现初探[J/OL].中国医学计算机成像杂志:1-7[2021-01-13].
[34]张志刚.IL-17的生物学特性及临床意义[J].国外医学(生理、病理科学与临床分册),2003(6):639-644.
[35]LAAN M,PRAUSE O,MIYAMOTO M,et al.A role of GM-CSF in the accumulation of neutrophils in the airways caused by IL-17 and TNF‐α[J]. European Respiratory Journal, 2003, 21(3):387-93.
[36]HOSHINO H,LAAN M,SJOSTRAND M,et al.Increased elastase and myeloperoxidase activity associated with neutrophil recruitment by IL-17 in airways in vivo[J].Journal of Allergy & Clinical Immunology, 2000, 105(1):143-149.
[37]国家卫生健康委办公厅,国家中医药管理局办公室.新型冠状病毒肺炎诊疗方案(试行第七版)[EB/OL].[2020-03-05]http://yzs.satcm.gov.cn/zhengcewenjian/2020-05-28/15455.html.
[38]左玮,刘容吉,许秀丽,等.托珠单抗不良反应研究进展[J].临床药物治疗杂志,2020,18(3):16-20.
[39]高云,罗凤鸣,范志航.血管内皮生长因子与肺部疾病的关系[J].国际呼吸杂志,2013,33(19):1512-1516.
[40]LIU J,LIU Y,XIANG P,et al.Neutrophil-to-lymphocyte ratio predicts critical illness patients with 2019 coronavirus disease in the early stage[J]. Journal of Translational Medicine, 2020, 18(1):206
[41]TSIAMBAS E,PAPANIKOLAOU V,CHRYSOVERGIS A,et al.Coronavirus in Hematologic Malignancies: Targeting Molecules Beyond the Angiotensin-Converting Enzyme 2 (ACE2) Wall in COVID-19[J].Pathology & Oncology Research, 2020(3):2823–2825.
[42]CULLEN V C,MACKAREL A J,HISLIP S J,et al.Investigation of vascular endothelial growth factor effects on pulmonary endothelial monolayer permeability and neutrophil transmigration[J].General Pharmacology,2001,35(3):149-157.
[43]陈思锋.2019新型冠状病毒导致的致命肺渗漏的病理生理学机制和防治策略:兼论血透的应用与依据[J].中国病理生理杂志,2020,36(3):562-567.
