金喉健配方超临界提取工艺产物体外抗病毒研究
2021-06-08温荣城贾金艳李霞
温荣城 贾金艳 李霞
【摘 要】 目的:评价金喉健配方超临界提取物的体外抗流感(H1N1)病毒活性。方法:通过流感病毒感染MDCK细胞来测定病毒TCID50/mL=10-6.25;将提取物加入细胞已成膜的96孔板中检测金喉健配方超临界提取工艺产物对细胞的毒性;将提取物和病毒混合后加入细胞中检测金喉健配方超临界提取工艺产物体外抗流感病毒活性。结果:提取物的抗病毒活性与浓度呈正相关性,半数抑制浓度(IC50)为8.71μg/mL,在6.25~50μg/mL的有效剂量范围内,未见对细胞产生毒性,选择指数(SI)大于11.48。结论:金喉健配方超临界提取工艺产物具有抗H1N1流感病毒活性。
【关键词】 金喉健;超临界提取;抗病毒药;H1N1
Abstract:Objective To evaluate the in vitro anti-influenza (H1N1) virus activity of the product extracted by supercritical fluid extraction of Jinhoujian Spray formulation. Methods TCID50 was determined by influenza virus infecting MDCK cells(TCID50/mL=10-6.25). The extract was added into the 96-well membrane of the cell to detect the toxicity of the product of the supercritical extraction process of Jinhoujian Spray formulation. The extracts were mixed with the virus and then added to the cells to detect the effect of the product on the virus in vitro. Results The antiviral activity of the extract was positively correlated with the concentration. The half-inhibitory concentration (IC50) of the extract was 8.71μg/mL, no cytotoxicity was observed in the effective dose range of 6.25~50g/mL, and the selection index (SI) was greater than 11.48. Conclusion The supercritical extraction process of Jinhoujian Spray formulation has anti-H1N1 influenza virus effect.
Keywords:Jinhoujian; Supercritical Extraction; Antiviral Agents; H1N1
我国自古有采用熏蒸药材或佩戴含药材的香囊来避疫、防病的传统,称之为“芳香避秽”。芳香类药材具有抗菌、抗病毒、免疫调节的作用[1- 2]。金喉健喷雾剂(国药准字Z20025361)是基于民族药用植物艾纳香[Blumea balsamifera(L.)DC.]和大果木姜子(Litsea lancilimba Merr.)两个芳香类药材的现代中成药制剂,其中含有大量挥发油、黄酮和萜类成分[3-6],在临床上被广泛用于急慢性咽炎、扁桃体炎、急性支气管炎、小儿疱疹性咽峡炎等多种疾病[7-10],也有被用于治疗柯萨奇病毒感染引发的手足口病,缓解口腔局部症状的相关报道[11-13]。金喉健喷雾剂显现出具有抗病毒活性的新应用潜质,但迄今未有直接的研究报道。
本研究采用现代CO2超临界提取工艺获得金喉健传统配方中的提取物,通过H1N1流感病毒感染MDCK细胞来评价该提取物的体外抗病毒作用,符合中药品种二次开发和民族医药产业的创新与发展战略,为拓展金喉健喷雾剂在防治呼吸道传播疾病方面的新应用提供参考。
1 材料
1.1 试剂 DMEM培养基(Gibco公司);DMSO(天津津东天正精细化工试剂厂);奥司他韦(OSV,安耐吉公司);TPCK-胰蛋白酶(上海国源生物技术有限公司);CellTiter-Glo试剂盒((Promega Corp., Madison, WI, USA)。
1.2 仪器 QP-160型CO2恒温培养箱(BIOBASE公司);XDS-1倒置相差显微镜(深圳市星明光学仪器有限公司);L500低速离心机(湖南湘仪实验仪器开发有限公司);1510全波长酶标仪(Thermofisher公司)。
1.3 病毒与细胞 甲型流感病毒减毒株A/WSN/33(H1N1),由中国医学科学院医学生物研究所提供;犬腎细胞(Madin-Daby canine kidney cells, MDCK),由中国医学科学院医学生物研究所提供。
2 方法
2.1 供试品制备 使用超临界CO2提取法对金喉健配方的中药饮片进行提取获得提取物,由贵州宏宇药业有限公司提供(批号:19ZY023001)。以DMSO溶解提取物配置成浓度为10mg/mL、5mg/mL、2.5mg/mL、1.25mg/mL、0.63mg/mL、0.32mg/mL、0.16mg/mL、0.08mg/mL的母液,再分别将母液用培养基稀释,依次配置成为100μg/mL 、50μg/mL、25μg/mL、12.5μg/mL、6.25μg/mL、3.13μg/mL、1.56μg/mL和0.78μg/mL八个浓度,作为提取物组待测溶液。
以DMSO溶解OSV,再用培养基稀释为100μm/mL浓度,作为阳性对照组待测溶液;配置含1%DMSO的培养基,作为空白对照组待测溶液。
2.2 病毒培养与毒力测定 将病毒接种于9~11日龄的鸡胚尿囊腔,35℃培育72h,无菌操作收获尿囊液。3000rpm离心15min以除去沉淀,收集上清液。将收集的病毒液做10倍系列稀释为10-1至10-8共8个稀释度,加入已贴壁的96孔板MDCK细胞中,每个浓度8个孔,每孔细胞大约3×104个,同时设空白对照组。各孔中MDCK细胞于35℃吸附病毒2h后换用培养液,置于培养箱中继续培养(37℃,5%CO2),48h后在显微镜下观察细胞病变效应,根据按Reed-Muench法计算病毒的半数细胞培养物感染量TCID50/mL=10-6.25。
2.3 提取物对细胞的毒性作用测定 将MDCK细胞以每孔3×104个细胞接种于96孔板,置培养箱(37℃,5%CO2)中,待细胞单层吸附于96孔板,吸弃上清液。分别加入100μL不同浓度提取物溶液作为提取物组,每个浓度重复3个孔,同时设阳性对照组(OSV, 100μM/mL)和空白对照组(DMSO,1%),置培养箱(37℃,5%CO2)中培养36~40h后,采用CellTiter-Glo试剂盒检测细胞活力。
细胞活力=各组细胞的检测值/空白对照组细胞的检测值×100%
2.4 提取物对流感病毒感染细胞活性的影响 取细胞已单层吸附的96孔板,接种100 TCID50病毒液,每孔100μL,在培养箱(37℃,5%CO2)中吸附2h后,吸弃病毒液。往各孔中分别加入不同浓度提取物溶液作为提取物组,每个浓度重复3个孔,同时设阳性药组、病毒对照组和空白对照组。置培养箱(37℃,5%CO2)中培养36~40h以后,测定含病毒状态下各组的细胞活力。计算提取物对病毒的抑制率,采用Probit回归分析[14]得出半数抑制浓度(50% Inhibiting Concentration, IC50),并计算选择指数(Selection Index,SI)。
提取物对病毒抑制率=1-(提取物对细胞作用检测值-提取物对病毒作用检测值)/(空白组检测值-病毒对照检测值)
2.5 统计方法 实验数据采用SPSS 21.0软件进行统计学分析,计量资料采用均数加减标准差(x±s)表示,多组间数据比较采用单因素方差分析。P<0.05为差异具有统计学意义。
3 结果
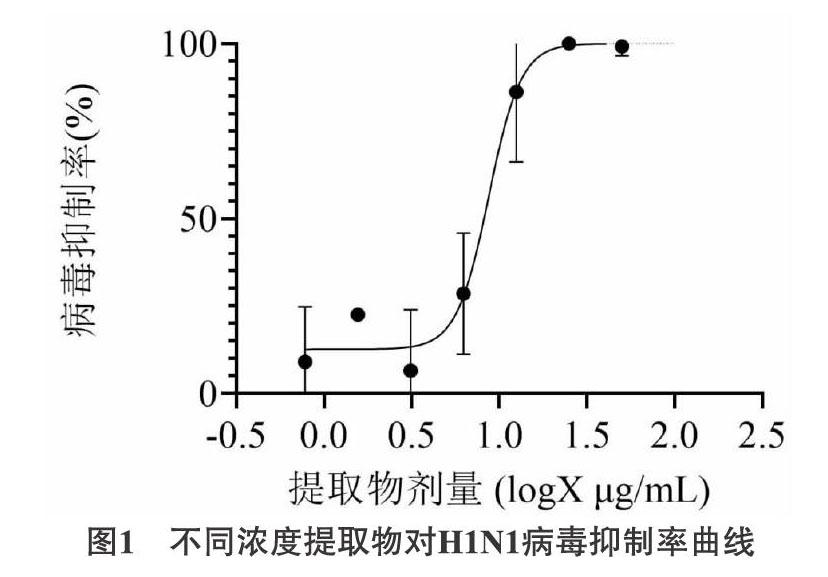
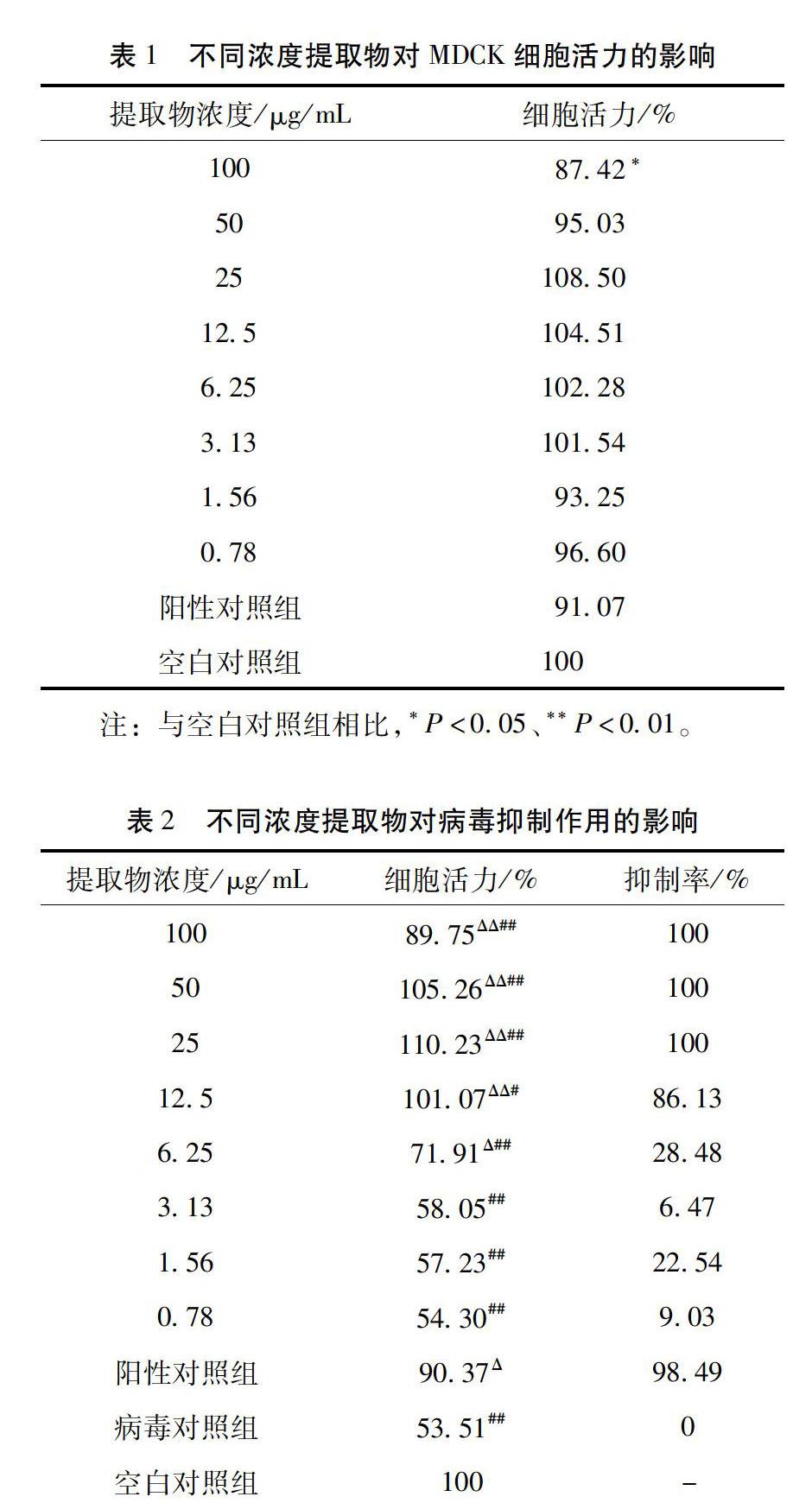
3.1 提取物对细胞毒性作用测定结果 当提取物浓度为0.78μg/mL、1.56μg/mL、3.13μg/mL、6.25μg/mL、12.5μg/mL、25μg/mL和50μg/mL时,细胞活力与空白组差异无统计学意义(P>0.05);在取物浓度升高到100μg/mL时,细胞活力降低至87.42%,低于空白对照组(P<0.05),提取物在此浓度下表现出轻微细胞毒性,但也可推断提取物对细胞的半数中毒浓度(TC50)应大于100μg/mL。见表1。
3.2 提取物体外抗病毒作用测定结果 当提取物浓度为0.78μg/mL、1.56μg/mL、3.13μg/mL时,提取物组的细胞活力与病毒对照组相比差异无统计学意义(P>0.05),表明提取物在这些浓度时对流感病毒没有抑制作用;当提取物浓度为6.25μg/mL、12.5μg/mL、25μg/mL、50μg/mL、100μg/mL时,提取物组细胞活力高于病毒对照组,差异有统计学意义(P<0.05),表明提取物在这些浓度时对流感病毒有抑制作用。见表2。
3.3 提取物对病毒的半数抑制浓度 通过Probit回归分析计算提取物对病毒的半数抑制浓度(IC50)为8.71μg/mL,SI = TC50 / IC50,因TC50应大于100μg/mL,所以提取物选择指数SI应大于11.48。(在此筛选体系下OSV的IC50为7.12μg/mL)。如图1所示。
4 讨论
流感是由流感病毒引起的一种急性、传染性呼吸系统疾病,主要通过接触传播、飞沫传播和气溶胶传播[15]。人类感染流感病毒后常出现发烧、肌痛、全身乏力、咳嗽咽痛和鼻炎[16]。2019年流行病学研究显示,全球每年有38.9万例呼吸性死亡与流感有关,相当于全年呼吸性死亡总数的2%[17],仅2017年流感引发的呼吸道感染导致全球945万人入院和14.5万人死亡[18]。因此控制流感的流行已是全球公共卫生系统所面临的重要问题之一。
目前,抗流感病毒的化学药主要分为M2离子通道抑制剂、神经氨酸酶抑制剂及RNA聚合酶抑制剂三类,其共同特点是针对病毒生命周期中的特异性靶点设计,作用机理较为清晰,但由于流感病毒基因复制过程中的高突变率易导致各类抗流感药物临床应用均受日益显著的耐药性限制。M2离子通道抑制剂(M2 Inhibitor),如金刚烷胺,能阻碍病毒外膜与内涵体膜融合,达到阻止病毒基因组复合体无法进入胞浆的目的[19],但目前流行的流感毒株对金刚烷胺类大多耐药,金刚烷胺在美国已不被推荐用作抗流感药物[20]。神经氨酸酶抑制剂(NA Inhibitor),如奥司他韦,通过抑制流感病毒的NA蛋白发挥抗病毒作用[21],如今也已出现耐药性病毒株的传播。流感RNA聚合酶抑制剂(RNA Polymerase Inhibitor),如巴洛沙韦,可阻止聚合酶功能和流感病毒mRNA复制[22],此类新药目前仅在美国和日本上市,尚處于专利保护期[23],价格昂贵。因此,寻找兼具低耐药性与经济性优势的新一代病毒抑制剂的研究需求依旧迫切。
天然药物在我国资源分布广泛,易获取,成本低廉,不受化学药专利保护制约,是我国创新药物研究的制高点。民间使用药用植物在预防和治疗呼吸传播疾病有着悠久的历史,在流感防治方面具有独特的优势,不仅表现出广谱抗病原微生物作用,同时还兼有提升机体免疫和抗炎功效,从而起到综合治疗的效果[24]。本研究发现,金喉健喷配方使用CO2超临界提取工艺得到的提取物对流感病毒(H1N1)有较好的体外抑制作用,提取物在6.25~50μg/mL的有效剂量范围内,未见提取物对细胞产生毒性,并且提取物对病毒的半数抑制浓度(IC50)为8.71μg/mL,SI大于11.48,证明了该提取物在抗流感病毒方面的有效性和安全性。本研究为未来金喉健喷雾剂的二次开发,拓展新应用提供了一定的理论依据。
参考文献
[1]宋文娟,顾伟.芳香中药的药理学研究概况与展望[J].中华中医药杂志,2017,32(6):2609-2611.
[2]谭艳云,赵扬,王文平,等.药用香囊浅谈[J].中国民族民间医药,2017,26(14):6-7.
[3]刘杰,郭江涛.大果木姜子挥发油的研究进展[J].化学工程师,2019,33(12):48-50,36.
[4]王军才,刘济明,文爱华,等.贵州省苗药植物大果木姜子的研究进展[J].黑龙江农业科学,2015(5):157-160.
[5]韦睿斌,庞玉新,杨全,等.艾纳香黄酮类化学成分研究进展[J].广东药学院学报,2014,30(1):123-127.
[6]吴丽芬. 艾纳香提取物质量标准与GC指纹图谱的研究[D].广州:广东药学院,2015.
[7]丁健,张先华.金喉健喷雾剂对小儿急性化脓性扁桃体炎的疗效观察[J].湖南师范大学学报(医学版),2008(2):44-46.
[8]杜广亮,廖媛.金喉健喷雾剂辅助治疗小儿疱疹性咽峡炎疗效观察[J].中医临床研究,2017,9(32):31-32.
[9]王俊,戚建伟.金喉健喷雾剂临床疗效观察[J].山西医药杂志(下半月刊),2008(10):888-889.
[10]袁娟,刘艳玲.金喉健雾化吸入联合抗感染治疗急性支气管炎疗效观察[J].中国卫生产业,2014,11(11):14-15.
[11]李亚平,魏剑平,戎萍,等.金喉健喷雾剂治疗小儿手足口病32例临床观察[J].河北中医,2011,33(4):634-635.
[12]梁建卫,张玉振,张静,等.清心泻脾汤联合金喉健喷雾剂治疗手足口病普通型100例[J].中药材,2012,35(9):1537-1539.
[13]钱丹丹,兰和魁,陈剑锋,等.金喉健喷雾剂治疗手足口病口腔疱疹80例[J].世界中医药,2012,7(2):119.
[14]田连起,黄鹤归,叶晓川,等.大青龙汤颗粒剂体外抗甲型H1N1流感病毒实验研究[J].中医学报,2013,28(2):172-175.
[15]李梦薇,王婷婷,丁玥,等.黄芩苷协同利巴韦林对流感病毒A/FM/1/47(H1N1)的体内外抑制作用[J].药物生物技术,2016,23(1):30-34.
[16]COSTA SNIA S,COUCEIRO JOS NELSON S S,Silva Isabel CRISTINA V,et al. Flavonoids in the therapy and prophylaxis of flu: a patent review[J]. Expert opinion on therapeutic patents,2012,22(10):1111-21.
[17]CHRISTOPHER E T,BRIGETTE F B,IBRAHIM A K,et al. Mortality, morbidity, and hospitalisations due to influenza lower respiratory tract infections, 2017: an analysis for the Global Burden of Disease Study 2017[J]. The Lancet Respiratory Medicine,2019,7(1):68-69.
[18]PAGET J,SPREEUWENBERG P,CHARU V,et al. Global mortality associated with seasonal influenza epidemics: New burden estimates and predictors from the GLaMOR Project[J]. Journal of global health,2019,9(2):020421.
[19]CLERCQ D E.Antiviral agents active against influenza A viruses[J]. Nature reviews. Drug discovery,2006,5(12):1015-25.
[20]BASSETTI M,CASTALDO N,CARNELUTTI.Neuraminidase inhibitors as a strategy for influenza treatment: pros, cons and future perspectives[J]. Expert opinion on pharmacotherapy,2019,20(14):1711-1718.
[21]JING X H,MA C L,OHIGASHI Y,et al. Functional studies indicate amantadine binds to the pore of the influenza A virus M2 proton-selective ion channel[J]. Proceedings of the National Academy of Sciences of the United States of America,2008,105(31):10967-72.
[22]YOUNG-A H. Baloxavir: First Global Approval[J]. Drugs,2018,78(6):693-697.
[23]李佳悅,刘洋.巴洛沙韦[J].中国药物化学杂志,2019,29(5):411.
[24]徐培平,赵昉,刘妮,等.中药体外防治甲型H1N1流感病毒实验研究[J].实用预防医学,2012,19(8):1121-1124.
