Sonic Hedgehog信号通路对小鼠血管瘤内皮细胞增殖的影响
2021-06-08张敏鸿卢洪飞
张敏鸿,曾 勇,卢洪飞
血管瘤是婴幼儿时期较为常见的内皮细胞异常增殖所致的一种良性肿瘤,发病率为4%~5%,其发病机制尚未明晰[1]。大多数血管瘤病变可自然消退,但部分患者瘤体生长在关键部位,导致溃疡、毁容或器官功能损害,甚至危及生命[2]。目前,虽然普萘洛尔已成为血管瘤治疗的临床一线药物,但仍存在部分患者对普萘洛尔耐药以及复发等情况,增加了治疗难度。因此,研究血管瘤进展过程中的相关信号通路,可为血管瘤分子靶向药物研发提供新的思路。血管的生成及发生受细胞信号通路调控网络的精密调节,血管瘤的发生发展与多条信号通路异常、失活密切相关,包括血管内皮生长因子(vascular endothelial growth factor,VEGF)/血管内皮生长因子受体(vascular endothelial growth factor receptor,VEGFR)信号通路、Notch信号通路、Ang-Tie信号通路、肾素-血管紧张素系统(renin-angiotensin system,Ras)信号通路等[3-4]。Sonic Hedgehog是一条调控分泌信号蛋白、进化高度保守的信号通路[5],其在控制胚胎发育和成体组织稳态中至关重要,对包括细胞增殖、凋亡在内的几乎所有细胞过程的调节起到关键作用[6]。Sonic Hedgehog信号通路在血管生成及发生中发挥重要作用,在胰腺癌、肝癌、动脉粥样硬化、缺血性心脏病等病理条件下可见其异常表达[7-10]。本研究旨在分析Sonic Hedgehog信号通路对小鼠血管瘤内皮细胞(mouse hemangioma endothelial cells,EOMA细胞)增殖的影响,以探讨Sonic Hedgehog信号通路对血管瘤发生发展的作用及其可能的分子机制,为血管瘤的治疗和诊断提供新的思路。
1 材料与方法
1.1实验仪器 细胞培养箱(Thermo,Forma 311)、洁净工作台(SW-CJ-2FD,上海博迅)、荧光定量PCR仪(Bio-Rad,CFX3.1)、流式细胞仪(BD,FACSCalibur)、连续光谱多功能酶标仪(Thermo Fisher,Varioskan Flash)、超纯水仪(Millipore,RiOs5+Milli-Q Biocel)、万向脱色摇床(北京六一,WD-9405B)等。
1.2实验材料与试剂 EOMA细胞系(由赣南医学院第一附属医院临床医学研究中心保藏并提供);高糖Dulbecco′s Modified Eagle Medium(DMEM)培养基、0.25%胰酶、胎牛血清(fetal bovine serum,FBS)购于美国Gibco公司;噻唑蓝(methyl thiazolyl tetrazolium,MTT)粉剂购于美国Sigma公司;EdU细胞增殖检测试剂盒、Sonic Hedgehog信号通路抑制剂GANT61、Sonic Hedgehog信号通路激动剂SAG等购于上海碧云天公司。所有化学试剂均达分析纯。
1.3细胞培养 使用含10%FBS的高糖DMEM培养基,于5% CO2、37 ℃恒温细胞培养箱中培养EOMA细胞。细胞生长至对数生长期时以0.25%胰酶消化,1 000 r/min离心5 min,传代,进行后续实验。
1.4MTT比色法检测细胞增殖抑制率 取对数生长期细胞,胰酶消化制成单细胞悬液,经细胞计数,接种2×103个EOMA细胞于96孔板,最终工作体积为200 μl。设调零组、对照组、实验组,各孔均重复3次。EOMA细胞培养12 h后,加入不同浓度的GANT61及二甲基亚砜(dimethyl sulfoxide,DMSO),GANT61工作浓度分别为10、20、40、80、160 μmol/L,DMSO含量不高于0.1%。培养24、48、72 h后,加入20 μl 5 mg/ml MTT溶液,37 ℃恒温培养箱继续孵育4 h,吸弃上清,每孔加入150 μl DMSO。酶标仪测量各孔490 nm波长处的光密度OD吸光值。计算细胞增殖抑制率。细胞增殖抑制率=(对照组OD值-实验组OD值)/(对照组OD值-调零组OD值)×100%。应用GraphPad Prism 6.0软件计算GANT61作用EOMA细胞24 h的半数抑制浓度(IC50),选择合适浓度范围用于后续实验。
1.5EdU染色流式细胞术检测细胞增殖 取对数生长细胞,胰酶消化制成单细胞悬液,经细胞计数,接种2×105个EOMA细胞于6孔板,细胞培养过夜。加入20、40、80 μmol/L浓度的GANT61及DMSO,药物处理24 h。培养基更换为1 ml 10 μM EdU培养基,孵育2 h,0.25%胰酶消化,1 000 r/min离心5 min收集细胞,加入1 ml 4%多聚甲醛固定15 min后,1 000 r/min离心5 min弃上清。加入2 ml 2 mg/ml甘氨酸中和5 min,1 000 r/min离心5 min弃上清。2 ml磷酸缓冲盐溶液(phosphate buffer saline,PBS)清洗1次,加入0.5% TritonX-100渗透剂室温孵育10 min,2 ml PBS清洗1次。加入200 μl Apollo染色反应液,避光孵育10 min,1 000 r/min离心5 min弃上清,加入3 ml 0.5% TritonX-100渗透剂清洗1次,1 000 r/min离心5 min弃上清,500 μl PBS重悬细胞,流式上机检测。EdU阳性细胞群为增殖细胞,细胞增殖抑制率即为EdU阳性细胞占比。
1.6实时荧光定量PCR(real-time quantitative polymerase chain reaction,RT-qPCR)法检测细胞周期蛋白D1(Cyclin D1)、增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)表达 提取20、40、80 μmol/L浓度GANT61及0.5 μmol/L浓度SAG处理24 h后的细胞总RNA,经逆转录成cDNA进行RT-qPCR检测,所用引物及其序列见表1。以2-ΔΔCt法计算目的基因相对表达量。

表1 引物名称及序列
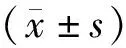
2 结果
2.1不同时间处理组不同GANT61浓度EOMA细胞增殖抑制率比较 MTT实验结果显示,GANT61处理浓度越大、作用时间越长,EOMA细胞的增殖抑制率越大,呈剂量及时间依赖性(P<0.05)。当处理24 h时,IC50值为79.42 μmol/L,选择20、40、80 μmol/L药物浓度进行后续实验。见表2。

表2 不同时间处理组不同GANT61浓度EOMA细胞增殖抑制率比较
2.2不同处理组EOMA细胞增殖率比较 EdU染色流式细胞术检测结果显示,随着GANT61药物浓度的增加,EOMA细胞增殖抑制率越大,呈计量依赖性(F=47.057,P=0.000)。0.5 μmol/L SAG干预处理可促进细胞增殖,与对照组[GANT61(-),SAG(-)]比较差异有统计学意义(t=5.819,P=0.004)。见图1。

图1 不同处理组EOMA细胞增殖率比较图
2.3不同处理组Cyclin D1、PCNA表达水平比较 RT-qPCR检测结果显示,Cyclin D1和PCNA的mRNA表达水平均随GANT61干预浓度的增加而降低,差异显著(F=15.788,P=0.004;F=19.324,P=0.002)。见图2ⓐ。与对照组比较,SAG干预处理可提高Cyclin D1和PCNA的mRNA表达水平,差异有统计学意义(t=3.250,P=0.035;t=2.978,P=0.041)。见图2ⓑ。

ⓐGANT61处理组;ⓑSAG处理组
3 讨论
3.1Sonic Hedgehog信号通路是一条进化高度保守的信号通路,其不仅能有效调控哺乳动物胚胎发育过程,而且在调控细胞分化、增殖、血管生成等方面起重要作用。在正常生理或病理条件下,Sonic Hedgehog信号通路在血管生成中发挥重要作用。研究表明[11]Sonic Hedgehog信号通路参与调控肿瘤血管生成,促进肿瘤生长和转移:在肝细胞癌中Sonic Hedgehog抑制剂Vismodegib/GDC-0449可阻断肝癌细胞中VEGF的产生,导致血管密度下降,血管生长减少,抑制肿瘤生长。Hong等[12]研究发现,结肠癌中Sonic Hedgehog信号通路核转录因子Gli1激活Sonic Hedgehog信号通路促进结直肠癌中淋巴管生成蛋白、VEGF-C和VEGFR3表达。另外,Huaitong等[13]研究发现口腔癌细胞释放的微泡通过Shh信号通路促进内皮细胞血管生成。目前,许多学者致力于靶向Sonic Hedgehog信号通路关键组分研究开发抗肿瘤药物[14],已有两种抑制剂LDE225/Sonidegib和GDC-0449/Vismodegib获得美国食品药物管理局(Food and Drug Administration,FDA)批准,用于治疗基底细胞癌[15],同时大量靶向Sonic Hedgehog信号通路的抗肿瘤药物也处于临床试验中。基于Sonic Hedgehog信号通路对肿瘤血管生成的调控作用,通过靶向Sonic Hedgehog信号抑制血管生成或许可为抗血管生成提供理论依据。
3.2血管瘤是婴幼儿时期最常见的良性软组织实体肿瘤,尽管大多数血管瘤为可自行消退的自限性疾病,但其呈浸润性生长,破坏周围组织,且部分患者由于肿瘤处于快速增生期或位于重要部位,可导致瘤体破溃、出血、功能损害等严重并发症,引起生理功能障碍,甚至危及生命,所以血管瘤在一些情况下又具有部分恶性肿瘤进程的特点[16]。目前,有关血管瘤的发病机制并不明晰,进一步深入研究血管瘤自行消退机制,对血管瘤的早期诊断及治疗具有重要意义。近年国内外研究[17-18]发现在增殖期血管瘤中可见Sonic Hedgehog信号通路配体蛋白Shh、转录因子Gli2及其靶基因FOXA2表达上调,Sonic Hedgehog信号通路异常激活,但Sonic Hedgehog信号通路在调控血管瘤进展中的作用机制及调控Sonic Hedgehog信号通路对血管瘤细胞生物学功能作用的文献报道较少。
3.3EOMA细胞是小鼠血管瘤内皮细胞,为血管瘤研究常用细胞模型。本研究结果显示Sonic Hedgehog信号通路抑制剂GANT61可抑制EOMA细胞增殖,且呈时间及剂量依赖性,而Sonic Hedgehog信号通路激活剂SAG可促进EOMA细胞增殖。RT-qPCR检测结果显示,经GANT61干预作用后,EOMA细胞的增殖相关基因PCNA及Cyclin D1表达下调,且呈剂量依赖,而SAG干预可上调PCNA及Cyclin D1的表达。表明Sonic Hedgehog信号通路在EOMA细胞增殖中发挥重要作用,特异性抑制该信号通路可抑制EOMA细胞增殖,这与相关文献结果相似,其机制可能为Sonic Hedgehog信号通路通过调控PCNA及Cyclin D1参与细胞增殖,但是否通过调控血管瘤内皮细胞增殖来调节血管生成具体机制有待进一步研究。
综上所述,调控Sonic Hedgehog信号通路活性可影响血管瘤细胞增殖,提示Sonic Hedgehog信号通路可能参与了血管瘤的发生发展过程,这可能为血管瘤的诊治方法提供了新的思路方向。但本研究未能在临床组织样本中检测血管瘤患者中Sonic Hedgehog信号通路其他关键组分的表达情况,也未涉及动物水平的体内研究,研究结论及具体机制有待进一步深入研究。
