蒙古族不同龋敏感儿童变形链球菌产酸耐酸及耐酸因子遗传多态性研究
2021-06-08王昭君祁安舒
缪 羽,王昭君,祁安舒
(1.内蒙古医科大学第四附属医院口腔科,内蒙古 包头 014030;2.河北经贸大学金融学院)
变形链球菌(S.mutans)作为主要的致龋菌,通过粘附、产酸、耐酸等作用导致牙体硬组织脱矿与再矿化的失衡[1~3]。菌细胞经糖酵解产生乳酸后口腔pH值降低,釉质崩解脱落脱矿,形成龋齿;同时为了适应低pH值的口腔环境,菌细胞通过酸适应性或耐酸性维持一个相对中性的胞内环境得以长期生存[4~6]。乳牙龋病发生与地域、民族、生活习惯均有相关性[7,8],蒙古族遗传多态性及生活饮食方式对龋病的影响可能存在不确定性。本课题通过蒙古族不同龋敏感儿童口腔变形链球菌的致龋过程分析,为区域蒙古族龋病防治提供思路。
1 材料与方法
1.1 研究对象及样本收集
受试者选取2015-09~2015-12包头市蒙古族幼儿园3~5岁70名的蒙古族儿童(高龋40名,无龋30名)。使用CPI探针在自然光条件下收集上述儿童牙菌斑,无龋儿童选取颊侧面菌斑,高龋儿童取龋病损区的菌斑。受试儿童取样前一天晚上不刷牙漱口,第二天早晨不进食喝水,所取牙菌斑置于含硫乙醇盐转送液的EP管中,上端加液体石蜡密封,冰浴下转送到-20℃的冰箱保存。所有受检儿童均家长同意,并签知情同意书。
1.2 诊断标准
点隙窝沟或光滑面有明显龋洞、釉质下破坏、可探及底部发软或洞壁的病损为龋。以龋失补牙数(decayed missing filled teeth,dmft)作为高龋和无龋判定标准,dmft≥5为高龋组,dmft=0为无龋组[9]。
1.3 纳入及排除标准
(1)纳入标准:①出生于内蒙古包头地区的蒙古族(三代内无与其他民族婚配);②3~5岁的儿童,乳牙已经全部萌出、未发生脱落,无恒牙早萌现象;③龋坏牙齿未进行充填等治疗;④未戴牙齿矫正器者;⑤检查前一个小时未进食,能够配合取样;(2)排除标准:①口腔有除龋病以外其他严重感染病灶;②有全身系统性疾病和(或)家族遗传性疾病;③因其他疾病近3个月内服用过抗生素等药物。
1.4 实验菌株
40例高龋儿童和30例无龋儿童牙菌斑,经过培养,形态学、生化反应、16sDNA鉴定,共获得40株变形链球菌临床分离株(21株来自高龋者,19株来自无龋者),国际参考菌株ATCC 25175(广东省微生物菌种保藏中心)。
1.5 实验方法
1.5.1 蒙古族不同龋敏感儿童口腔变形链球菌临床分离株产酸、耐酸能力测定以0.5为间隔配制含5%蔗糖pH值为7.0~4.0的BHI培养基。取国际标准株和临床分离株菌悬液,按照菌液与液体培养基1:10(v/v)比例接种细菌,37℃厌氧袋内培养48h,3000r/min离心15min,收集上清液体,精密酸度计测定上清液体的终末pH值,每个pH值测三次,取平均值,计算pH值变化值△pH值(初始pH值-终末pH值)即产酸能力。同样条件下,收集培养基内的细菌,用4mL无菌生理盐水稀释震荡混匀,紫光分光光度计测定540nm处的吸光度A值即耐酸能力。
1.5.2 蒙古族不同龋敏感儿童口腔变形链球菌临床分离株DNA提取经形态学鉴定的高龋组、无龋组变形链球菌临床分离株接种于选择培养基上,厌氧袋内培养48h,挑取单个菌落于10mL BHI培养基内增菌,细菌DNA提取试剂盒提取和纯度检测:提取DNA的A260/280比值在1.7~2.0之间,没有蛋白质和酚的污染,-20℃冰箱保存。
1.5.3 PCR反应和uncD扩增依次混匀并离心下列试剂:(1)1μL上游引物(引物1);(2)1μL下游引物(引物2);(3)2μL模板DNA;(4)25μL PCRmix;(5)21μL H2O。
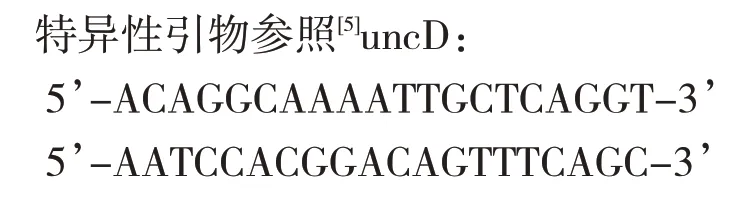
uncD扩增:充分扩增PCR反应产物,1%琼脂糖凝胶电泳检测PCR产物结果,凝胶成像系统分析,凝胶DNA回收试剂盒回收产物,-20℃冰箱保存。
1.5.4 蒙古族儿童变形链球菌耐酸因子F-ATPase亚基uncD基因的RFLP分析uncD选择限制性内切酶是AluI和HinfI。按照酶切条件:37℃恒温水浴中孵育18h,酶切产物行3%的琼脂糖凝胶电泳。
1.5.5 DNA测序40株蒙古族儿童高龋、无龋变形链球菌临床分离株与变形链球菌标准菌株进行细菌基因组DNA提取和PCR产物扩增,16SrDNA鉴定,测序结果在EZTaxon数据库进行Identify比对,利用MEGA软件构建菌株系统进化树。
2 统计学处理
采用SPSS 21.0软件统计分析,蒙古族不同龋敏感儿童口腔变形链球菌在pH值7.0~4.0条件下,高龋组和无龋组变形链球菌产酸和耐酸能力比较,以、采用独立样本t检验分析处理(检验水准α=0.05,P<0.05差别有统计学意义)。采用确切概率法分析处理蒙古族不同龋敏感儿童口腔变形链球菌耐酸因子F-ATPase亚基uncD基因分型(P<0.05为差别有统计学意义)。
3 结果
3.1 蒙古族不同龋敏感儿童口腔变形链球菌临床分离株产酸能力比较
蒙古族儿童口腔变形链球菌临床分离株的产酸能力随着pH值升高而升高;同一pH值条件下,高龋组产酸能力高于无龋组;pH值为7~6、4~4.5时,高龋组和无龋组的产酸能力差别尚无统计学意义(P>0.05);pH值为5.0~5.5时,高龋组与无龋组比较差别有统计学意义(P<0.05)(见表1)。
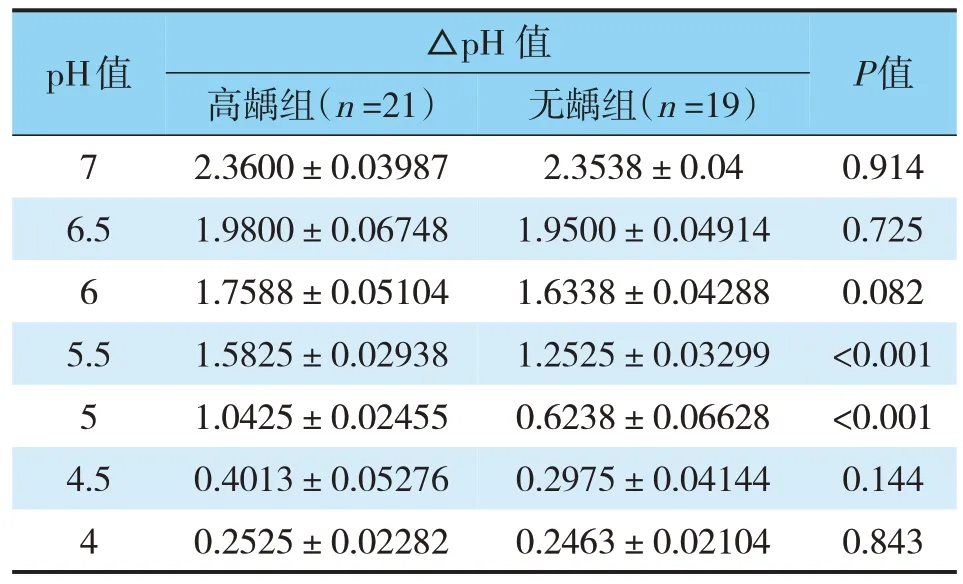
表1 pH7.0~4.0条件下不同龋敏感儿童变链菌的产酸能力(x±s)
3.2 蒙古族不同龋敏感儿童口腔变形链球菌临床分离株耐酸能力比较
随着pH值降低,蒙古族不同龋敏感儿童口腔变形链球菌临床分离菌株的生长受到抑制;同一pH值,无龋组菌株的生长抑制更明显;pH值4.5条件下,高龋组与无龋组菌株的耐酸性比较差别有统计学意义(P<0.05),其他pH环境中,两组间比较差别尚无统计学意义(P>0.05)(见表2)。
3.3 DNA测序结果
序列拼接后片段长度1336bp,结果如下:
表2 pH7.0~4.0条件下不同龋敏感儿童变链菌的生长情况(±s)

表2 pH7.0~4.0条件下不同龋敏感儿童变链菌的生长情况(±s)
pH值 吸光度A值P值高龋组(n=21) 无龋组(n=19)71.49263±0.0449391.40638±0.0648900.293 6.51.25738±0.0394551.21975±0.0655170.630 61.22225±0.0511611.22063±0.517440.982 5.50.89238±0.0593540.85863±0.0635890.704 50.51988±0.0645430.50413±0.0519710.852 4.50.24913±0.0131450.19850±0.0109560.010 40.16363±0.0104160.16213±0.0092670.916

3.4 样品的比对和菌株进化

图1 样品在EZTaxon数据库上Identify
EZTaxon数据库上进行Identify比对结果显示样品的序列与变形链球菌(S.mutans)的序列同源性很高,相似度高达100%。
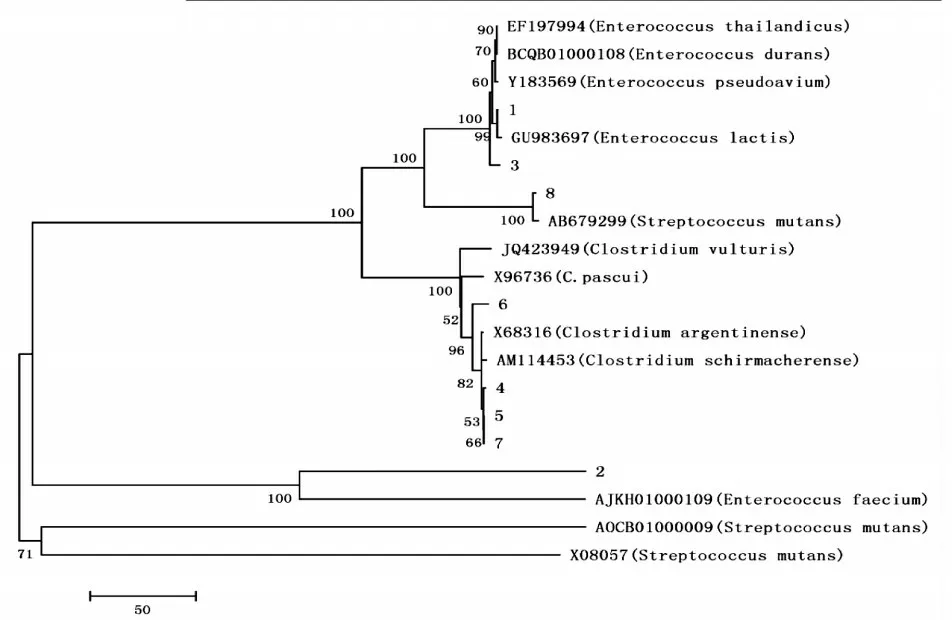
图2 菌株系统进化树
蒙古族儿童高龋组和无龋组变形链球菌临床分离株经blast比对和进化树分析,可确定样品中的细菌为变形链球菌(S.mutans),测序成功。
3.5 变形链球菌耐酸因子F-ATP酶的亚基uncD基因分析
以DNA为模板,特异引物扩增基因uncD,约1.3Kb,相对分子质量与引物相同,扩增条带亮度较高,无一杂带,说明特异性较高(见图3)。

图3 变形链球菌临床株F-ATPase亚基uncD基因扩增
通过对蒙古族不同龋敏感儿童变形链球菌耐酸因子F-ATPase亚基uncD的AluI-RFLP分析,表现为A和B两种基因型,且不同耐酸菌株中分布不同,差异有统计学意义(P<0.05),高龋组菌株B型居多,无龋组菌株A型居多(见表3)。

表3 蒙古族不同龋敏感儿童口腔变形链球菌临床分离株耐酸因子F-ATPase亚基uncD基因型分布
4 讨论
龋病贯穿于整个生命周期,乳牙龋病的发生发展使儿童的身心健康生长发育受到严重威胁。缪羽等调查[10]包头市3~5岁儿童患龋率65.7%,充填率仅2.3%,乳牙龋病形势不容乐观。本实验对内蒙古包头地区3~5岁蒙古族高龋、无龋儿童口腔变形链球菌初步分析,认为蒙古族不同龋敏感儿童口腔变形链球菌临床分离株在pH值7.0~4.0的BHI液体培养基中生长态势良好,随pH值升高产酸能力升高,同时菌株生长受到抑制,耐酸能力影响不一。同一pH值条件下,高龋组产酸能力、耐酸能力均高于无龋组,无龋组菌株生长抑制更明显;说明高龋组中变形链球菌数量多,龋病敏感性不同,产酸效果与龋病严重性相关,致龋性强。薛晶等人对不同龋敏感人群牙菌斑中变形链球菌群的分布的研究发现,高龋儿童检出率中位居前列,高达93.3%,无龋组的检出率仅为50%[11,12],本研究与其相一致。pH为4~4.5时,无龋组虽然产酸,但与高龋的产酸能力差别无统计学意义(P>0.05);pH升至6~7.0时,无龋与高龋的产酸能力差别尚无统计学意义(P>0.05),可能是糖酵解开始发生和达到最大临界值时,遗传主导的变形链球菌在不同个体中表现和能力各异,致龋能力结果不同[13],这也充分解释龋病致病因素的宿主个性化特点。pH为5~5.5时,致龋菌生长趋势下,高龋与无龋产酸能力差别有统计学意义(P<0.05),说明这一基线水平患龋率、龋坏程度与菌株敏感性相关。pH值4.5条件下,高龋组与无龋组菌株耐酸性有差别有统计学意义(P<0.05),其他pH环境中,菌株生长受到抑制,两组间差别尚无统计学意义(P>0.05),在复杂的口腔微生态环境中,细菌生存于适合自己的环境,基因类型及其遗传多态性可能是酸反应效应与龋病结果不同的原因[14,15]。
本实验依据生理生化和16SrDNA相结合的方法对变形链球菌进行鉴定,确定培养筛选的细菌为变形链球菌,为下一步实验研究打下了基础。变形链球菌临床株F-ATPase亚基uncD基因扩增反应条带清晰,确保了基因型纯度。与耐酸有关的质子移位膜ATP酶(membrane-bound proton-translocating F-ATPase)是一种重要的致龋酶,在龋病的发生发展中发挥重要的毒力作用,通过排除H+,维持跨膜pH梯度,与细菌的耐酸能力密切相关,它既增加变链菌的致龋性,又发挥不同龋敏感的竞争能力。本研究对内蒙古的蒙古族不同龋敏感儿童口腔变形链球菌的耐酸菌株利用限制性内切酶长度多态性分析和核酸测序比较突变位点,在限制性内切酶Alu和Hinf作用下分析发现uncD的基因型存在A、B两组基因型,高龋者以B型为主,低龋者以A型为主,且不同耐酸菌株中分布差别有统计学意义(P<0.05),不同龋敏感性所含的龋病基因数量、类型有差别,证实了蒙古族口腔变形链球菌uncD具有遗传多态性。不同种族与龋病相关性国内外也有报道:乌鲁木齐市维吾尔族儿童口腔分离的变链菌耐酸因子F-ATPase主要功能亚基uncD、uncEBF具有遗传多态性,与菌株耐酸能力相关,不同龋敏感巴西学龄前儿童S.mutans中高龋组携带更多的基因型。美国黑人不同龋敏感儿童S.mutans基因多态性与携带基因型呈相关关系。
综上所述,蒙古族不同龋敏感儿童口腔变形链球菌产酸耐酸能力不同,PH值的变化与变形链球菌的产酸和耐酸能力有一定关系,这也提示着龋病的发生与变形链球菌的产酸和耐酸能力有关,同时,变形链球菌的耐酸因子F-ATPase亚基uncD具有遗传多态性,与致龋严重性相关,但未发现uncD具有特殊基因型与种族龋病关联性,这需要我们对蒙古族儿童口腔变形链球菌的耐酸因子的其他基因型进一步研究。
