消除食品背景杂菌干扰的金黄色葡萄球菌分离方法的改进
2021-06-07区楚君尚岱麒吴酉芝施春雷
区楚君,尚岱麒,吴酉芝,2,施春雷*
(1 上海交通大学农业与生物学院 上海200240 2 上海中侨职业技术大学 上海201319)
金黄色葡萄球菌(Staphylococcus aureus,以下简称为金葡菌)一直以来都是我国监测的主要食源性致病菌之一。金葡菌之所以受到广泛的关注,是由于越来越多的案例证实,其不仅在食品中引起人群食物中毒和乳制品污染,而且在医疗过程中频繁引起医院和社区获得性感染,导致许多疾病难以完全治愈。金葡菌一般均具有较强的菌膜形成能力,使其广泛地存在于自然界的各种环境中,甚至人畜共患[3-4]。同时,菌膜被认为是耐药性传播的一种潜在载体,近年来日益凸显的细菌耐药性问题使得越来越多研究者的目光投向具有强菌膜形成能力的金葡菌。多项研究发现金葡菌存在多重耐药现象[5],可能成为细菌耐药性传播的载体[6],导致更加严重的耐药性问题。由此,金葡菌被世界卫生组织列为“高危害”监控对象[7],我国也逐步提高了对金葡菌的重视程度。
监控金葡菌的前提是能够有效鉴别、分离食品中的金葡菌。试验中一般依据GB 4789.10-2016《食品安全国家标准 食品微生物学检验 金黄色葡萄球菌检验》分离、鉴定食品基质中的金葡菌。该方法的主要步骤为:将待检测的食品放入无菌袋中,加入7.5%氯化钠肉汤进行增菌培养,然后根据Baird-Parker 琼脂平板和血平板上划线培养后的特异性现象鉴别、分离金葡菌。然而,本实验室研究人员前期试验发现,当检测冷冻肉(尤其是鸡肉)及肉制品时,常会出现一层灰色物质覆盖在Baird-Parker 琼脂平板上,改变了培养平板上可疑菌落的表观形态(如图1c所示),严重影响研究人员依据国标进行结果判定的准确性,由此引起误判而导致出现大量的假阴性结果。初步判断该物质为冷冻食品中污染的另一类背景杂菌,具有生长速度快(快于金葡菌)且扩散性强的特性,不仅影响人眼判定的结果,而且在后续试验中无法分离单菌落,难以获得较好的纯化结果。同时该杂菌也存在溶血现象,在血平板上的培养特征与金葡差异性不大,会产生大量的假阳性结果,因此本试验不采用血平板作为选择性平板。为了解决此类食品中存在杂菌污染无法分离金葡菌的问题,本研究根据金葡菌的生物学特性和其它文献研究,优化国家标准中的增菌方法,引入改良后的胰蛋白酶大豆琼脂(TSA)平板分离杂菌及纯化金葡菌单菌落,以降低假阴性结果的出现,避免多次纯化而造成试验资源的浪费。

图1 金葡菌受背景杂菌干扰时在Baird-Parker 平板上的菌落形态Fig.1 Colony morphology of S.aureus on Baird-Parker plate with the interference of background flora
有研究表明,金葡菌具有耐盐性,在10%~15%的高盐环境中也能生长良好[8],且在食品中提高盐浓度一直以来被视为抑制杂菌生长的有效手段。本试验通过提高增菌液中氯化钠质量分数来抑制杂菌的生长,以此改变金葡菌与杂菌的相对丰度,使得金葡菌成为增菌液中的优势菌,更易分离。同时,金葡菌可耐受低浓度的乙醇,0~1.5%乙醇对金葡菌生长无显著影响[9],甚至在2.5%~3.5%的乙醇胁迫下,金葡菌的菌膜形成能力会增加[10]。而乙醇作为一种常见的杀菌手段,绝大部分的杂菌对乙醇敏感。据此,将一定量的乙醇加入胰蛋白酶大豆琼脂(TSA)平板中,可以达到抑制杂菌生长的作用。除了抑制杂菌生长外,在应对杂菌的扩散性上,考虑增加TSA 中琼脂的含量,使其难以在培养基中发生迁移,实现杂菌的分离与金葡菌的纯化。本文研究以上3 个因素(增菌液中氯化钠质量分数、TSA 中乙醇的添加量和琼脂的添加量)对杂菌的影响,以期实现抑制杂菌生长和扩散,降低金葡菌分离中出现假阴性结果的可能性。
1 材料与方法
1.1 主要材料与试剂
本试验中涉及的金黄色葡萄球菌标准菌株ATCC 29213、ATCC 43300、Newman、SJTUF 21456、SJTUF 21510 以及分离纯化后的杂菌,均为本实验室保存菌株。
Baird-Parker 琼脂(BP)、胰蛋白酶大豆肉汤(TSB)、7.5%氯化钠肉汤,北京陆桥技术股份有限公司;95%乙醇,上海阿拉丁生化科技股份有限公司;LB 平板(10 g/L 胰蛋白胨、5 g/L 酵母提取物、10 g/L 氯化钠、15 g/L 琼脂);细菌基因组DNA 提取试剂盒,北京天根生化科技有限公司。
1.2 仪器与设备
5424D 型微量台式离心机、Mastercycler 型PCR 扩增仪,德国Eppendorf 公司;ES-315 型高压蒸汽灭菌锅,日本TOMY 公司;ZQZY-CF 型全温恒温培养摇床,上海知楚仪器有限公司;Sunrise 酶标仪,瑞士Tecan 公司。
1.3 方法
1.3.1 菌株活化及工作菌液的制备 取出-80℃超低温冰箱保存的菌株,使用接种环在TSA 平板上划线,置于37℃恒温培养箱中静置培养18~24 h。在平板上挑取单菌落转接至TSB 中,于37℃,200 r/min 条件下在摇床培养箱中连续培养10~12 h。取出后,10 000 r/min 离心30 s,弃去上清液,用0.85%氯化钠的生理盐水清洗沉淀,重复离心和清洗沉淀2 次,最后调节菌液的OD600nm 值为0.8 ±0.02。
1.3.2 确定接种比例将ATCC 29213 和杂菌调节至一致的OD600nm值,按1∶2,1∶1,2∶1 的比例,接种至10 mL 7.5%氯化钠肉汤中,于37℃,200 r/min 条件下在摇床培养箱中培养18 h。稀释后涂步于BP 平板上,监测2 种菌竞争生长情况,根据菌落计数法的结果确定最终的接种比例。
1.3.3 增菌液优化设置3 种分别含7.5%,10%,15%氯化钠的肉汤。将ATCC 29213 和杂菌按1.3.2 节确定好的比例接种至10 mL 含有不同质量分数氯化钠的肉汤中,设置为试验组。并把1 μL 的ATCC 29213 菌液接种至10 mL 含有不同氯化钠质量分数的肉汤中,设置为对照组。把2 组菌液同时置于37℃,200 r/min 条件下的摇床培养箱中连续培养18 h。培养结束后,划线于BP 平板,监测2 组的污染程度,根据菌落计数法的结果确定增菌效果。
1.3.4 TSA 分离平板优化 根据实验室标准,用单因素试验的方法确定琼脂质量分数、乙醇体积分数以及培养时间每个因素的取值范围,并设计了如表1所示的正交试验。以扩散半径、计数法和划线情况对比评价分离效果。其中,在平板中心处点种,培养结束后测量3 处中心点至菌落边缘的长度,然后取平均值作为扩散半径。

表1 正交试验设计Table 1 The design of orthogonal test
1.3.5 验证性试验
1.3.5.1 普适性试验 将本实验室保存的菌株ATCC 43300、Newman、SJTUF 21456、SJTUF 21510活化后,按1.3.2 节确定好的比例将纯种金葡菌菌株与杂菌混合,然后接种至优化后的氯化钠肉汤中,验证优化后的方法的分离效果。
1.3.5.2 采样分离试验 随机选取不同的采样点进行食品样品的采集工作,检测优化后的方法在实际应用中的分离鉴定效果。
1.3.5.3 杂菌种、属鉴定 将杂菌划线于改良后的TSA 平板上,挑取单菌落接种至TSB 中,于37℃,200 r/min 条件下在摇床培养箱中连续培养10~12 h。使用细菌基因组DNA 提取试剂盒完成DNA 提取。
通过16S rDNA 测序的方法确定杂菌的种、属,通用引物序列为:27F 5’-AGAGTTT GATCMTGGCTCAG-3’,1492R 5’-TACGGYTACCTTGTTACGACTT-3’。相对应的PCR 反应参数为:94℃预变性4 min;94℃变性30 s;54℃复性30 s;72℃延伸90 s;72℃复性和延伸10 min;35个循环。
2 结果与讨论
2.1 确定接种比例
BP 平板培养发现不同混合接种比例的杂菌都覆盖了整个平板表面(培养结果没有明显区别,故未放图)。杂菌的接种比例越高,平板上的污染越明显,越难以通过人眼辨别金葡菌菌落的典型状态。而3 种混合接种比例(1∶2,1∶1,2∶1)分别对应的平板上的金葡菌菌落数为1.1×107,1.5×107,7.5×106 CFU/mL。根据杂菌在BP 平板上的污染程度以及金葡菌的菌落总数,确定本试验中纯种金葡菌和杂菌的混合接种比例为1∶1。
2.2 增菌液优化结果
从BP 平板上的培养结果(表2)可以看出,10%氯化钠肉汤比7.5%氯化钠肉汤能够分离出更多的金葡菌。

表2 使用不同氯化钠质量分数的肉汤增菌后的平板计数结果Table 2 Colony counting results after enrichment with different NaCl mass fraction
通过计数法得到的培养结果显示,使用7.5%氯化钠肉汤增菌,对照组培养得到的菌落总数比试验组更多,说明金葡菌的生长受到了杂菌的影响。已有研究表明,金葡菌很难与基质中的其它微生物菌群竞争生长,即便是在更利于金葡菌生长的环境中,其它菌群也能够以包括营养竞争作用、拮抗作用和改变基质环境(如竞争消耗提供营养的底物、产生有机酸降低pH 值、增加氧气的消耗以改变氧浓度和氧化还原电位等)在内的多种方式成为优势菌[11]。
氯化钠质量分数增加至10%,试验组的计数结果为4.13×107CFU/mL,对照组的计数结果为4.10×107CFU/mL,两者间相差不大,由此可以看出,氯化钠质量分数高对金葡菌的生长影响并不明显,而对杂菌的抑制作用更强,使其与金葡的竞争能力下降。已有研究表明,金葡菌菌膜形成相关基因——icaA 在盐浓度较高的情况下表达量上升[12],更有利于菌膜形成[13],由此可减少高盐浓度的影响。同时,在高氯化钠质量分数的刺激下,金葡菌细胞质膜中的脂质成分也会出现变化,双磷脂酰甘油的合成量上升[14]。此外,金葡菌菌体也会产生相应的应激改变,如细胞体积变大、表面积减小、细胞壁的厚度和重量增加等[15]。这些盐胁迫反应都能够减弱高氯化钠质量分数对金葡菌生长的影响,增加金葡菌对10%氯化钠的耐受性。
然而当氯化钠质量分数为15%时,无论是BP平板的划线结果还是计数结果都表明金葡与杂菌均受到强烈的抑制,仅有少数菌体幸存。
2.3 TSA 分离平板优化结果
表3的试验结果表明,在培养基中添加乙醇和琼脂,金葡菌生长不受抑制;而试验组1~5 的扩散半径均大于0.2 cm,且划线结果显示杂菌和金葡菌无法分离,表明杂菌扩散的程度较高。对比试验组6 和试验组9,杂菌生长受到抑制,然而试验组6 的扩散半径较大,表明该分离平板条件对杂菌扩散性的抑制作用较差。从整体试验结果来看,试验组9 的分离效果最佳,不仅抑制了杂菌的生长,同时也有效地抑制了杂菌的扩散。
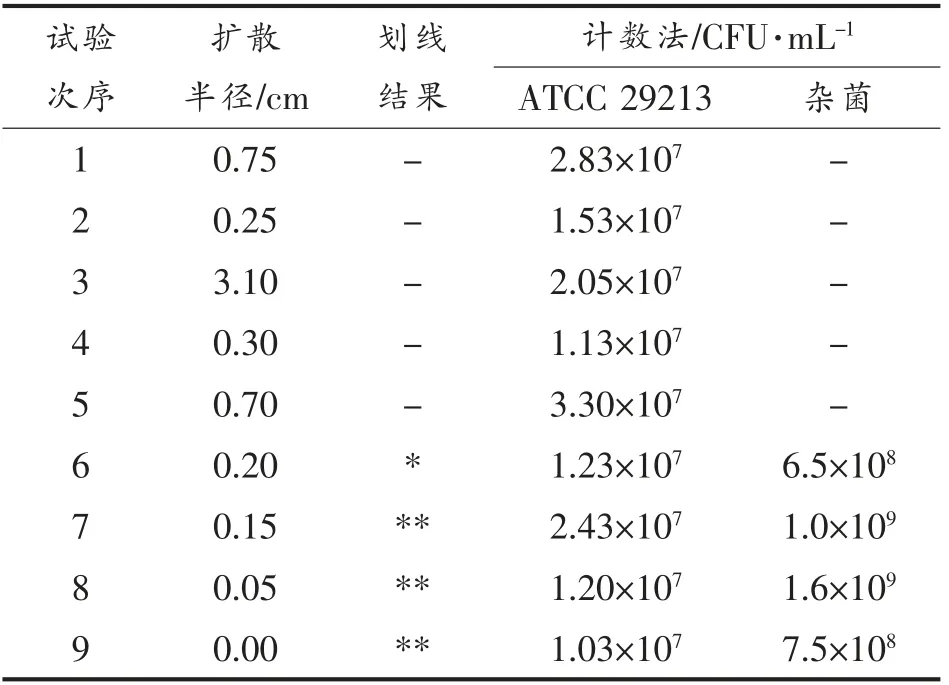
表3 TSA 分离平板优化效果评价Table 3 Evaluation on the optimization effect of TSA separation plate
2.4 验证性试验
普适性试验结果显示,4 种金葡菌(ATCC 43300、Newman、SJTUF 21456、SJTUF 21510)在BP 平板上均能被有效辨识,菌落数分别为5,14,6,6 CFU。在后续的的分离纯化步骤中,金葡菌能够在改良后的TSA 平板上形成单菌落,如图2所示,同时杂菌与金葡菌明显分离,没有出现扩散现象。

图2 4 株金黄色葡萄球菌在改良TSA 平板上的菌落形态Fig.2 The colony morphology of 4 strains on the modified TSA plates
把优化后的方法用于实际样品的分离、鉴定试验中,通过对比可以看到,食品基质中的金葡菌分离率由2.61%提升为19.98%(表4)。这些实际案例表明该优化方法有效地降低了假阴性结果的出现。
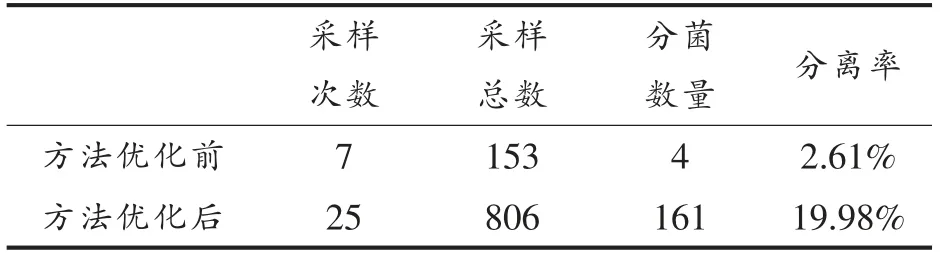
表4 方法改进前、后金葡菌分离情况对比Table 4 Comparison of separation of S.aureus before and after the improvement of the method
通过细菌16S rDNA 测序方法鉴定了该杂菌的种属,结果显示该杂菌为奇异变形杆菌。
尽管冷链储存和运输在一定程度上防止了食品的腐败,但其后不恰当的保存和售卖方式却引发了严重的奇异变形杆菌污染。这个问题可能成为未来冷藏和冷冻食品保藏的一大挑战。
3 结论
从冷冻肉及肉制品中分离金葡菌时,增菌液中氯化钠质量分数提高到10%可以有效地抑制背景杂菌的生长,而对金葡菌影响不大。当BP 平板上出现严重的杂菌扩散污染时,可挑取疑似菌落划线于含有2%乙醇和4%琼脂的TSA 平板上,静置培养18 h,由此可使金葡菌与杂菌完全分离。利用这一改进的方法,可有效降低假阴性结果的出现。
