红肉火龙果采后品质劣变及苹果酸代谢研究
2021-06-07刘瑞玲潘旭婕吴伟杰韩延超陈杭君郜海燕
刘瑞玲,潘旭婕,吴伟杰,韩延超,陈杭君,郜海燕
(浙江省农业科学院食品科学研究所 农业农村部果品采后处理重点实验室中国轻工业果蔬保鲜与加工重点实验室 浙江省果蔬保鲜与加工技术研究重点实验室 杭州310021)
火龙果(Hylocereus undatus)属仙人掌科(Cactaceae)三角柱属(Hylorereus)[1],原产于墨西哥、中美洲和南美洲,因其健康特性和营养价值受到重视而被广泛种植[2]。目前,市面上常见的火龙果品种主要有:白肉火龙果、红肉火龙果(Hylocereus polyrhizus)和紫红肉火龙果(Hylocereus costaricensis)3 种。其中,红肉火龙果果肉中富含白肉火龙果所缺少的甜菜色素,还含有丰富的不饱和脂肪酸、水溶性食物纤维等。除了有较高的营养价值外,红肉火龙果在抗氧化方面对人体也有一定的辅助作用[3]。
果实中有机酸的组成与含量是影响果实风味品质的重要因素。果实中存在许多种类的有机酸,然而大多数果实通常以1 种有机酸为主,少数以多种为主[4]。根据主要有机酸的种类,可以将果实分为苹果酸型果实、柠檬酸型果实和酒石酸型果实等[5]。果实中的有机酸代谢是一个复杂的生理过程,由有机酸的合成和降解共同决定[6]。有研究表明,苹果酸是火龙果的主要有机酸[7]。苹果酸脱氢酶(NAD-MDH)、磷酸烯醇式丙酮酸羧化酶(PEPC)和苹果酸酶(NADP-ME)是苹果酸代谢中关键的3 个酶,前两者催化苹果酸的合成,后者则参与苹果酸的降解,它们共同调节了火龙果生长发育过程中苹果酸的代谢和积累[8-10],其含量是一个动态变化的过程,可影响火龙果的风味品质。
目前关于红肉火龙果中苹果酸的代谢变化还未见研究报道。本试验研究了“玫瑰香”品种和“大红一号”品种火龙果贮藏过程中的品质变化和苹果酸代谢关键基因NADP-ME、PEPC 和NADMDH 的表达差异,为进一步研究红肉火龙果采后贮藏过程中苹果酸积累的调控机制和对风味特性形成的影响提供科学依据。
1 材料与方法
1.1 材料与试剂
1.1.1 材料 “玫瑰香”品种火龙果,采自浙江省江山市秋实家庭农场;“大红一号”品种火龙果,采自浙江省诸暨市雪锋火龙果基地,保鲜车运回实验室后置于10℃冷库中预冷12 h。
1.1.2 试剂 磷酸二氢钾、磷酸、福林-酚等(分析纯级),购自国药集团化学试剂有限公司;色谱级甲醇、色谱级乙腈,购自美国迪马科技公司;草酸、酒石酸、苹果酸、乳酸、柠檬酸、富马酸及琥珀酸标准品,购于阿拉丁试剂(上海)有限公司;异硫氰酸苯酯、三乙胺、游离氨基酸混标,购于美国Sigma试剂公司;PEPC 测定试剂盒,购于南京建成生物工程研究所。
1.2 仪器与设备
TAXT Plus 型质构仪,英国SMS 公司;PAL-1型手持折射仪,日本ATAGO 公司;877 Titrino plus 自动电位滴定仪,瑞士万通股份有限公司;UV-9000 紫外-可见分光光度计,上海元析仪器有限公司;Waters 高效液相色谱仪(型号e2695-2998 配有PDA 检测器),沃特世科技(上海)有限公司;微量分光光度计,日本SHIMADZY 公司;恒温扩增PCR 仪,美国赛默飞世尔科技公司;微量核算蛋白测定仪,美国赛默飞世尔科技公司;Thermo MR23i 高速低温冷冻离心机,法国捷安特集团股份有限公司。
1.3 试验方法
挑选无机械损伤,果实大小和成熟度相对一致的“玫瑰香”火龙果和“大红一号”火龙果。用2%次氯酸钠浸泡消毒后自然晾干,于25℃恒温培养,每组3 次重复。分别在贮藏第0,1,2,3,4,5,6,7,8 天定期取样,置于液氮中迅速冻存,混合后分装至样品袋中,于-80℃保存,用于后续品质指标测定。
1.3.1 硬度的测定 参考黄子娟[11]的方法,并稍作修改。采用质构仪测定火龙果的果皮硬度和果肉硬度,使用直径2 mm 探头(P/2 型),选取火龙果果实无鳞片的赤道部位进行穿刺测定,重复3次,取平均值,单位为N。
1.3.2 可滴定酸含量的测定 采用可滴定酸自动电位滴定仪测定。果肉匀浆后过滤,取滤液1 mL,用去离子水定容至100 mL,以0.05 mol/L NaOH溶液滴定,记录滴定终点时所用碱溶液的体积,并计算可滴定酸含量,重复3 次。
1.3.3 可溶性固形物含量的测定 采用手持折射仪测定样品可溶性固形物含量,重复3 次。
1.3.4 维生素C 含量的测定 参考吴媛媛等[12]的方法。称取1 g 火龙果研磨样,加入5% TCA 溶液,混匀后离心。取上清液依次加入5%三氯乙酸、0.5%邻菲罗琳-乙醇溶液、0.5%磷酸-乙醇溶液、0.03%三氯化铁-乙醇溶液和1 mL 无水乙醇后于30℃水浴1 h。用蒸馏水调零,以蒸馏水代替上清液为参比。在波长534 nm 处测定吸光度值,重复3 次,单位为mg/100 g。
1.3.5 总酚含量的测定 采用福林酚比色法,参考范智义等[13]的方法,并作适当修改。称取火龙果研磨样1.0 g,加入5.0 mL 60%乙醇浸提2 h,10 000×g 离心15 min,取上清液1 mL 至25 mL具塞试管中,加入3 mL 1.0 mol/L 福林酚试剂后摇匀,静置5 min 后加入6 mL 7.5%碳酸钠,用蒸馏水定容至25 mL。室温下在暗处放置2 h,以不加没食子酸的样品为空白,于波长760 nm 处测定其吸光度值,重复3 次,以没食子酸含量为标准物测定总酚含量,单位为μg/g。
1.3.6 可溶性糖含量的测定 参考曹健康等[14]的苯酚-硫酸法,并作适当修改。称取火龙果研磨样1.0 g,加入5~10 mL 蒸馏水后封口,于100℃水浴30 min,冷却后过滤,滤液移入100 mL 容量瓶,回收残渣,加入5~10 mL 蒸馏水于100℃水浴10 min 后冷却、过滤,合并滤液。取500 μL 样品液于试管中,加入1.5 mL 蒸馏水和1.0 mL 9%苯酚,摇匀,在5~20 s 内加入5 mL 浓硫酸,摇匀,室温下反应30 min,以空白为参比,在波长485 nm 处测定其吸光度值,重复3 次。
1.3.7 有机酸组分的测定
1)色谱条件C18 反相色谱柱(3.9 mm×300 mm,5 μm);柱 30℃;流动相为0.04 mg/L KH2PO4-H3PO4缓冲溶液∶甲醇=95∶5(体积比);流速0.8 mL/min;进样体积10 μL;配有PDA 检测器,检测波长214 nm;外标法定量。
2)提取方法 采用高效液相色谱法,参考关秀杰等[15]的方法,并作适当修改。称取火龙果研磨样5.0 g 于10 mL 容量瓶,加入一定量流动相,于75℃水浴45 min,冷却至室温,定容。涡旋2 min,超声提取15 min,过滤分离蛋白质等大分子物质。取一定量滤液,离心10 min 后用0.45 μm 孔径的滤膜过滤上清液,备用。
1.3.8 NAD-MDH 和NADP-ME 酶活的测定
1)酶液提取参考Masashi 等[16]和Hirai等[17]的方法,稍作修改。取5 g 火龙果研磨样,加入10 mL 经预冷的研磨缓冲液(包含10 mmol/L 异抗坏血酸、0.6 mol/L 蔗糖、0.2 mol/L Tris-HCl,pH 8.2),低温离心后取上清液。用pH 8.2 的提取缓冲液(包含10 mmol/L 异抗坏血酸、0.1%曲拉通X-100、0.2 mol/L Tris-HCl)定容到50 mL,混匀后用提取缓冲液定容至100 mL,酶液低温保存备用。
2)酶活测定NAD-MDH 和NADP-ME 酶活性测定参考Hirai 等[17]的方法。
1.3.9 PEPC 酶活的测定使用PEPC 测定试剂盒测定样品中PEPC 的酶活。
1.3.10 总RNA 提取及检测 使用天根多糖多酚植物总RNA 提取试剂盒提取火龙果总RNA。取1 μL RNA 通过核酸蛋白测定仪测定OD260/OD280比值检验RNA 纯度,用普通琼脂糖凝胶电泳检验RNA 完整性。
1.3.11 RT-qPCR 分析以总RNA 为模版,采用诺维赞反转录试剂盒,在冰浴条件下进行第1 链cDNA 的合成。
苹果酸代谢相关基因引物(表1)通过Primer软件自主设计,检验引物熔解曲线单一(无特异性产物)后,可用于实时荧光定量分析。
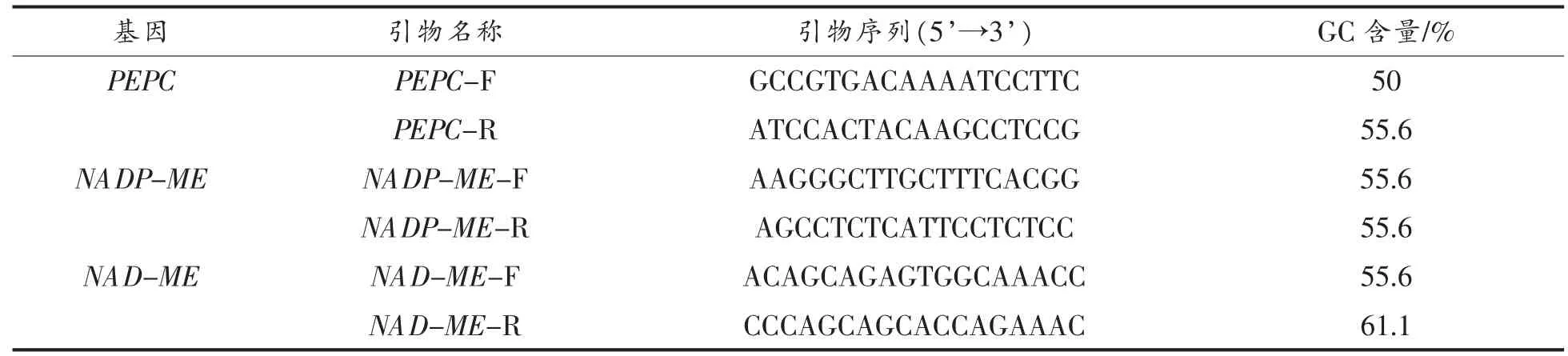
表1 火龙果苹果酸代谢相关基因引物序列Table 1 Primer sequence of Hylocereus polyrhizus on malate metabolism related genes
基因表达分析均以YLS8 作为内参基因[18],采用2-ΔΔCt法计算相对表达量,以3 个生物学重复的“平均数±标准差”表示。
1.4 数据处理
采用Excel 2010、Graphpad prism 8 软件系统进行数据处理。
2 结果与分析
2.1 不同品种红肉火龙果贮藏过程中品质的变化
果皮硬度和果肉硬度是反映火龙果耐贮性的重要指标,能够直观反映火龙果果实采后软化的程度[8]。如图1a 和图1b所示,在25℃贮藏条件下,随着贮藏时间的延长,火龙果的果皮硬度和果肉硬度逐渐下降,贮藏后期随着腐败严重,硬度下降很快。“玫瑰香”品种在第3 天和第5 天,“大红一号”品种在第2 天和第5 天硬度均有上升现象,可能是由温度较高,火龙果过度失水导致。“玫瑰香”品种火龙果在贮藏期间,果皮硬度下降了45.86%,果肉硬度下降了68.35%;“大红一号”品种火龙果在贮藏期间,果皮硬度下降了46.68%,果肉硬度下降了59.28%。
在贮藏过程中由于呼吸作用,火龙果果实中的可溶性固形物作为呼吸底物会被消耗[19]。如图1c 和图1d所示,在贮藏过程中“玫瑰香”品种和“大红一号”品种火龙果的可溶性固形物和可溶性糖含量的总体变化不明显,这可能是由于常温贮藏使得糖代谢处于一个较高的水平,淀粉等糖类物质分解为可溶性固形物的速率大于可溶性固形物作为底物被消耗的速率。图1d 中“玫瑰香”品种火龙果的可溶性糖含量在第4 天达到最高值,随后呈下降趋势,可能是由于在贮藏前期糖类物质分解为可溶性固形物的速率小于可溶性固形物作为底物被消耗的速率,贮藏后期糖类物质含量降低,分解速率下降,果实呼吸作用消耗底物,导致可溶性糖含量下降。
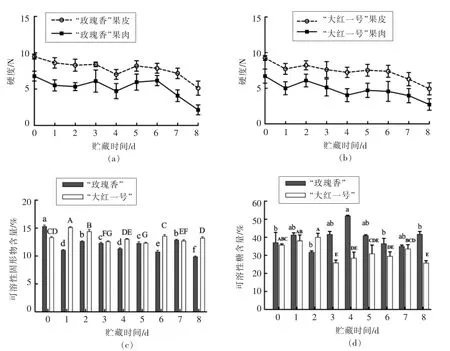
图1 不同品种红肉火龙果在贮藏过程中品质的变化Fig.1 Changes in quality decline of different varieties of red pitaya during storage
2.2 不同品种红肉火龙果贮藏过程中总酚和VC含量的变化
总酚是火龙果中重要的营养成分之一,多酚化合物具有清除自由基、防止衰老等功能[20]。如图2a所示,“玫瑰香”品种和“大红一号”品种火龙果的总酚含量在贮藏期间呈现下降的趋势。
VC 也是火龙果中重要的营养成分之一,能维持活性氧代谢平衡、延缓后熟软化,是果实内清除活性氧的一种重要的抗氧化剂,对延缓果实衰老有一定效果[21-22]。“玫瑰香”品种和“大红一号”品种火龙果的VC 含量如图2b所示,随着贮藏时间的增加,VC 含量均呈现下降趋势,与总酚含量的变化趋势一致,说明随着贮藏时间增加,果实逐渐软化腐败,火龙果的抗氧化能力下降。
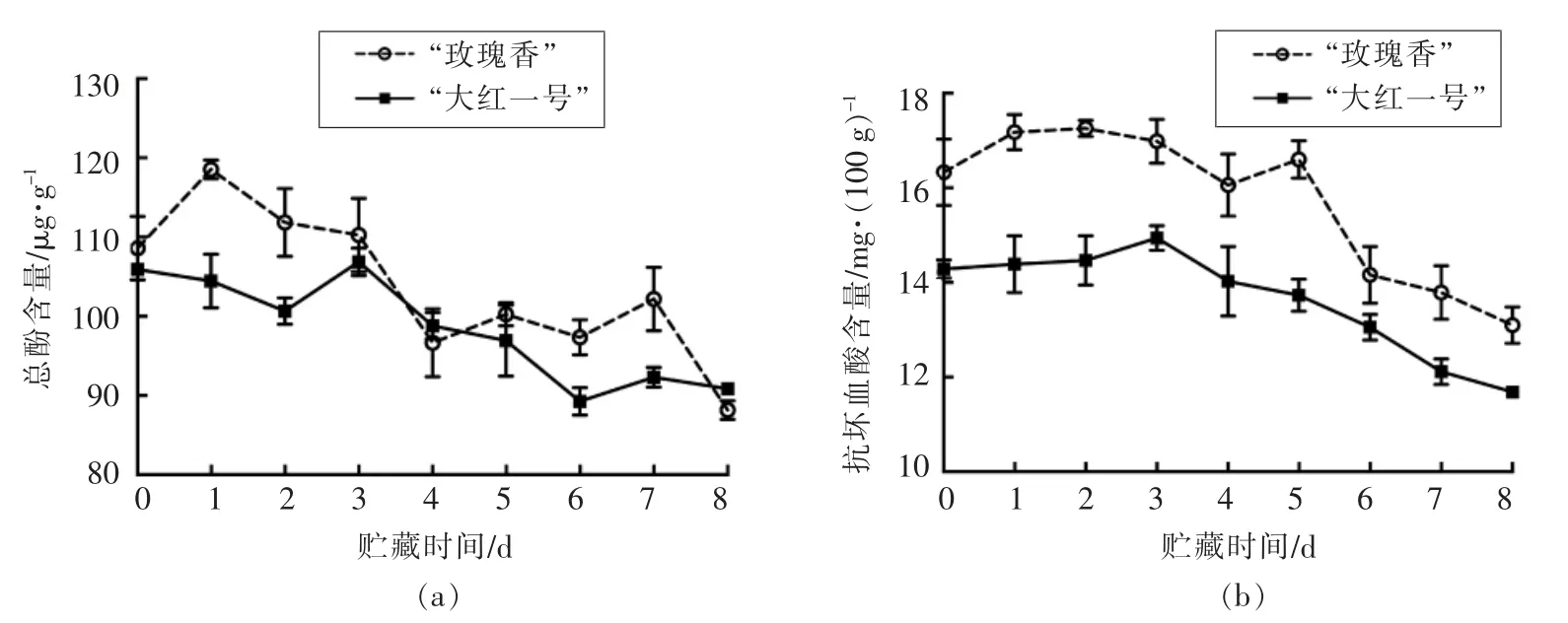
图2 不同品种红肉火龙果贮藏过程中VC 和总酚含量的变化Fig.2 Changes of VC and total phenol contents during storage of different varieties red pitaya
2.3 不同品种红肉火龙果贮藏过程中有机酸含量的变化
有机酸含量是影响果实风味品质的重要因素,不同的主要有机酸种类构成了果实特殊的风味[6,23]。“玫瑰香”品种火龙果和“大红一号”品种火龙果的可滴定酸含量如图3a所示,在贮藏期间呈现下降趋势,这是由于有机酸作为呼吸底物,通常在TCA 循环中被降解。通过测定“玫瑰香”品种和“大红一号”品种火龙果中7 种有机酸(分别为苹果酸、草酸、酒石酸、柠檬酸、琥珀酸、富马酸和乳酸)含量的变化趋势,得出苹果酸为2 个品种火龙果中含量最高的有机酸,这与Bellec 等[24]的研究结果一致,说明可滴定酸含量下降主要是由苹果酸含量下降导致的。
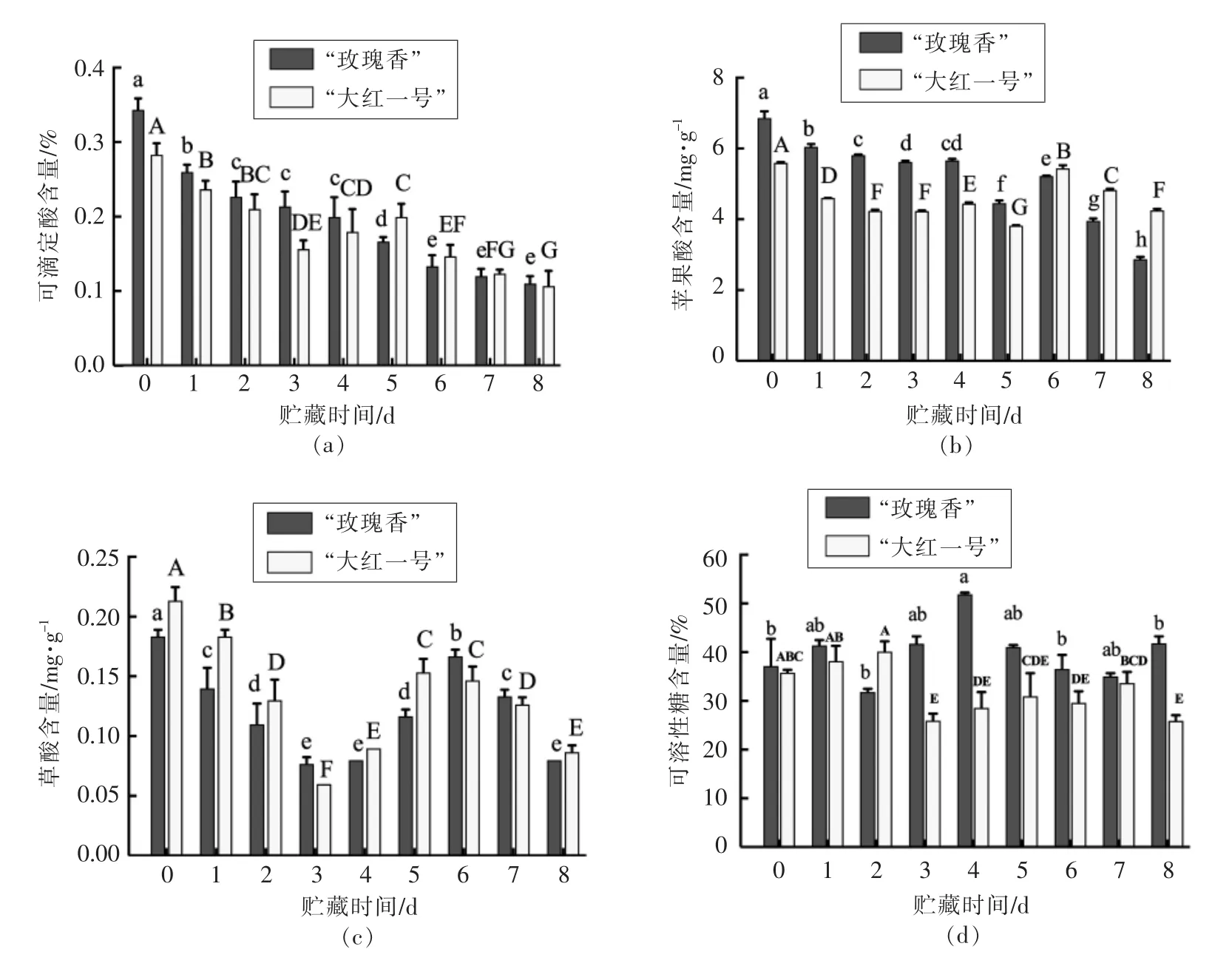
图3 不同品种红肉火龙果贮藏过程中有机酸含量的变化Fig.3 Changes of organic acid contents in different varieties of red pitaya during storage
2.4 不同品种红肉火龙果苹果酸代谢相关酶活性变化
苹果酸脱氢酶(NAD-MDH)、苹果酸酶(NADP-ME)和磷酸烯醇式丙酮酸羧化酶(PEPC)是影响苹果酸代谢的关键酶[25]。“玫瑰香”品种和“大红一号”品种火龙果果实中的有机酸主要以苹果酸为主,苹果酸代谢途径是果实有机酸代谢的途径之一,这与杨道富等[7]的研究结果一致。
苹果酸的积累受苹果酸代谢关键酶的调控,NAD-MDH 和PEPC 主要负责调控苹果酸的合成,NADP-ME 主要负责苹果酸的降解[26]。如图4a和图4b所示,在贮藏前期,2 个品种火龙果的NAD-MDH 和PEPC 活性也呈上升趋势;在贮藏后期,苹果酸的合成速度低于苹果酸作为底物被消耗的速度,故呈下降的趋势。从图4c 可以看出,负责苹果酸降解的NADP-ME 在火龙果贮藏过程中呈现上升的趋势,这与苹果[27]、樱桃[28]中的苹果酸代谢酶活变化一致,总体与2 个品种火龙果的苹果酸含量趋势一致。
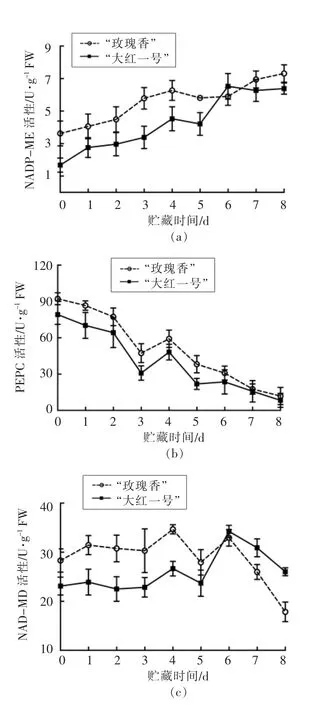
图4 不同品种红肉火龙果贮藏过程中苹果酸代谢相关酶活变化Fig.4 Changes of malate metabolism related enzyme activities of different varieties of red pitaya during storage
相关性分析结果(表2)表明,“玫瑰香”品种火龙果的NAD-MDH 和PEPC 活性与苹果酸含量呈极显著正相关(P<0.01),NADP-ME 活性与苹果酸含量呈极显著负相关(P<0.01);“大红一号”品种火龙果的NAD-MDH 活性与苹果酸含量呈显著正相关(P<0.05),PEPC 活性与苹果酸含量呈正相关,NADP-ME 活性与苹果酸含量呈负相关。
2.5 苹果酸代谢相关基因表达量的变化
采用RT-qPCR 测定火龙果苹果酸代谢相关基因的相对表达量。NADP-ME 基因主要参与调控苹果酸的降解,如图5a所示,NADP-ME 的表达量在“玫瑰香”品种和“大红一号”品种火龙果中均呈现先下降后上升的趋势,在贮藏第8 天,该基因在“玫瑰香”品种中的表达量显著高于“大红一号”,且相关性分析(表2)表明“玫瑰香”品种NADP-ME 的相对表达量与酶活呈极显著正相关;“大红一号”品种的NADP-ME 相对表达量与酶活呈显著正相关,表明NADP-ME 基因的表达水平与火龙果果实贮藏过程中苹果酸含量密切相关,直接影响果实的口感和风味。
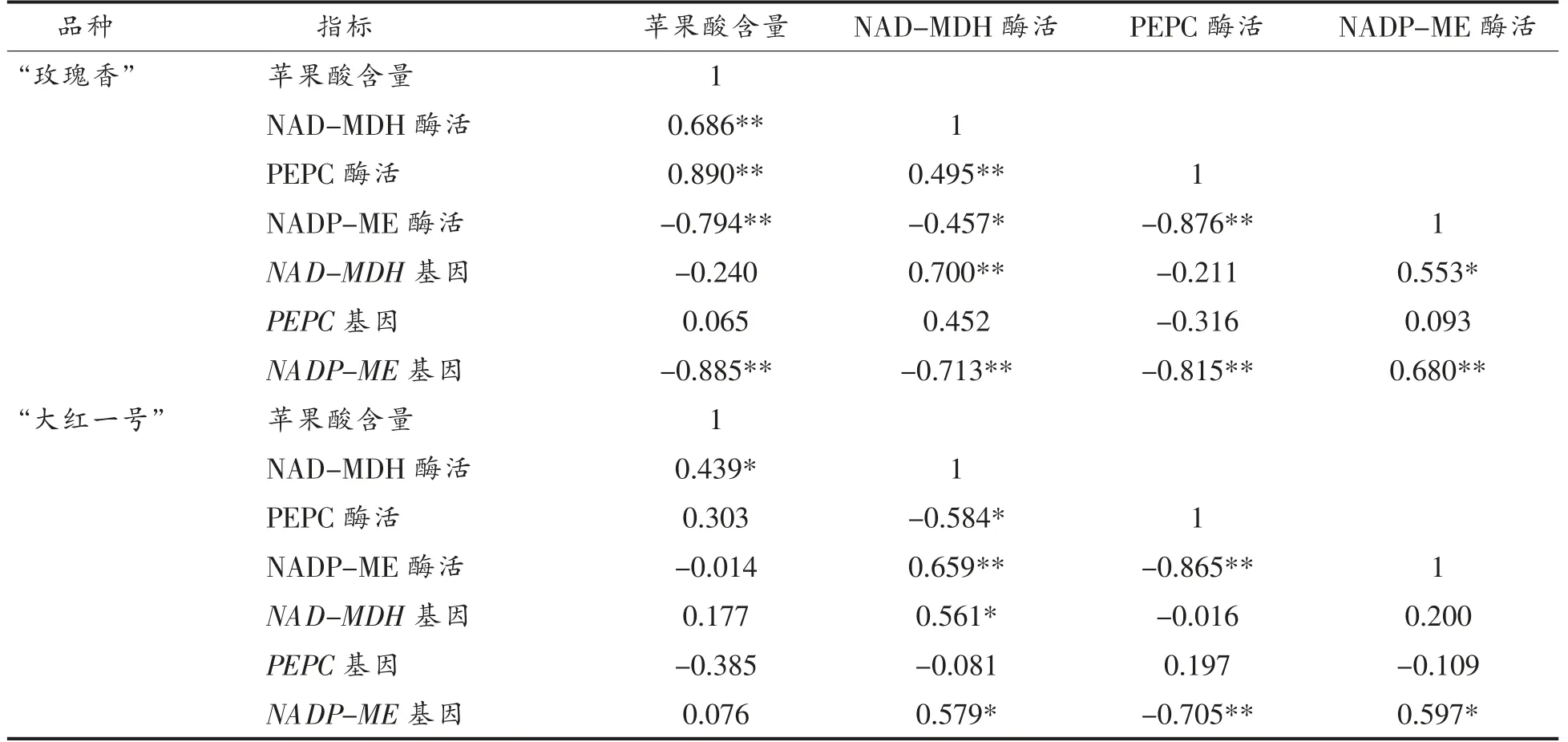
表2 苹果酸含量、苹果酸代谢相关酶及基因间Pearson 相关系数Table 2 Pearson correlation coefficients among malic acid content,malic acid metabolism-related enzymes and genes
PEPC 和NAD-MDH 基因是果实发育过程中苹果酸代谢的关键基因,与苹果酸的合成相关。PEPC 和NAD-MDH 主要参与苹果酸的合成。由图5b 可知,PEPC 相对表达量在贮藏过程中呈现先上升后下降的趋势,细胞质内的丙酮酸被还原为乳酸,导致细胞质内可转化为苹果酸的丙酮酸含量降低,间接导致细胞质内的苹果酸含量的降低。在贮藏第6 天,“玫瑰香”品种的PEPC 相对表达量达到峰值,与PEPC 酶活性呈负相关;在贮藏第4 天,“大红一号”品种的相对表达量达到峰值,与PEPC 酶活呈正相关。如图5c所示,NAD-MDH相对表达量总体呈现先上升后下降的趋势,相关性分析表明,“玫瑰香”品种的NAD-MDH 相对表达量与酶活呈极显著正相关;“大红一号”品种的NAD-MDH 相对表达量与酶活呈显著正相关,这与Famiani 等[29]的研究结果一致。PEPC 和NADMDH 2 个基因的相对表达水平与火龙果果实贮藏过程中苹果酸的积累密切相关,直接影响果实的口感和风味。
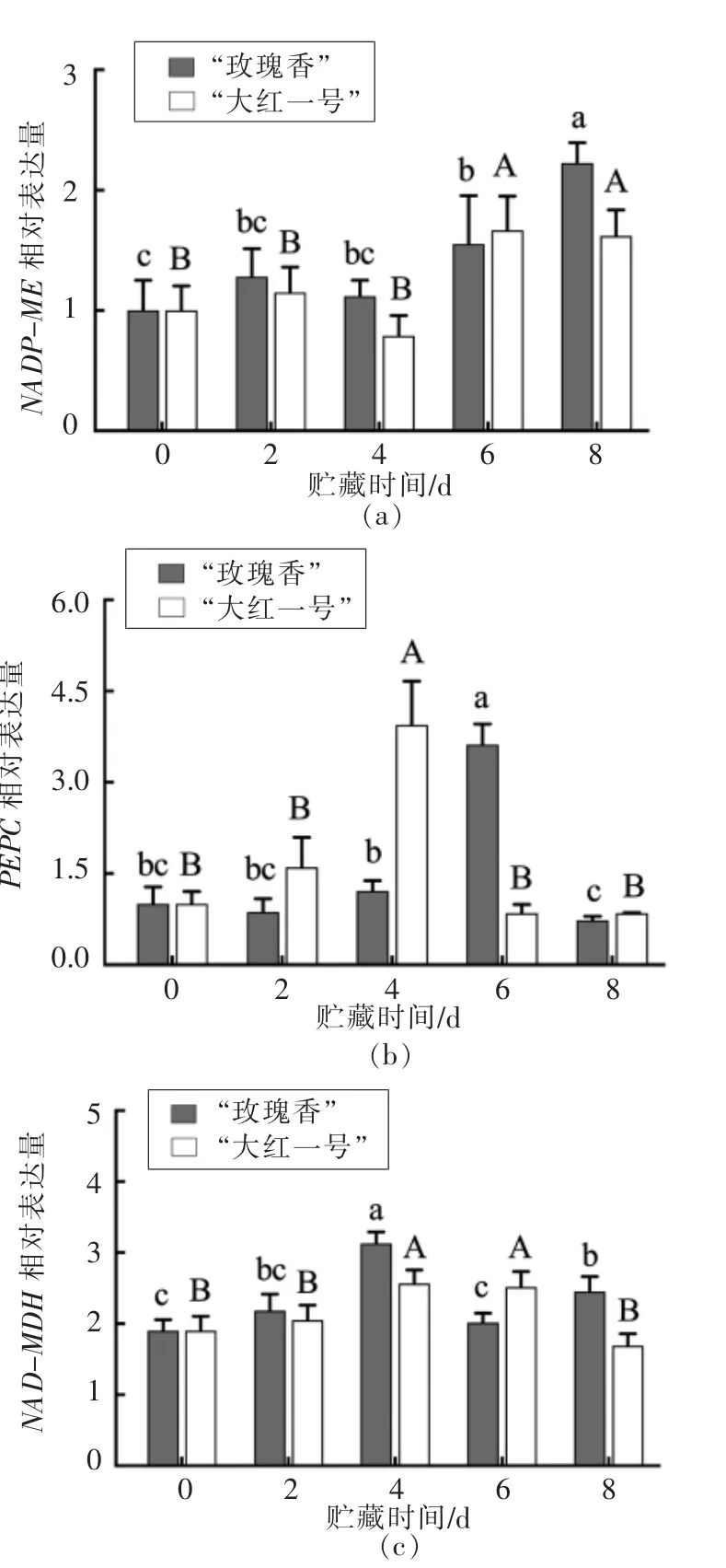
图5 不同品种红肉火龙果贮藏过程中苹果酸代谢相关基因表达量变化Fig.5 Changes in the expression of malate metabolism-related genes of different varieties of red pitaya during storage
3 结论
红肉火龙果采后品质劣变由果皮和果肉硬度下降及可滴定酸、抗坏血酸、总酚含量降低共同导致。苹果酸为红肉火龙果果实中有机酸的主要成分,其含量变化导致果实有机酸含量下降。负责苹果酸合成的NAD-MDH 和PEPC 的酶活性与苹果酸含量呈正相关,而负责苹果酸降解的NADP-ME则与苹果酸含量呈负相关。进一步研究测定苹果酸相关代谢酶NADP-ME、PEPC 和NAD-MDH 基因水平变化,发现苹果酸代谢相关基因水平的变化与酶活的变化趋势一致。火龙果采后贮藏过程中,PEPC 和NAD-MDH 的基因水平呈下降趋势,而NADP-ME 的基因水平呈上升趋势,使得果实中苹果酸合成受阻,降解加剧,最终导致苹果酸含量下降,火龙果在贮藏过程中品质变劣。
