2株米曲霉的特色酶系对酱油理化指标及品质的影响
2021-06-07路怀金刘通讯赵谋明林涵玉陈子杰冯云子
路怀金,刘通讯,赵谋明,林涵玉,陈子杰,冯云子
(华南理工大学食品科学与工程学院 广州510641)
酱油由酱演变而来[1],现今已是亚洲重要的大宗调味品,且越来越受到世界人民的欢迎。酱油是用大豆或豆粕、小麦或麸皮酿造的液体调味品,原料中的蛋白质、淀粉、脂质等营养物质在微生物发酵作用下分解且相互作用,经过长时间的日晒夜露,最终形成的酱油具有滋味鲜美、酱香浓郁的特色。
酱油发酵过程中的微生物组成复杂,包括米曲霉、乳酸菌、细菌、酵母菌等,其中米曲霉是酱油酿造过程的关键起始菌株。现代酱油酿造多采用商业化的米曲霉曲精制曲,米曲霉在曲料上充分生长发育,产生酱油发酵所需要的中性及酸性蛋白酶类、氨肽酶、淀粉酶、糖化酶、纤维素酶等。多年以来,对米曲霉酶活力的研究主要围绕中性和酸性蛋白酶展开,而对其它酶的研究较少,这是因为国标GB/T 18186-2000《酿造酱油》中酱油等级的划分主要取决于氨基酸态氮含量。Lin 等[2]研究了米曲霉的木聚糖酶酶系,发现具有Xyl-1 和Xyl-2 酶切位点的木聚糖酶与鲜味氨基酸含量呈正相关。Zhao 等[3]研究发现蛋白酶和淀粉酶具有协同关系,能促进醇类、酸类、酯类、醛类、呋喃类、吡嗪类等香气物质的形成及释放。这些研究均表明,除蛋白酶外,米曲霉的酶系组成对酱油风味的形成具有非常重要的影响。
本文在前期对商业米曲霉性质调研的基础上,选取2 株酶系差异较大的商业化米曲霉菌株进行酱油发酵,其中1 株具有较高的分解蛋白类酶活力,另一株偏重分解碳水化合物类物质,研究其对酱油发酵过程中理化指标变化及产品滋味品质的影响,初步探究酶系组成特点与酱油风味形成的关系。
1 材料与方法
1.1 材料与设备
1.1.1 材料与试剂 大豆,黑龙江意念食品有限公司;面粉,五得利集团兴化面粉有限公司;麸皮,辛集市福之源面业有限公司;SWJS-AO-K 和SWJS-AO-D 是两株商业推广较好的米曲霉,分别购于山东和河北企业。
孟加拉红培养基,广州环凯微生物科技有限公司;酪氨酸、葡萄糖、木糖、果糖、羧甲基纤维素、淀粉等(分析纯级),上海伯奥生物科技有限公司;无水乙醇、浓硫酸、氢氧化钠、钨酸钠、钼酸钠、磷酸、硫酸锂、溴水、3,5-二硝基水杨酸、酒石酸钾钠、苯酚等(分析纯级),国药集团化学试剂有限公司;一次性无菌平板,扬州市创新医疗器械有限公司。
1.1.2 仪器与设备 恒温培养箱、恒温水浴锅,上海一恒科学仪器有限公司;AIRTECH 无菌操作台,苏净安泰空气技术有限公司;OPTEC 电子显微镜,重庆奥特光学仪器有限公司;LDZX-30KBS立式压力蒸汽灭菌器,上海申安医疗器械厂;ZXJP-A1430 霉菌培养箱,上海智城分析仪器制造有限公司;酱油桶,实验室自制不锈钢桶[4];紫外分光光度计,上海佑科仪器仪表有限公司;PHS-25数显pH 计,上海精密科学仪器有限公司;Thermo酶标仪、气相色谱-质谱联仪,美国赛默飞世尔公司;KND-2C 定氮仪,上海新嘉电子有限公司;MembraPure 氨基酸分析仪A300,德国默普尔公司;Insent 电子舌,日本Insent 公司。
1.2 试验方法
1.2.1 米曲霉平板及镜检生长、孢子计数
1)米曲霉平板生长 称取曲精0.0100 g,放入250 mL 三角烧瓶中,加入100 mL 超纯水和磁力搅拌转子,转动5 min 使之充分混匀,得到悬浮液后稀释成不同梯度。在无菌操作环境下,倾倒15~20 mL 孟加拉红培养基于无菌平板中,待凝固后,取合适稀释梯度的曲霉液0.20 mL 于平板上,倒置于28℃暗箱培养72~96 h。
2)米曲霉镜检 参考微生物观察试验的载玻片培养观察法。为更好区分差异,延长培养时间至96 h。
3)孢子计数 米曲霉血球计数板法计数参考发酵调味品微生物检定规程。
1.2.2 大曲制备及高盐稀态酱油发酵[5-6]
1)制曲 取2 kg 干大豆泡水约8 h 后于125℃高压灭菌锅蒸煮15 min。将面粉与熟大豆按质量比1∶4 比例混合,其中添加质量分数为0.5%曲精,三者拌曲均匀后置入霉菌培养箱中。初始培养条件为30℃,湿度95%.培养15 h 进行第1 次翻曲;22 h 后进行第2 次翻曲。培养38 h 后湿度降为90%,40 h 后湿度降为75%,42 h 后湿度降为70%,44 h 出曲即为成曲。成曲样品粉碎后于-4℃和-18℃各保存1 份,用于酶活力测定。
2)酱醪发酵 将成曲与盐水按照料液比1∶2.2 比例混匀,置入酱油发酵桶内。日晒夜露过程中,在1,5,15,30,60,110 d 淋油取样,置于-18℃冰箱中保存。所有样品过滤后备用分析。
1.2.3 成曲酶系活力分析 中性蛋白酶活力的测定参考国标GB/T 28715-2012《饲料添加剂酸性、中性蛋白酶活力的测定 分光光度法》。称取2.50 g 成曲,加入约50 mL pH 7.5 的磷酸盐缓冲液,在150 r/min,40℃条件下恒温振荡60 min,过滤并定容至250 mL。根据国标方法准确反应10 min 后过滤,将滤液与5.00 mL Na2CO3溶液及1.00 mL 福林酚试剂混匀,于40℃保温20 min 后测量波长680 nm 处的吸光度值并计算。中性蛋白酶活力单位U/g 定义为1 g 干重的大曲在40℃,pH 7.5 条件下水解酪蛋白每分钟产生1 μg 酪氨酸的量。
酸性蛋白酶活力的测定参考国标GB/T 28715-2012《饲料添加剂酸性、中性蛋白酶活力的测定 分光光度法》。具体操作等同于上述中性蛋白酶活力测定方法,仅将缓冲液替换成pH 3.0 的乳酸缓冲液。酸性蛋白酶活力单位U/g 定义为1 g 干重的大曲在40℃,pH 3.0 条件下水解酪蛋白每分钟产生1 μg 酪氨酸的量。
糖化酶活力的测定参考Chen 等[7]方法。称取2.50 g 大曲浸没于50 mL pH 4.6 的醋酸-醋酸钠缓冲溶液中,并在150 r/min,40℃条件下恒温振荡60 min 后,过滤并定容至250 mL。在40℃恒温水浴条件下,取糖化酶提取液与可溶性淀粉溶液反应30 min 后,加入NaOH 终止反应,取反应终止液与3,5-二硝基水杨酸(DNS)沸水浴5 min,测量波长540 nm 处的吸光度值。糖化酶活力单位U/g 定义为1 g 干重的大曲在40℃,pH 4.6 条件下每小时产生1 mg 葡萄糖的量。
淀粉酶活力的测定参考DB13/T 1095-2009《饲料用酶制剂中α-淀粉酶活力的测定 分光光度法》。称取2.50 g 大曲浸没于50 mL pH 6.0 的磷酸-柠檬酸盐缓冲溶液中,并在40℃条件下振荡60 min 后,过滤定容至250 mL。在60℃恒温水浴条件下,酶提取液、可溶性淀粉溶液、缓冲液定时反应5 min,随后加入0.5 mL 0.1 mol/L HCl 终止反应,再加入2.5 mL 稀碘液涡旋混匀后,测量波长660 nm 处的吸光度值。淀粉酶活力单位U/g定义为1 g 干重的大曲在60℃,pH 6.0 条件下每小时液化1 g 可溶性淀粉的量。
葡萄糖苷酶活力的测定参考GB 5009.7-2016《食品安全国家标准 食品中还原糖的测定》。称取2.50 g 大曲浸没于50 mL pH 4.6 的醋酸-醋酸钠缓冲溶液中,并在40℃条件下振荡60 min后,过滤并定容至250 mL。在50℃恒温水浴条件下,取葡萄糖苷酶提取液30 μL 与270 μL 0.15%对硝基苯葡萄糖苷(p-Nitrophenol-Glucoside,p-NPG)溶液定时反应10 min,随后加入600 μL Na2CO3终止反应,采用酶标仪测量波长410 nm 处的吸光度值。葡萄糖苷酶活力单位U/g 定义为1 g 干重的大曲在50℃,pH 4.6 条件下降解p-NPG溶液每分钟产生1 μmol 对硝基苯(p-Nitrophenol,p-NP)的量。
木聚糖酶活力的测定参考GB/T 23874-2009《饲料添加剂木聚糖酶活力的测定方法 分光光度法》。称取2.50 g 大曲浸没于50 mL pH 5.5 的醋酸-醋酸钠缓冲溶液中,并在150 r/min,40℃条件下恒温振荡60 min 后,过滤并定容至250 mL。在37℃恒温水浴条件下,取木聚糖酶提取液与木聚糖溶液定时反应30 min,随后加入DNS 并沸水浴5 min,测量显色混合液在波长540 nm 处的吸光度值。木聚糖酶活力单位U/g 定义为1 g 干重的大曲在40℃,pH 5.5 条件下每分钟降解木聚糖产生1 μmol 木糖的量。
纤维素酶活力的测定参考GB/T 23874-2009《饲料添加剂木聚糖酶活力的测定方法 分光光度法》。除用羧甲基纤维素反应底物代替木聚糖底物外,具体操作等同于上述木聚糖酶活力测定方法。纤维素酶活力单位U/g 定义为1 g 干重的大曲在40℃,pH 5.5 条件下每分钟降解羧甲基纤维素产生1 μmol 葡萄糖的量。
果胶酶活力的测定参考GB 5009.7-2016《食品安全国家标准 食品中还原糖的测定》。取2.50 g 大曲浸没于50 mL pH 3.5 的柠檬酸盐缓冲溶液中,并在150 r/min,40℃条件下恒温振荡60 min后,过滤并定容至250 mL。在48℃恒温水浴条件下,取果胶酶提取液、缓冲液与果胶溶液以1∶4∶1比例混合,反应30 min,随后沸水浴5 min 终止反应。取反应终止液与DNS 涡旋混匀,沸水浴5 min后,用紫外-分光光度计测量波长540 nm 处的吸光值。果胶酶活力单位U/g 定义为1 g 干重的大曲在48℃,pH 3.5 条件下降解果胶每分钟产生1 mg D-半乳糖醛酸的量。
氨肽酶活力的测定参考雷芬芬[8]的方法。称取2.50 g 大曲浸没于50 mL pH 8.0 的Tris 缓冲溶液(Trimethylolamine)中,并在40℃条件下振荡60 min 后,过滤并定容。在40℃恒温条件下,取氨肽酶提取液90 μL 与亮氨酸对硝基苯胺溶液10 μL在96 孔板定时反应10 min,随后加入100 μL 无水乙醇终止反应。用酶标仪测量波长405 nm 处的吸光度值。氨肽酶活力单位U/g 定义为1 g 干重的大曲在在40℃,pH 8.0 的条件下每分钟水解L-亮氨酸-对硝基苯胺生成1 μmol 4-硝基苯胺的量。
1.2.4 酱油的理化指标分析 总氮测定参考国标GB 5009.5-2010《食品安全国家标准 食品中蛋白质的测定》中的微量凯氏定氮法;还原糖测定参考国标GB 5009.7-2016《食品安全国家标准 食品中还原糖的测定》中的DNS 法;pH 值采用pH 计测定。
美拉德反应产物测定参考文献[9]。将酱油样品过0.45 μm 微滤膜后,测定波长294 nm 处100倍稀释样品的吸光度值,作为中间产物的指标;测定波长420 nm 处10 倍稀释样品的吸光度值,作为终止产物的指标。
游离氨基酸测定参考文献[7]。取4 mL 酱油加入1 mL 15%磺基水杨酸混匀,1 h 后以10 000 r/min 离心15 min 除去蛋白沉淀,取上清液于10 000 r/min 再次离心15 min 后,取第2 次离心上清液稀释N 倍,上清液过0.22 μm 微滤膜后进氨基酸分析仪。
1.2.5 酱油的风味品质分析 酱油滋味特征采用日本Insent 电子舌分析,试验依照标准操作进行。首先将电子舌滋味电极浸泡于参比溶液中活化24 h 备用。同时准备电子舌正、负极清洗溶液和30 倍稀释酱油样品。电子舌对酱油滋味进行4 次评定,最后取平均值。各样品测定之间,电极需浸入相应清洗液进行清洗。
1.2.6 数据分析本文采用SPSS 22.0 及Microsoft Office 2017 进行数据分析,数据表示为“平均值±标准差”,进行ANOVA 差异性分析,符号“a,b”表示同一行数据具有显著性差异(P<0.05)。
2 结果讨论
2.1 米曲霉平板及镜检结果分析
2 株米曲霉的平板生长形态及显微镜观察结果如图1所示。为更好地区分两者差异,延长培养时间至96 h。SWJS-AO-K 形态特点为白色菌丝以中心向四周辐射生长,绿色孢子主要着生在中环,中心和四周仍为白色菌丝体,处于生长状态。SWJS-AO-D 的平板表面基本看不到白色菌丝体,均已经着生米曲霉孢子,且颜色相对米曲霉SWJS-AO-K 偏黄色。对比显微镜观察结果发现,与SWJS-AO-K 相比,SWJS-AO-D 的孢子生长更为旺盛,同等视野下孢子头更多,与平板培养观察结果一致。此外,SWJS-AO-D 菌丝孢子头相对更为饱满、充盈,表明该菌产孢子能力相对较强。有研究表明,黄色孢子菌株蛋白酶活力低,绿色孢子菌株蛋白酶活力高[10],这与本研究结果相符,即产绿色孢子的SWJS-AO-K 菌种相较产黄色孢子的SWJS-AO-D 菌种,具有更高的中性蛋白酶、酸性蛋白酶、氨肽酶等蛋白类酶活力。
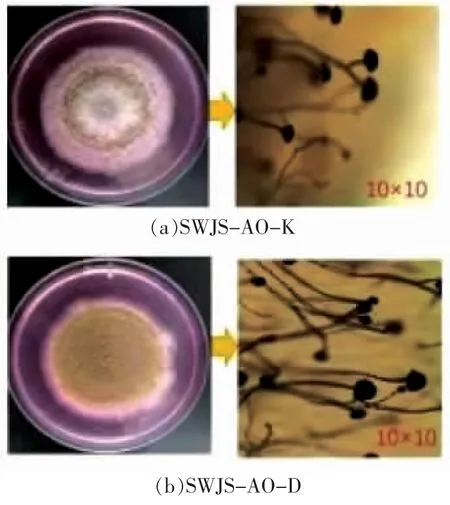
图1 2 株米曲霉的平板及显微镜形态观察Fig.1 Morphology and microscopic observation of two strains of Aspergillus oryzae
2.2 成曲酶活力差异
分别采用2 株米曲霉制作酱油大曲,成曲酶系如表1所示。结果表明,SWJS-AO-K 成曲的中性蛋白酶、酸性蛋白酶、氨肽酶酶活力显著高于SWJS-AO-D 成曲(P<0.05),分别达到了3 035,744 U/g 和9.37 U/g,为SWJS-AO-D 成曲中相应酶活力的2.2,2.6 和4.4 倍。然而,SWJS-AO-D 成曲中糖化酶、淀粉酶、葡萄糖苷酶、木聚糖酶、纤维素酶等分解碳水化合物类酶活力明显优于SWJSAO-K 成曲,其中糖化酶、淀粉酶、纤维素酶具有显著性差异,分别为SWJS-AO-K 成曲相应酶活力的1.8,1.1 和1.3 倍。徐宁等[11]定义酶活力及对应报道值与本文酶活力测定结果相符。整体表明,SWJS-AO-K 代表高蛋白质分解能力的菌株类型,而SWJS-AO-D 代表高碳水化合物分解能力的菌株类型。
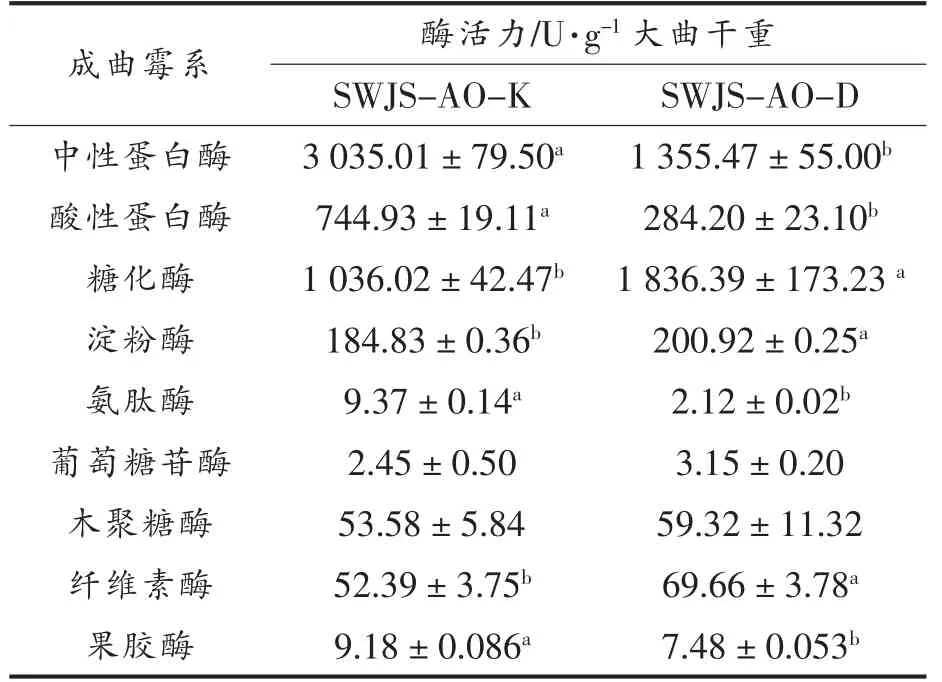
表1 2 株米曲霉酱油成曲酶系分析Table 1 Comparison of enzyme profiles of matured koji of two strains of Aspergillus oryzae
SWJS-AO-K 与SWJS-AO-D 具有不同优势的酶系特征,不同酶系的活力存在明显差异。具有高蛋白质分解酶活力的菌株SWJS-AO-K,将有可能在发酵过程中生成更为丰富的多肽及氨基酸,从而提高原料蛋白质的利用率和酱油的鲜味品质,这也是一直以来米曲霉菌种筛选的主流导向[3]。糖化酶、淀粉酶、葡萄糖苷酶等分解碳水化合物酶类则可能与酱油风味品质联系更为密切,分解生成的还原糖是美拉德反应的重要前体物质,也是促使酱醪发酵过程中酵母菌生长的营养物质[12-13]。此外,SWJS-AO-D 中优势的木聚糖酶、纤维素酶等细胞破壁酶,能够分解植物细胞壁,促进酱油发酵过程中营养物质的溶出。
2.3 酱油发酵过程中理化指标的测定
2 株米曲霉发酵酱油理化指标的变化如图2所示,包括总氮含量、还原糖含量、pH 值及美拉德反应产物分析。
如图2a所示,总氮含量在发酵过程中一直呈增长趋势。相对整个变化过程,前5 d 的变化最大,占据总变化量的60%和76%。两者之间,SWJS-AO-D 总氮含量在前30 d 相对SWJS-AOK 有略微优势。发酵30 d 为转折点,SWJS-AO-D后期总氮含量上升较为平缓,而SWJS-AO-K 总氮含量则继续保持较高增长,最终超过了SWJSAO-D,终点的总氮含量分别为1.33 g/100 mL 和1.15 g/100 mL,该结果与SWJS-AO-K 菌种的高蛋白酶系活力特征相符[14]。
如图2b所示,还原糖含量在发酵过程前段均呈上升趋势,然而后期变化趋势不一致。SWJSAO-K 在发酵30 d 后出现下降,从1.41 g/100 mL(30 d)下降到1.15 g/100 mL(110 d),而SWJSAO-D 则一直保持上升趋势,最终达到2.08 g/100 mL。此外,2 菌株成曲发酵阶段初期(1 d),还原糖含量也有显著差异(P<0.05),SWJS-AO-D 还原糖含量为1.08 g/100 mL,是SWJS-AO-K(0.16 g/100 mL)的6.8 倍,这可能是因为菌种SWJS-AOD 的糖化酶、淀粉酶、纤维素酶等酶活力都比较高,所以成曲中细胞壁、糖类物质降解较为充分,不仅积累了大量的还原糖,而且其释放更为迅速。较高的降解碳水化合物类酶活也保证了还原糖在酱醪发酵过程中的持续增长,释放量大于美拉德反应及微生物生长的消耗量,因此呈现增长趋势。许瑜[15]在研究中发现还原糖含量在发酵酱油后期具有降低趋势,仅与本研究中SWJS-AO-K 发酵趋势一致,推测该类还原糖变化的主流研究可能多以高蛋白酶活力菌种为主。
如图2c所示,酱油发酵过程中酸度变化较为一致,均呈现下降趋势,下降数值在0.48~0.53 左右。然而,SWJS-AO-K 酱油发酵过程中pH 值变化一直比SWJS-AO-D 低0.4 左右,可能与SWJSAO-K 酱油中所产生的酸类物质有关。
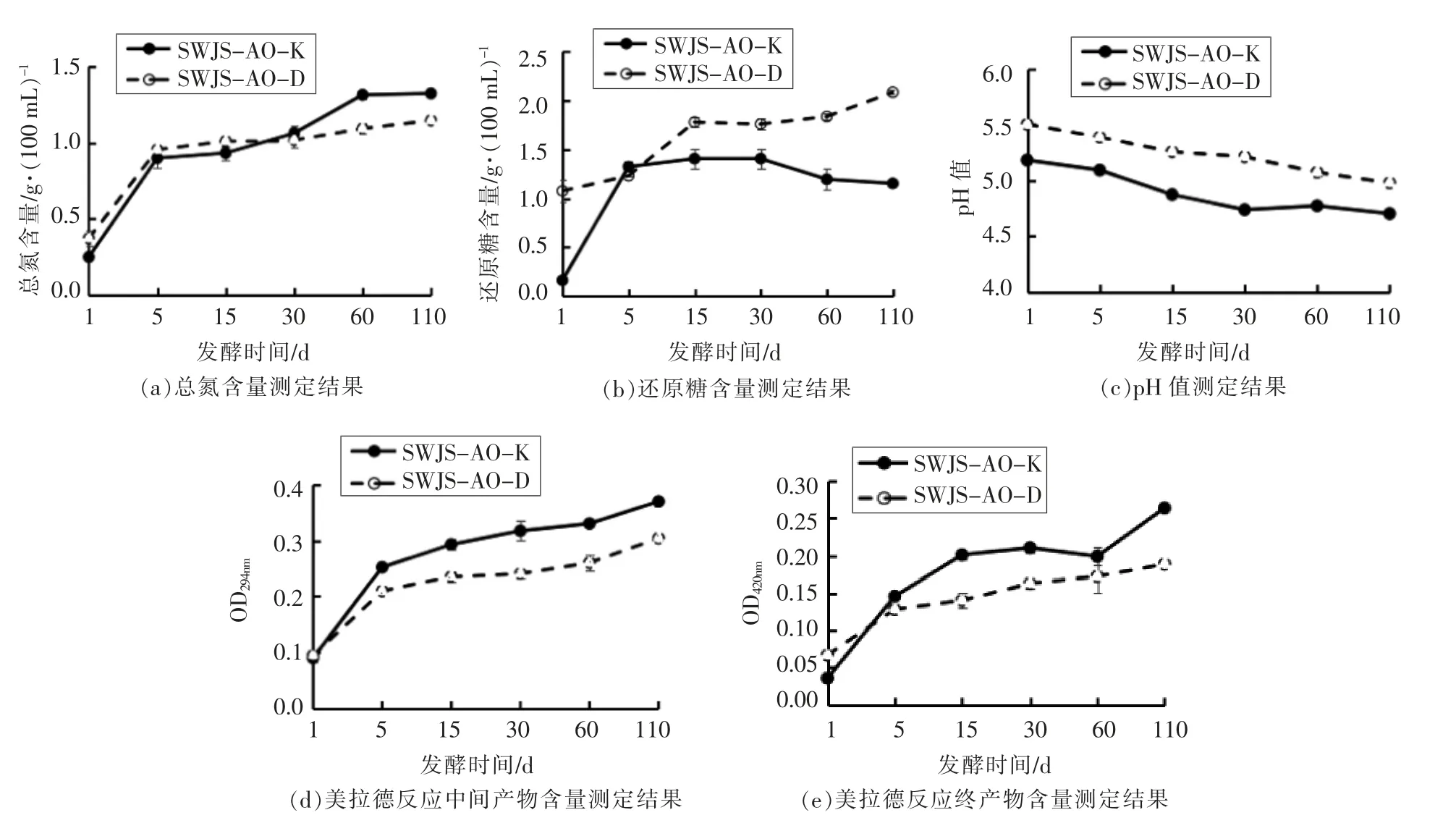
图2 2 株米曲霉酱油发酵过程中理化指标的变化Fig.2 Changes of physical and chemical indicators during the soy sauce fermentation process fermented by two strains of Aspergillus oryzae
由图2d 和图2e 可知,美拉德反应中间产物(OD294nm)和终产物(OD420nm)的吸光值均呈现上升趋势,前15 d 增加明显,后期缓慢上升,且SWJSAO-K 酱油吸光度基本整体高于SWJS-AO-D,这表明SWJS-AO-K 酱油发酵过程中美拉德反应程度相比SWJS-AO-D 更深,美拉德反应消耗更多的氨基酸与还原糖,因此这可能是SWJS-AO-K发酵酱油中还原糖含量后期下降的部分原因。营养物质的释放与消耗均处于一个动态平衡之中。一方面,还原糖含量偏少与对应酶系降解生成速度较慢有关,另一方面也可能与还原糖的消耗较高有联系。
2.4 酱油游离氨基酸测定及分析
发酵酱油的游离氨基酸组成是决定酱油品质好坏的重要因素。2 株米曲霉发酵酱油的游离氨基酸结果如表2所示,其中鲜味氨基酸(Asp,Glu)占23.25%~25.23%,甜味氨基酸(Ser,Gly,Thr,Ala)占19.79%~21.27%,甜苦味氨基酸(Pro,Lys)占11.53%~12.35%,苦味氨基酸(His,Val,Tyr,Met,Arg,Ile,Leu,Phe)占40.82%~45.12%,无味氨基酸(Cys)占0.32%~0.33%,测定结果符合文献报道范围[16]。整体而言,两者氨基酸总量差异不大,分别为2 693.70 mg/100 mL 和2 609.10 mg/100 mL,然而氨基酸组成具有一定差异。SWJS-AO-D的鲜、甜味氨基酸含量更高,鲜味和甜味氨基酸的总量分别比SWJS-AO-K 高了5.14%和4.10%,而SWJS-AO-K 的苦味氨基酸比SWJS-AO-D 高出10.53%。由此可推测,SWJS-AO-D 样品可能具有更强烈的鲜甜味特征。

表2 2 株米曲霉发酵酱油的游离氨基酸组成Table 2 The free amino acids profiles of soy sauce fermented by two strains of Aspergillus oryzae
2.5 酱油电子舌滋味测定及分析
2 株米曲霉发酵90 d 酱油电子舌滋味测定的结果如表3所示,分别测定酱油的酸味、苦味、鲜味、咸味和甜味。结果表明,SWJS-AO-D 发酵的酱油在鲜味、甜味上略高于SWJS-AO-K 发酵的酱油。而SWJS-AO-K 发酵的酱油酸味、苦味和咸味得分值分别要比SWJS-AO-D 发酵的酱油高10.06,0.49,1.01。该结果与酸度测定及氨基酸组成结果分析相符。

表3 2 株米曲霉发酵的酱油的电子舌滋味测定Table 3 Electronic tongue measurement of soy sauce fermented by two strains of Aspergillus oryzae
筛选具有高活力蛋白酶类的米曲霉是一直以来的研究热点,蛋白酶系活力高有利于发酵生成丰富的多肽及氨基酸,从而提高原料的蛋白利用率和酱油的鲜味品质。本研究中,SWJS-AO-K 发酵的酱油在鲜味氨基酸含量及鲜味评分中并未表现出优势,虽然游离氨基酸总量相比SWJS-AO-D发酵的酱油有所提高,但滋味上反而是其酸味、苦味、咸味较高。反之,SWJS-AO-D 发酵的酱油甜味和鲜味得分较高,这与酱油中还原糖、天冬氨酸和谷氨酸等含量丰富的结果相符,也可能与糖肽的生成带来的鲜味提升效果有关[17]。该结果表明,一味的追求高蛋白酶系活力菌株,并不一定能定向富集酱油的鲜味物质,酱油鲜味的提升可能与碳水化合物水解酶类具有密切联系,这与本团队前期一份研究结果相符。
3 结论
通过对比研究SWJS-AO-K(高蛋白酶类活力)和SWJS-AO-D(高碳水化合物水解酶类活力)在高盐稀态酱油中的发酵情况,发现高蛋白酶系活力菌株SWJS-AO-K 能够提升发酵酱油的美拉德反应程度,而具有高活力碳水化合物水解酶类的SWJS-AO-D 发酵酱油具有较高的还原糖含量、鲜味氨基酸及甜味氨基酸含量,分别比SWJSAO-K 发酵的酱油高出80.80%,5.14%和4.10%,这使SWJS-AO-D 发酵酱油相较SWJS-AO-K 在鲜味和甜味上更具优势。整体而言,具有碳水化合物水解酶类活力优势的米曲霉对发酵酱油的鲜味、甜味物质生成具有积极影响,能够提高酱油产品的风味特性,这与市场上一直以来侧重高蛋白酶活力的米曲霉基础导向有所不同。本论文将对今后差异化的米曲霉筛选育种及发酵应用提供重要理论参考。
