乳酸菌强化技术降低黄酒浸米过程生物胺的积累
2021-06-07刘彩霞刘双平徐岳正周建弟余永建
刘彩霞,刘双平,,3,徐岳正,周建弟,余永建,毛 健,,3*
(1 江南大学食品学院 粮食发酵工艺与技术国家工程实验室 江苏无锡214122 2 浙江古越龙山绍兴酒股份有限公司 国家黄酒工程技术研究中心 浙江绍兴312000 3 江苏省产业技术研究院 江南大学如皋食品生物技术研究所 江苏南通226500 4 江苏恒顺醋业股份有限公司 江苏镇江212043)
生物胺是一类低分子碱性化合物的总称,广泛存在于发酵食品中。适量的生物胺对人体的各项生理机能有调节作用,浓度过高则会引起头疼、呕吐、眩晕等不适感[1-2]。黄酒作为中国传统发酵食品的典型代表,生物胺质量浓度普遍较高,平均可达到115 mg/L[3-4],远远高于啤酒(4.79 mg/L)与葡萄酒(11.24 mg/L)[5]。有研究表明,酒类饮品中生物胺含量过高是饮后“上头”的主要原因之一[6-7]。
黄酒主要经浸米、蒸饭、发酵和陈酿等环节酿制而成,其中生物胺的形成主要集中于浸米与发酵阶段[8-9]。目前现有的控制黄酒中生物胺含量的手段主要针对于发酵阶段,如向发酵过程中添加具有降解生物胺能力的微生物或者对黄酒酵母进行基因改造达到降低黄酒中生物胺含量的目的[10-12]。魏晓璐[13]的研究发现,浸米环节产生的生物胺越多,最终黄酒中生物胺的含量越高。这说明控制浸米环节生物胺的积累是降低黄酒生物胺含量的一个有效途径,然而目前对浸米过程中生物胺来源及调控工艺的研究较少。
黄酒浸米过程中微生物大量繁殖并产酸,为后续的发酵过程提供酸性环境,抑制杂菌生长,保证酵母正常代谢[14-15]。虽然有研究称浸米水中存在较多乳酸菌[16],但是浸米过程中微生物的群落结构组成尚不十分明确。通过高通量测序技术解析浸米过程中的微生物群落构成,对于确认生物胺来源和优化浸米微生物组成均有重要价值。在浸米微生物强化过程中,除了考虑生物胺浓度控制外,为保障应用效果和生长优势,必须确保微生物具有较高的产酸性能和生长性能,因此筛选具有高产酸能力、高生长速率、能降解生物胺的乳酸菌,是确保微生物强化浸米效果的关键。本研究基于对浸米水微生物群落结构的解析,筛得具有降解生物胺功能且在浸米水中有种群优势的乳杆菌属微生物,采用生物强化技术将其应用于浸米过程,以大幅降低黄酒浸米过程中生物胺的积累。
1 材料与方法
1.1 材料
1.1.1 试验材料
3 种浸米水样品(A,B,C)于2018年11月采集自绍兴某黄酒厂,所有样品均为随机选取,样品生物胺含量(299 ±1.66)mg/L,总酸含量(9.23 ±0.12)g/L。
明登乳杆菌(Lactobacillus mindensis)ML4(分离自浸米水),植物乳杆菌(Lactobacillus plantarum)14-2-1[25]和干酪乳杆菌(Lactobacillus casei)X12(分离自黄酒发酵醪),均为本实验室分离、保藏菌株。
1.1.2 仪器与试剂 聚合酶链式反应仪,美国Life Technologies 公司;Universal Hood II 凝胶成像系统,美国Bio-RAD 公司;Agilent 1100 型高效液相色谱仪,美国安捷伦公司;超净工作台,苏州安泰空气技术有限公司;隔水恒温培养箱,上海智城分析仪器制造有限公司。
DNA Marker、蛋白酶K,宝生物工程(大连)有限公司;2×Taq PCR MasterMix,杭州宝赛生物科技有限公司;生物胺标椎品、丹磺酰氯、乙腈(分析纯级),上海阿拉丁生化科技股份有限公司;乙醚、丙酮(分析纯级)等其它试剂,国药集团化学试剂有限公司。
1.1.3 培养基
1)MRS 培养基MRS 培养基参照文献[17]配制。
2)生物胺降解检测培养基(MRSBA) 以液体MRS 培养基(1 L)为基础,添加组胺、酪胺、尸胺、腐胺各0.05 g,调节pH 值为5.3~5.5。
3)大米糖化液培养基[13]按m米饭∶m麦芽汁∶V水=5∶1∶20 比例混合,加入适量麦曲、液化酶、糖化酶,60℃保温糖化3.5 h,调整外观糖度为12 °Brix。
1.2 方法
1.2.1 高通量测序分析浸米水中的细菌群落结构采用SDS-CTAB 法提取浸米水样品的基因组DNA,参考文献[18]和[19]并略有改动。将5 mL 浸米水样品12 000 r/min 离心10 min,收集沉淀,加入0.5 mL ddH2O 混悬后转移至2 mL EP 管中;加入10 μL 溶菌酶(50 mg/mL),37℃条件下放置30 min;加入125 μL 10% SDS,立即加入5 μL 蛋白酶K(20 mg/mL),混均后于65℃水浴1 h(每隔10 min 上下颠倒混均样品);加入700 μL CTAB 缓冲液,混均后于65℃水浴1 h;12 000 r/min 离心10 min,取上清液。DNA 纯化方法参照文献[20]。将提取的基因组DNA 送至北京诺禾致源有限公司,对其16S V3-V4 高变区进行扩增并测序。数据质控后,利用Blast 将代表性操作分类单元(OTU)序列与NCBI 中16S rRNA 基因序列进行比对,确定OUT 序列的物种信息。
1.2.2 不产且降解生物胺乳酸菌生长代谢特性分析 将菌株于固体MRS 培养基活化后,转接到液体MRS 培养基中,37℃培养24 h,传代2 次(菌液浓度达到108~1010CFU/mL)。将活化好的菌液转接到MRSBA 培养基中(接种量1%),37℃条件下培养48 h。采用高效液相色谱法测定培养基中生物胺的含量,最终确定不同菌株对生物胺的降解率(以不接种乳酸菌的MRSBA 空白培养基为对照)。
将菌株于液体MRS 培养基活化,传至第3 代时每隔2 h 取样测定培养基OD600nm值和pH 值,比较分析不同乳酸菌的生长和产酸能力。将活化好的乳酸菌于不同pH 值的液体MRS 培养基中培养24 h,pH 值分别为3.5,4.0,4.5,5.0,5.5,6.0,6.5,7.0,8.0,并通过测定在不同pH 值下的OD600nm值,最终确定pH 值对乳酸菌生长的影响。
1.2.3 筛选菌株在浸米中的应用及效果测定 将筛得的菌株于固体MRS 培养基活化后,转接至液体MRS 培养基中,于37℃条件下培养24 h,传代2 次。当菌液浓度达到108~1010CFU/mL 时,以1%的接种量转接到大米糖化液中,培养36~48 h,当菌液浓度达到106~107CFU/mL 时,将此大米糖化液分别以0%,2.5%,5%,7.5%,10%的接种比例接种至浸米体系中(米水比为1∶1.2,接种比例以大米为基准),浸泡120 h。测定浸米水中总酸和生物胺的质量浓度,并对浸米水的微生物进行高通量测序分析。
1.2.4 指标测定采用HPLC 测定生物胺的质量浓度[13];pH 值和总酸的测定参照国标GB/T 13662-2018《黄酒》进行。
2 结果与分析
2.1 浸米水中细菌α多样性及其群落结构组成
对采集自工厂的3 个浸米水样品A、B 和C进行测序分析,共获得240 179 条有效序列,序列平均长度424 bp,与16S rRNA V3-V4 区序列长度基本一致。按照97%的相似度进行OTU 分类,共划分了136 个OUT。浸米水样本的Ace、Chao1、Shannon、Simpson、Coverage 等统计学分析结果见表1。Coverage 值均为100%,表明测序深度已覆盖到测试样品的绝大部分物种,可以满足样品中细菌多样性分析的需要。浸米水样品的Chao1 和Ace 指数无明显差异,Shannon 指数与Simpson 指数分别在3 与0.8 左右,表明浸米水中微生物种类丰富、多样性较高。
根据各样品OTU 分类结果进行物种注释,发现3 个浸米水样品中的微生物均属于厚壁菌门。如图1a所示,浸米水中微生物主要包括乳杆菌属(Lactobacillus,98.45%)、片球菌属(Pediococcu,0.13%)、假单胞菌属(Pseudomonas,0.13%)、链球菌属(Streptococcus,0.10%)、泛菌属(Pantoea,0.09%)等,其中乳杆菌属占比最高,在3 个样本的平均相对丰度达高98%以上,是浸米水中的优势微生物。进一步分析浸米水中微生物种水平群落结构组成,结果如图1b 表示。在种水平上,香肠乳杆菌(Lactobacillus farciminis,14.38%)、瑞士乳杆菌(Lactobacillus helveticus,23.98%)、桥乳杆菌(Lactobacillus pontis,25.16%)、发酵乳杆菌(Lactobacillus fermentum,18.06%)和戊糖乳杆菌(Lactobacillus pentosus,6.59%)为优势物种,相对丰度大于5%。棒状乳杆菌(Lactobacillus coryniformis)、面包乳杆菌(Lactobacillus panis)、老面乳杆菌(Lactobacillus zymae)、美洲虎乳杆菌(Lactobacillus pantheris)、植物乳杆菌(L.plantarum)等物种的相对丰度均小于2%。
由分析测序结果可知,浸米水中形成了以乳酸菌为主导,乳杆菌占绝对优势的微生物区系,并且乳杆菌属内物种多样。研究表明,部分乳杆菌具有产生物胺的能力[21]。有学者研究了15 个乳杆菌属物种的生物胺代谢情况,发现其中存在12 个乳杆菌属物种含有产生物胺相关基因并且能够表达[22]。也有报道分析了分离自浸米水和黄酒发酵醪中的微生物生物胺代谢能力,发现超过75%的产生物胺菌株为乳杆菌[23-24],可能是由于浸米水中存在具有潜在代谢生物胺能力的乳杆菌导致浸米过程中生物胺大量积累。然而,也有研究发现由于乳酸菌的遗传多样性以及株间特异性,黄酒酿造过程中也存在许多不产且可降解生物胺的乳酸菌。Xia 等[10]以及Niu 等[11]分别探究了不产生物胺的植物乳杆菌ACBC271 以及具有降解生物胺功能的植物乳杆菌CAU 3823 和木糖葡萄球菌(Staphylococcus xylosus)CGMCC1.8382 对黄酒发酵过程中生物胺形成的影响,发现将这些菌株用于黄酒发酵能降低黄酒中生物胺的含量。因此,基于对浸米水中微生物群落结构组成的解析和理解,可通过调控浸米水中菌群的结构实现对浸米水中的生物胺含量的控制。筛选具有降解生物胺能力且适用于浸米过程的微生物,并通过生物强化技术将其应用于浸米环节,使其主导浸米水中的微生物区系,从而控制浸米过程中生物胺的形成,达到降低浸米过程生物胺含量的目的。
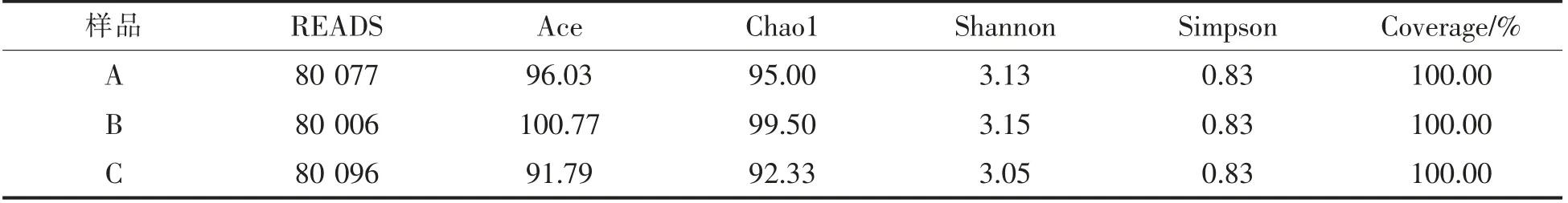
表1 细菌α多样性指数分析Table 1 The analysis of alpha diversity index of bacteria
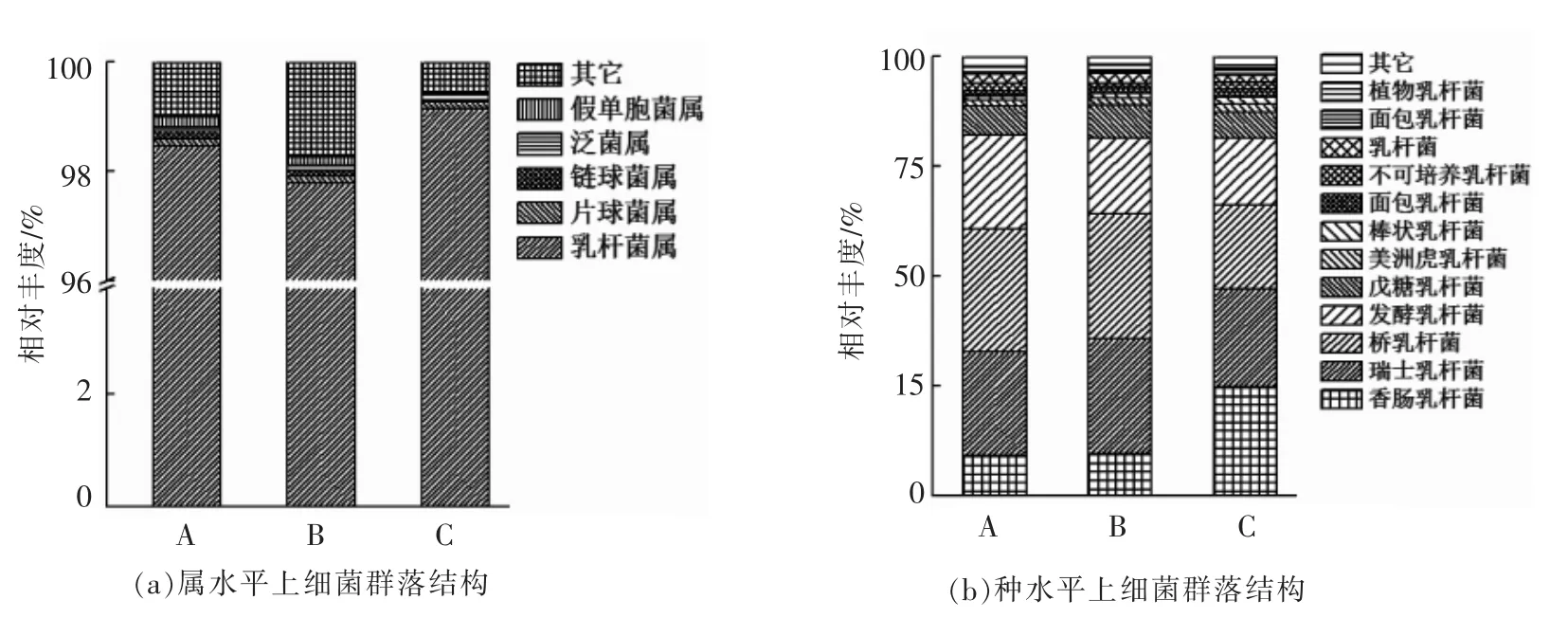
图1 浸米水中细菌群落结构组成Fig.1 Bacterial community structure of rice soaking water
2.2 不产且降解生物胺乳杆菌的生长代谢特性分析
浸米阶段作为黄酒酿造的首要环节对发酵过程有巨大影响。浸米过程中微生物大量产酸,为发酵提供酸性环境,促进酵母生长、保证发酵的顺利进行。因此,采用乳酸菌强化技术降低浸米过程中生物胺的积累,要求向浸米水中添加的微生物需满足生长和产酸能力强、耐低pH 值且具有降解生物胺的功能。本团队前期从黄酒发酵醪以及浸米水中分离得到3 株不产生并且能够降解生物胺的明登乳杆菌ML4、植物乳杆菌14-2-1 和干酪乳杆菌X12。为筛选得到1 株既能够满足浸米需求,同时还可以降低浸米过程中生物胺积累的菌株,分析以上3 株乳杆菌的生物胺降解能力、生长和产酸特性及pH 值耐受性。
浸米过程中产生的生物胺主要为腐胺、尸胺、组胺和酪胺,其中腐胺占比最高,约占生物胺总量的45.54%,尸胺和酪胺次之[3]。3 株乳杆菌对腐胺、尸胺、组胺、酪胺以及总胺的降解能力如图2a所示。菌株14-2-1 对腐胺降解最多,可达到26.88%,菌株ML14 和X12 对腐胺的降解率分别为25.67%和25.69%。尽管菌株ML4、14-2-1 以及X12 对不同生物胺的降解能力有所差异,但综合比较3 株菌对总生物胺含量的降解情况,并未发现明显差异。对3 株乳杆菌的生长特性做进一步的分析发现,菌株14-2-1 的生长能力最强,前4 h 为调整期,生长缓慢,随后迅速进入对数生长期,最终进入平稳期(14 h 后);X12 与ML4 生长能力相近,明显慢于菌株14-2-1 的生长速率(图2b)。如图2c所示,分别接种3 株菌的培养基pH值变化趋势基本一致、差异较小。在4~14 h 内,3株菌的培养基pH 值从6.0 左右迅速下降至3.6左右,之后趋于平稳;然而在6~18 h 内,接种菌株14-2-1 的培养基pH 值下降速率明显快于其它2株菌。3 株乳酸菌在不同pH 值培养基的生长情况如图2d所示。当pH 值在3.5~6 范围内时,菌株14-2-1 的生长速率随着pH 值的升高而增加;当pH>6 时,菌株14-2-1 的生长能力趋于稳定。菌株X12 和M14 的生长速率在pH 3.5~5 范围内随着pH 值的增加而有所提高;然而当pH>5 时,它们的生长能力明显下降。因此可以得出,菌株14-2-1 相较于X12 和M14,对pH 值具有更好的适应性。同时与X12 和M14 相比,菌株14-2-1 在任意pH 值下的生长能力也要更强一些。综合考虑3 株菌的pH 值耐受性、生长和产酸速率以及生物胺降解能力,选择植物乳杆菌14-2-1 为目标菌株。

图2 3 株菌的代谢特性Fig.2 The metabolism properties of three strains
2.3 植物乳杆菌14-2-1 对浸米过程中总酸、菌群结构及生物胺的影响
将接种植物乳杆菌14-2-1 的大米糖化液分别以0%,2.5%,5%,7.5%,10%的接种量接种于浸米水中,其产酸情况如图3a所示。随着浸米时间的增加,浸米水总酸含量呈上升趋势,并且随着乳酸菌接种量的增加,浸米水酸度积累速度也越快。当接种量≥7.5%时,产酸速率明显提高,浸米48 h 即可达到非接种浸米120 h 的酸度效果。浸米过程中在24~96 h 期间内快速增酸,不同接种量浸米水在24~96 h 内的产酸速率如图3b所示,与不接种乳酸菌的浸米水相比,接种植物乳杆菌14-2-1 的浸米水中总酸的增加速率提高了0.70~2.18 g/(L·d)。与其它接种比例相比,当接种量达到7.5%时,浸米水中酸度的增加速率明显加快,达到了4.09 g/(L·d),而与10%接种量【4.37 g/(L·d)】相比无明显差异。综合考虑浸米水的增酸速率以及生产成本,选择7.5%为最佳接种比例。如图3c所示,接种量为7.5%的浸米水中微生物由乳杆菌属(80.01%)、肠杆菌属(Enterobacter,4.93%)、寡养单胞菌属(Stenotrophomonas,4.81%)、泛菌属(Pantoea,3.34%)、不动杆菌属(Acinetobacter,0.98%)等5 个属的微生物组成。浸米水中乳杆菌属的物种丰度最高,主要由植物乳杆菌(79.52%)和发酵乳杆菌(0.39%)等物种组成。与传统浸米相比,接种植物乳杆菌14-2-1 的浸米水中微生物的群落结构发生较大改变,植物乳杆菌的相对丰度由不接种时的0.95%升高至79.52%,形成了以植物乳杆菌为绝对优势的微生物区系。
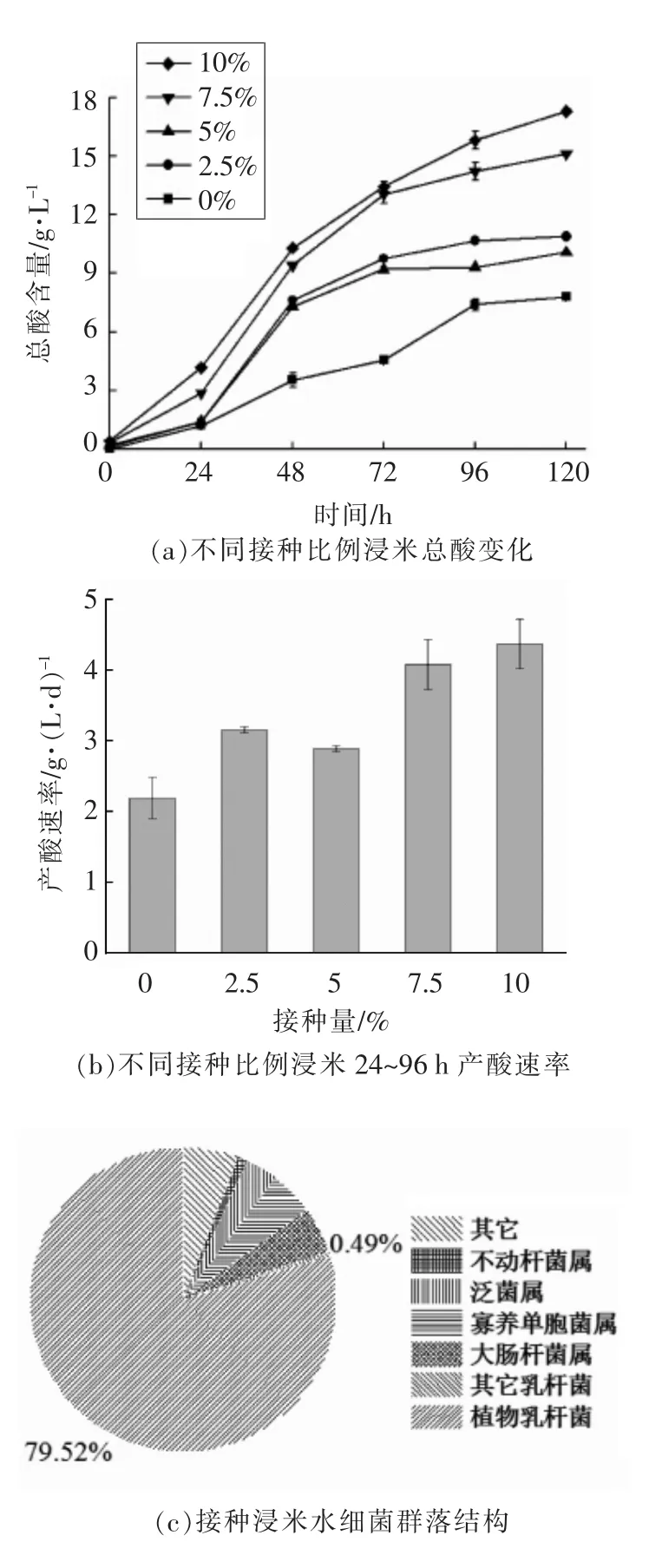
图3 植物乳杆菌14-2-1 对浸米过程影响Fig.3 Influence of L.plantarum 14-2-1 on the rice socking process
接种植物乳杆菌14-2-1 改变了浸米水中微生物群落结构,进一步分析其对浸米水中生物胺含量的影响,结果如表2所示。接种7.5%植物乳杆菌14-2-1 的浸米水中生物胺含量在浸米24 h时,从0 mg/L 增加到2.73 mg/L 左右,之后变化较小;而未接种的浸米水中生物胺含量随着浸米时间的增加而不断升高,浸米结束时达到39.6 mg/L。与未接种的浸米水相比,接种植物乳杆菌14-2-1 使浸米水中生物胺的含量从39.6 mg/L 减少到了2.44 mg/L,生物胺含量降低了93.84%。由此表明,植物乳杆菌在接种浸米过程中发挥较大作用,在提升产酸速率、缩短浸米时间的同时,也使得浸米水中生物胺的含量大幅降低。

表2 浸米过程中生物胺含量变化Table 2 Changes of the content of BAs during rice soaking
3 结论与讨论
本文通过高通量测序技术解析了浸米水中微生物的群落结构组成及物种多样性。浸米过程形成了以乳酸菌为主导,乳杆菌占绝对优势的微生物区系,乳杆菌属内物种多样,且存在较多具有潜在生物胺代谢能力的物种,这可能是导致浸米过程生物胺积累的主要原因。将不产且具有降解生物胺功能的植物乳杆菌14-2-1 应用于浸米过程后,浸米水中形成了以植物乳杆菌占据优势生态位的微生物区系,其相对丰度高达79.52%,同时浸米水中酸度上升速率明显加快,生物胺含量大幅降低。
有研究通过生物强化技术调控发酵过程中生物胺含量,将不产生物胺的植物乳杆菌和具有降胺功能的木糖葡萄球菌应用于黄酒发酵过程,生物胺含量分别降低了11%和25.5%[10]。本团队前期也曾将不产且具有降解生物胺功能的植物乳杆菌14-2-1 应用于发酵阶段,降低了发酵过程中27.16%的生物胺[14]。将该菌应用于浸米过程后,相比非接种浸米,生物胺含量降低93.84%。本团队前期研究表明,浸米过程中生物胺的形成对最终黄酒中生物胺含量影响较大[13],因此控制浸米阶段生物胺的形成是降低黄酒中生物胺含量的一条有效途径。
将植物乳杆菌14-2-1 应用于浸米过程,在大幅降低生物胺的同时,浸米时间也显著缩短。浸米过程中微生物产酸可为黄酒发酵提供酸性环境,保证发酵正常进行。传统浸米过程中浸米水酸度上升速率较慢,浸米时间一般需持续14 d 左右,耗时较长且能耗较大。有研究利用循环浸米的方法缩短浸米时间[25],然而浸米水的循环使用会导致浸米过程中产生物胺的微生物大量繁殖,使浸米水中生物胺不断积累,含量越来越高。本研究基于乳酸菌强化策略,将高产酸且具有降解生物胺功能的植物乳杆菌14-2-1 应用于浸米体系,相比传统浸米,在减少生物胺积累的同时,使浸米时间得到大幅缩短。
利用乳酸菌强化技术改变浸米过程中微生物群落结构组成以控制浸米过程中生物胺形成是一种能有效降低浸米水中生物胺积累的技术方案。菌株植物乳杆菌14-2-1 在浸米过程中高效的产酸和降胺能力为其在工业中的推广应用提供了有力的理论支撑和物质基础。植物乳杆菌14-2-1 以及相关调控策略的进一步工业化应用,将为企业在缩短浸米时间、降低黄酒生物胺含量等方面做出贡献。
