功能糖通过甜味受体信号通路促进GLP-1的分泌
2021-06-07田巧基刘义凤李海枝段盛林
田巧基,夏 凯,刘义凤,潘 聪,李海枝,段盛林
(中国食品发酵工业研究院有限公司 北京100015)
人类对甜味的喜爱是由遗传基因决定的,然而甜味为人类带来愉悦感的同时也带来了诸多健康问题,例如:肥胖、龋齿、胰岛素抵抗(IR),甚至Ⅱ型糖尿病等[1-2]。针对膳食结构中碳水化合物过量,尤其是单糖摄入超标的不良现状,设计开发功能糖,减少单糖的摄入显得尤为重要[3]。
NCI-H716 是1 株人结直肠腺癌细胞,常作为研究GLP-1 分泌及其信号通路的人源肠内分泌L细胞模型,该细胞可表达G 蛋白偶联甜味受体、Gα-味蛋白(Gα-gustducin)和TRPM5 等味觉受体及其下游信号元件[4]。小肠内分泌L 细胞分泌的肠源性激素包括血糖素样肽-1(GLP-1)、血糖素样肽-2(GLP-2)和酪酪肽(PYY)。其中,GLP-1 的作用是刺激胰岛素分泌,抑制胰高血糖素分泌,延缓胃排空并充当肠胃道和回肠“制动机制”的一部分,被称为食欲和摄食的“生理调节器”[5]。GLP-2的作用是刺激肠黏膜生长,抑制肠隐窝细胞凋亡,抑制胃排空和胃酸分泌[6-7]。PYY 的作用是增强饱腹感,抑制食欲[8]。
实验室前期试验表明,人源化酵母模型证明海藻糖、异麦芽酮糖醇、棉籽糖等功能糖通过去糖基化作用回补由糖基化损伤造成的酵母菌生长抑制的现象。人体血糖生成指数(GI)测试结果表明,富含多元功能糖的特膳米属于低GI 食品,适合作为糖尿病人的主食选择[9]。虽然功能糖的生理功能得到肯定,但是其作用机理还未被阐明。本研究以NCI-H716 细胞构建的肠内分泌细胞为模型,评价山梨糖醇、赤藓糖醇、海藻糖、异麦芽酮糖醇、木糖醇和L-阿拉伯糖等功能糖对肠源性激素的促分泌作用,初步阐明功能糖改善人体糖、脂代谢的机理,继续探究功能糖促GLP-1 分泌的机理。
1 材料与方法
1.1 材料与试剂
人结直肠腺癌细胞NCI-H716,购自中国医学科学院基础医学研究所;RPMI1640 培养基、高糖DMEM 培养基、平衡盐缓冲液(Hank's balanced salt solution,HBSS)、KRB 缓冲溶液(含10 mmol/L 葡萄糖),中科迈晨科技有限公司;胎牛牛血清(Fetal Bovine Serum,FBS),美国Gibco 公司;山梨糖醇、赤藓糖醇、海藻糖、异麦芽酮糖醇、木糖醇、L-阿拉伯糖,上海士锋生物科技有限公司;牛血清白蛋白(Bovine serum albumin,BSA),北京拜尔迪生物技术有限公司;DPP-Ⅳ抑制剂,美国Med-ChemExpress 公司;钙离子荧光探针Fluo-3AM,美国Sigma 公司;CCK-8 试剂盒(Cell counting Kit-8)、二甲基亚砜(Dimethyl sulfoxide,DMSO)、RIPA裂解液、苯甲基磺酰氟(Phenyl methane sulfonyl fluoride,PMSF)、BCA 蛋白浓度测定试剂盒,上海碧云天生物技术研究所;基质胶、美国BD 公司;RNA 提取试剂盒,北京全式金生物技术有限公司;GLP-1、GLP-2、PYY 试剂盒(ELISA),艾恩斯生物科技有限公司。
1.2 仪器与设备
倒置生物显微镜,日本OLympus 公司;生物安全柜,济南鑫贝西生物技术有限公司;CO2培养箱,日本松下公司;Spectra Max i3 酶标仪,美国MD 公司;分析天平,梅特勒-托利多仪器有限公司;超声波清洗仪,昆山超声仪器有限公司KQ-250DE;pH 计,上海雷磁仪器厂;实时荧光定量PCR 仪,伯乐生命医学产品有限公司;洗板机,赛默飞世尔科技(中国)有限公司;手持式细胞计数器,密理博中国有限公司。
1.3 方法
1.3.1 NCI-H716 细胞的培养 人结直肠腺癌细胞NCI-H716 在含有20% FBS、100 U/mL 青霉素和100 μg/mL 链霉素的RPMI1640 培养基中,于37℃,5% CO2以及90%相对湿度的培养箱中悬浮生长。当细胞生长至1.0×107 个/mL,将培养液移至15 mL 离心管,2 000 r/min 室温离心5 min。离心完毕后,弃掉上清并取1 mL 的完全培养基吹打细胞,将细胞均匀的分成3 份,每个T75 培养瓶加20 mL 完全培养基。
1.3.2 NCI-H716 细胞内分泌模型的建立NCIH716 细胞以3×105 个/mL 的密度接种于包被有基质胶的12 孔板中,培养2 d,进行内分泌分化试验。内分泌分化所用培养基为含有20% FBS、1%双抗的高糖DMEM 培养基,分化2 d 后,培养基用含有0.2% BSA 的KRB 缓冲溶液代替培养2 h。向上清中加入50 μg/mL 的苯甲基磺酰氟和10 μg/mL 的DPP-Ⅳ抑制剂,使用ELISA 试剂盒检测GLP-1 含量。
1.3.3 CCK-8 法测定NCI-H716 细胞存活率 取96 孔培养板,每孔加100 μL 细胞悬液,细胞密度为3×105个/mL,37℃培养24 h 后每孔加入0.5,1,2 mg/mL 3 个不同质量浓度的功能糖,以无功能糖的相同培养基孵育细胞为对照组,培养24 h后每孔加入10 μL CCK-8 溶液于37℃避光孵育2 h。用酶标仪在波长450 nm 处测定吸光度值。以对照组细胞存活率为100%计算其余组别细胞存活率。
1.3.4 功能糖对GLP-1、GLP-2、PYY 分泌的影响试验方法同1.3.3 节,分化后分别设对照组、样品组(赤藓糖醇、海藻糖、山梨糖醇质量浓度为0.5,1,2 mg/mL)。
1.3.5 功能糖对NCI-H716 细 胞T1R2、T1R3、Gα-gustducin、PLCβ2、TRPM5 mRNA 表达量的影响NCI-H716 细胞以3×105个/mL 的密度接种于包被有基质胶的6 孔板,分化后分别设对照组、样品组(赤藓糖醇、海藻糖、山梨糖醇质量浓度为0.5,1,2 mg/mL),培养2 h 后,按照全式金试剂盒说明书提取细胞总RNA,用RNA/DNA 超微量测定仪对RNA 进行定量,测定RNA 纯度及浓度。qPCR 反应条件为45℃-5 min;94℃-30 s,94℃-5 s,65℃-1 min,循环40 次;PCR 扩增完毕后,进行半定量分析。引物序列及产物大小见表1。

表1 试验用目标基因特异性引物序列Tab1e 1 Sequences of primers for target genes of amplified fragment
采用2-△△Ct计算基因表达的相对量,具体如下:
△Ct(待测样本)=Ct(目的基因,待测样本)-Ct(内参基因,待测样本)
△Ct(对照样本)=Ct(目的基因,对照样本)-Ct(内参基因,对照样本)
△△Ct=△Ct(待测样本)-△Ct(对照样本)
相对表达量=2-△△Ct
1.3.6 功能糖对NCI-H716 细胞内Ca2+含量的影响NCI-H716 细胞以3×105 个/mL 的密度接种于包被有基质胶的黑色96 孔板,培养2 d。按试验需求给予不同因素处理分为对照组、样品组(赤藓糖醇、海藻糖、山梨糖醇质量浓度为0.5,1,2 mg/mL)。弃掉细胞培养液后,用HBSS 清洗2 次,每孔加入100 μL 荧光探针Fluo-3MA(5 μmol/L),37℃细胞培养箱内孵育30 min 进行探针装载。HBSS洗涤后在37℃下避光孵育30 min,用酶标仪检测激发波长488 nm、发射波长525 nm 处的荧光值。
1.4 统计学处理
试验数据采用Origin 8.0 统计软件进行分析,结果用±s 表示,并对试验结果进行单因素方差分析ANOVA,P<0.05 表示显著差异,信号通路图采用Pathway Builder 2.0 软件绘制。
2 结果与分析
2.1 小肠内分泌模型的建立
小肠内分泌细胞受肠腔内营养物质刺激分泌肠源性激素,GLP-1 的合成和分泌呈葡萄糖浓度依赖性[10]。由于GLP-1 的合成是建立在一定葡萄糖浓度基础之上,因此选择适宜的葡萄糖浓度对模型建立至关重要。如图1所示,葡萄糖能够刺激GLP-1 分泌且具有浓度依赖性,当葡萄糖浓度达到15 mmol/mL 时,GLP-1 分泌量较对照组显著增加。为了研究功能糖是否具有促GLP-1 等肠源性激素分泌的特性,选取10 mmol/mL 的葡萄糖浓度作为基础浓度,在此浓度之下NCI-H716 细胞具有一定的分泌GLP-1 的能力但是又不至于过量分泌影响功能糖的作用。
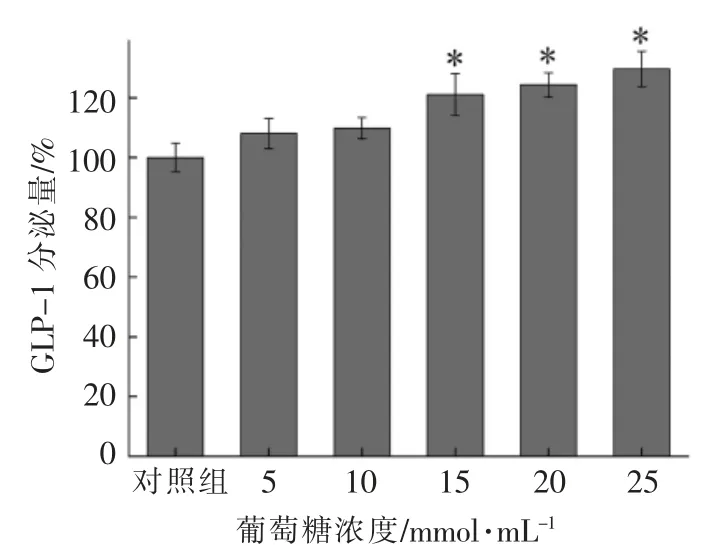
图1 不同浓度葡萄糖对GLP-1 分泌的影响Fig.1 Effects of different concentrations of glucose on GLP-1 secretion
2.2 不同功能糖促肠源性激素分泌研究
2.2.1 不同功能糖对NCI-H716 细胞活力的影响图2为功能糖处理细胞24 h 后对细胞活力的影响。从图2中可以看出,海藻糖、木糖醇、异麦芽酮糖醇、山梨糖醇在0.5~4 mg/mL 质量浓度范围内对NCI-H716 细胞存活率无显著影响(图2a~d),赤藓糖醇、L-阿拉伯糖在0.5~8 mg/mL 质量浓度范围内对NCI-H716 细胞存活率无显著影响(图2e~f)。因此选取0.5~4 mg/mL 范围内任意质量浓度进行后续试验,但是考虑到GLP-1 的分泌量可能与功能糖剂量有关,因此选择低剂量(0.5 mg/mL),中剂量(1 mg/mL),高(2 mg/mL)3 个质量浓度进行后续试验。
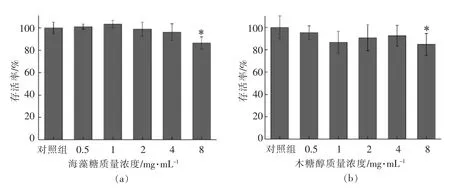

图2 功能糖对NCI-H716 细胞活力的影响Fig.2 Effects of functional sugars on the viability of NCI-H716 cells
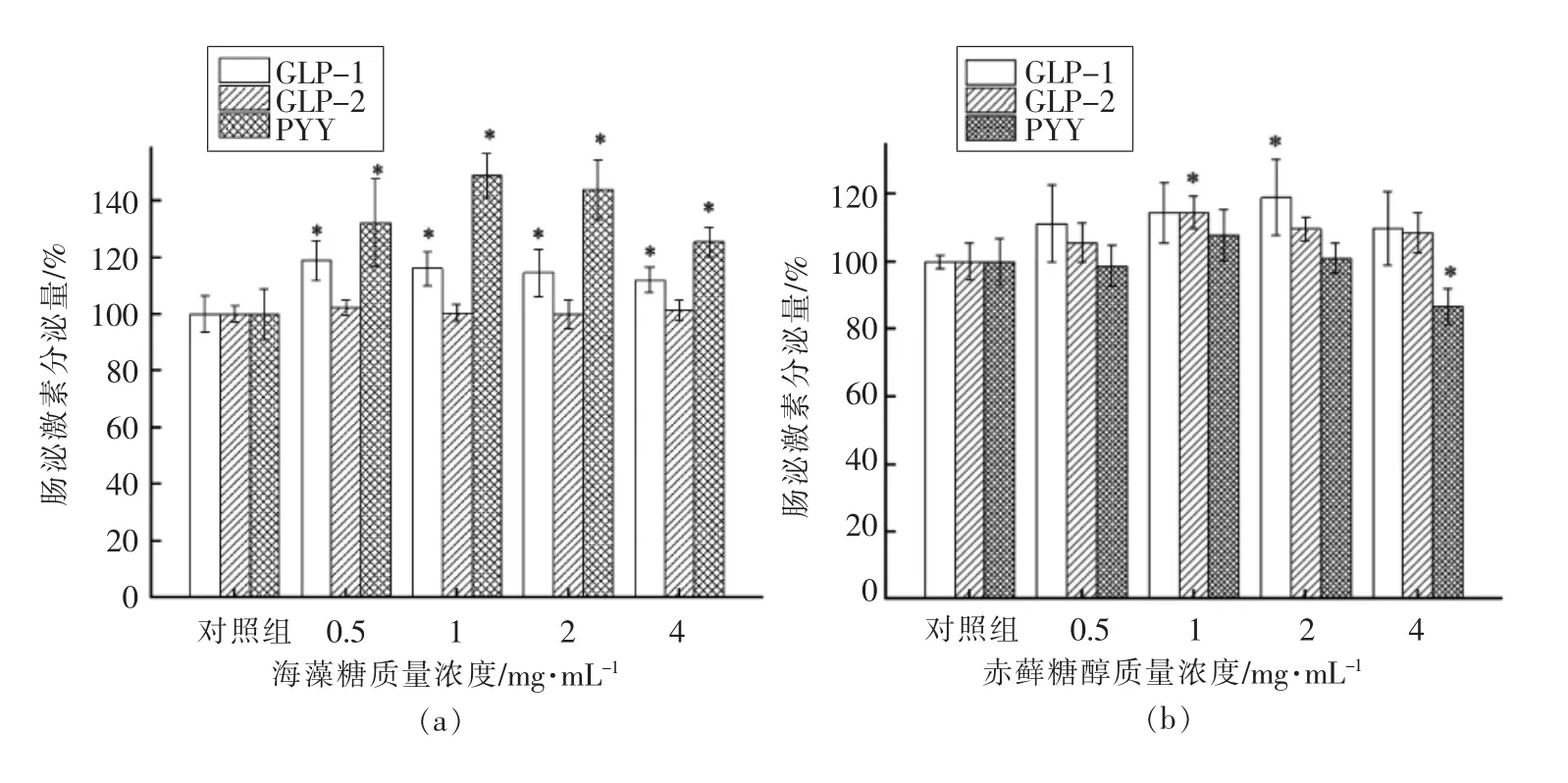
2.2.2 不同功能糖对NCI-H716 细胞GLP-1、GLP-2、PYY 分泌的影响如图3所示,异麦芽酮糖醇、L-阿拉伯糖对GLP-1、GLP-2、PYY 的分泌无显著影响(图3e~f)。赤藓糖醇、山梨糖醇、木糖醇的促激素分泌能力类似。当赤藓糖醇质量浓度为2 mg/mL 时,GLP-1 分泌率达到对照组的1.18倍;当赤藓糖醇质量浓度为1 mg/mL 时,GLP-2 的分泌率达到对照组的1.15 倍(图3b)。当山梨糖醇质量浓度为1 mg/mL 时,GLP-1 分泌率为对照组的1.08 倍;当山梨糖醇质量浓度为0.5 mg/mL 时PYY 的分泌率达到对照组的1.14 倍(图3c)。木糖醇质量浓度在1~2 mg/mL 范围内显著促进PYY的分泌(P<0.05)(图3d)。海藻糖促进激素分泌作用最显著,质量浓度在0.5~4 mg/mL 范围内均显著促进GLP-1、PYY 的分泌(P<0.05)。当海藻糖质量浓度为0.5 mg/mL 时,GLP-1 分泌率达到对照组的1.19 倍;当海藻糖质量浓度为1 mg/mL 时PYY 分泌率达到对照组的1.49 倍(图3a)。由此可见,功能糖促激素分泌不具有质量浓度依赖性且上述6 种功能糖中海藻糖的促肠源性激素分泌能力最强。
有研究发现糖类物质主要通过甜味受体信号通路促进GLP-1 分泌[11],故本研究选择促GLP-1分泌能力较强的海藻糖、赤藓糖醇、山梨糖醇进一步探究其对甜味受体关键基因表达量的影响,阐明功能糖促GLP-1 分泌的机制。
2.3 功能糖对NCI-H716 细胞甜味受体信号通路相关基因T1R2、T1R3、Gα-gustducin、PLCβ2、TRPM5 mRNA 表达量的影响
甜味受体是存在于细胞膜上的跨膜异二聚体蛋白,分为T1R2 和T1R32 个亚基。当T1R2 或T1R3 单独存在时,对甜味的感知能力极低,然而2 个单体结合后几乎能感知所有甜味[12]。甜味受体与细胞膜内侧Gα-gustducin 味蛋白相偶联,甜味物质与受体结合导致受体的构象发生变化,引发细胞内信号传导及肠泌激素释放[13]。图5的试验结果表明:赤藓糖醇、海藻糖、山梨糖醇质量浓度在0.5~2 mg/mL 范围内可上调甜味受体T1R2/T1R3 和TRPM5 通道mRNA 表达量(图3a,3e);0.5 mg/mL 的赤藓糖醇、海藻糖、山梨糖醇可上调甜味受体下游Gα-gustducin mRNA 表达量(图3c);0.5 mg/mL 的赤藓糖醇和海藻糖及1 mg/mL的山梨糖醇可上调PLCβ2 mRNA 的表达量(图3d)。
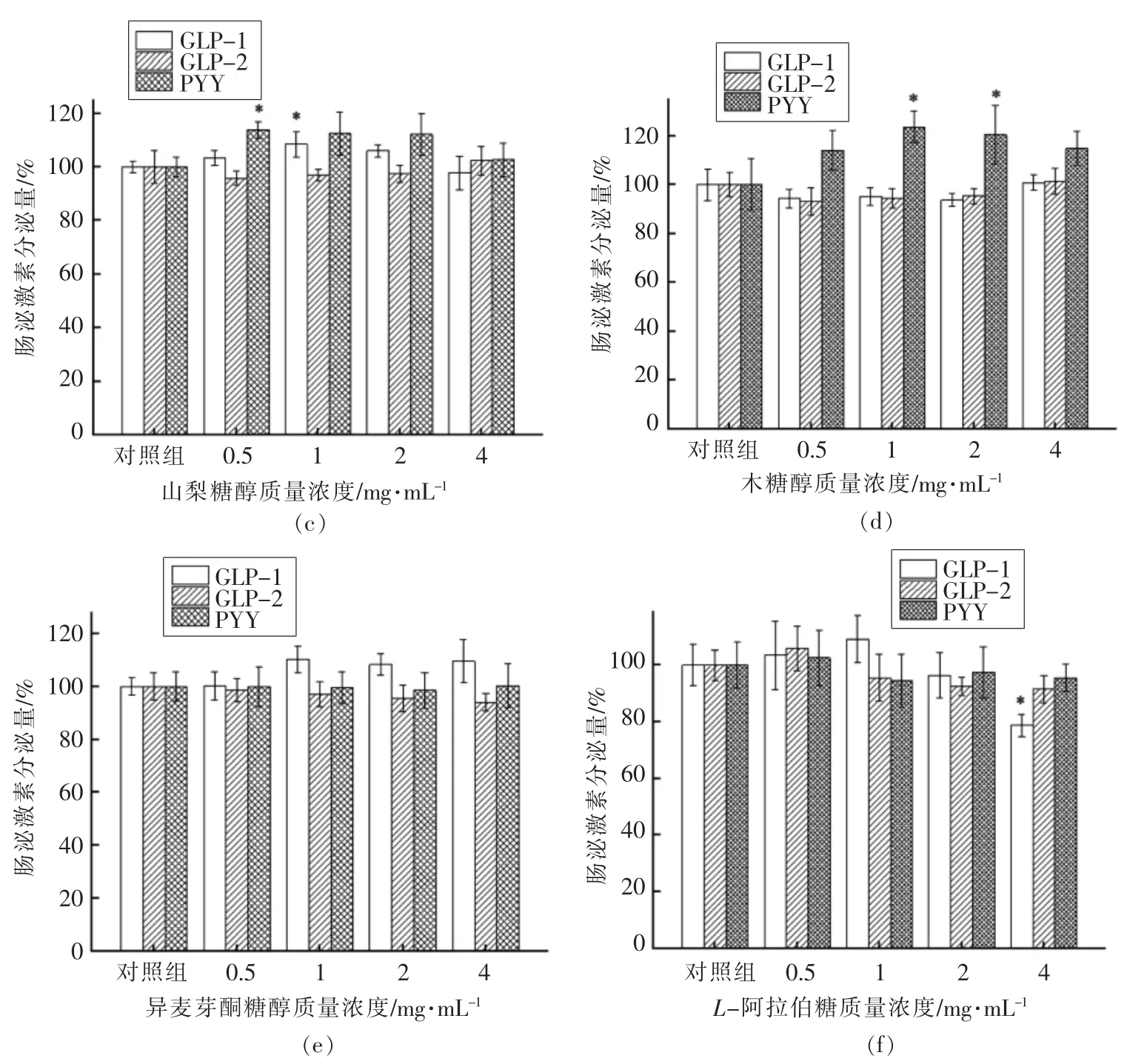
图3 功能糖对GLP-1、GLP-2、PYY 分泌的影响Fig.3 Effects of functional sugars on secretion of GLP-1,GLP-2 and PYY
上述研究表明,赤藓糖醇、海藻糖、山梨糖醇通过上调甜味受体信号通路相关基因T1R2、T1R3、Gα-gustducin、PLCβ2、TRPM5 mRNA 表 达量促进肠源性激素分泌,且海藻糖对5 种基因表达量的上调能力远高于其它2 种。肠腔通过葡萄糖转运蛋白和甜味受体感应糖类物质促进激素分泌[14]。Margolskee 等[15]研究表明甜味受体T1R2/T1R3 可以调控钠依赖性葡萄糖转运载体1(SGLT1)的基因表达。海藻糖是一种非还原型双糖,可分解为2 分子葡萄糖被人体吸收利用,因此推测海藻糖能够同时激活甜味受体与葡萄糖转运蛋白,两者之间存在协同作用可增强肠腔对海藻糖的感应,促进海藻糖介导的激素分泌[16]。
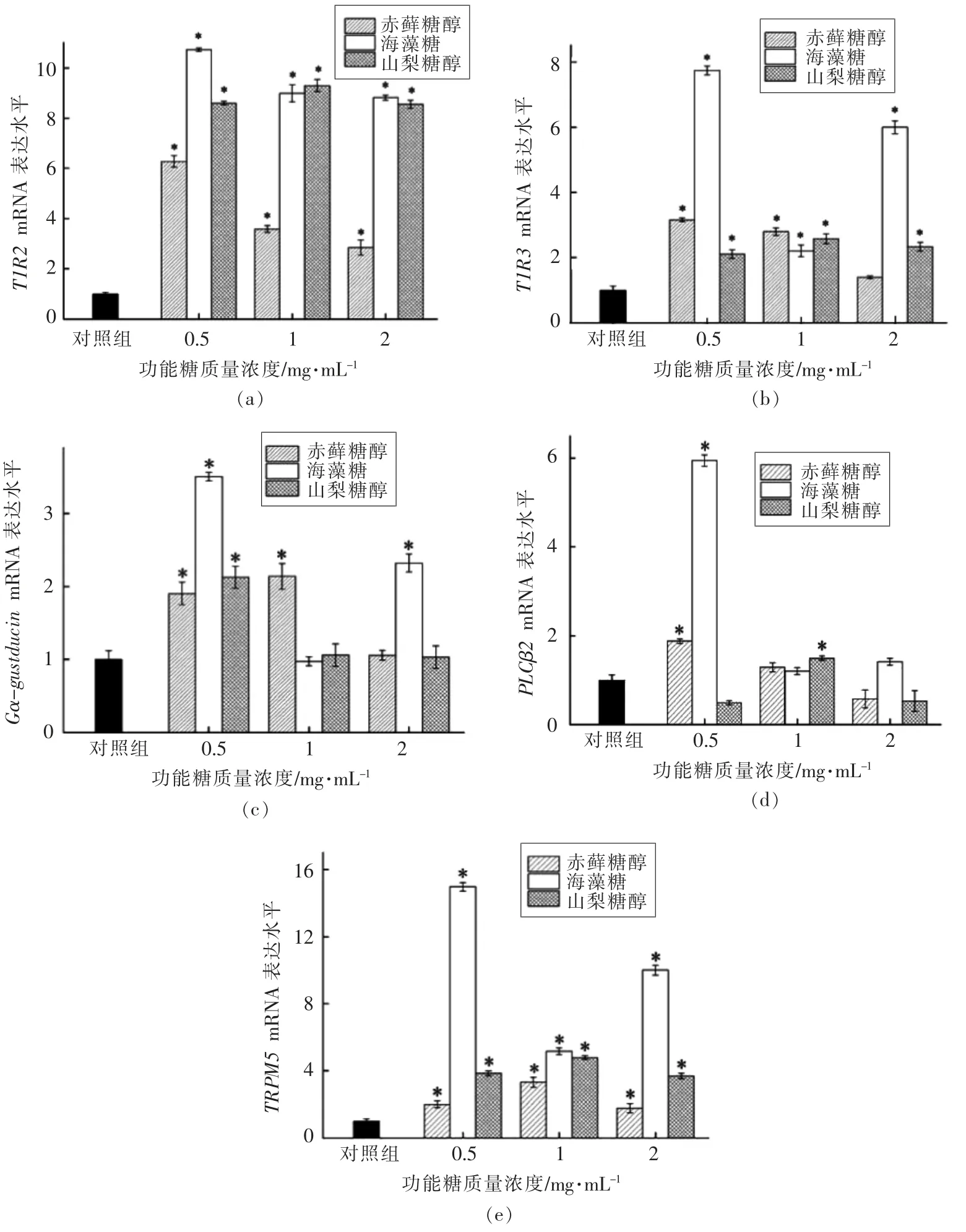
图4 功能糖对NCI-H716 细胞中T1R2、T1R3、Gα-gustducin、PLCβ2、TRPM5 mRNA 表达量的影响Fig.4 Effects of functional sugar on the mRNA expression levels of T1R2,T1R3,Gα-gustducin,PLCβ2 and TRPM5 in NCI-H716 cells
2.4 功能糖对NCI-H716 细胞内Ca2+含量的影响
Ca2+是细胞内的第二信使,也是甜味受体信号通路中的重要信号分子。因此胞内Ca2+含量变化是甜味受体信号通路激活的重要指标之一。由图6可知,0.5~1 mg/mL 的赤藓糖醇、海藻糖、山梨糖均可以促进胞内Ca2+含量升高。
通过研究初步探索了功能糖激活甜味受体信号通路促进肠源性激素分泌的机理(图7)。信号传达的大致过程为:小肠内分泌细胞表面的甜味受体识别功能糖后蛋白质构象发生改变,导致Gα-gustducin 与甜味受体解离,Gα-gustducin 可以激活PLCβ2,PLCβ2 能将PIP2 分解为IP3,IP3激活内质网表面的IP3R,引起钙池的Ca2+外流,Ca2+浓度升高后激活TRPM5 通道打开,引起Na+内流,胞内带正点离子浓度升高引起细胞去极化,促进肠源性激素分泌。
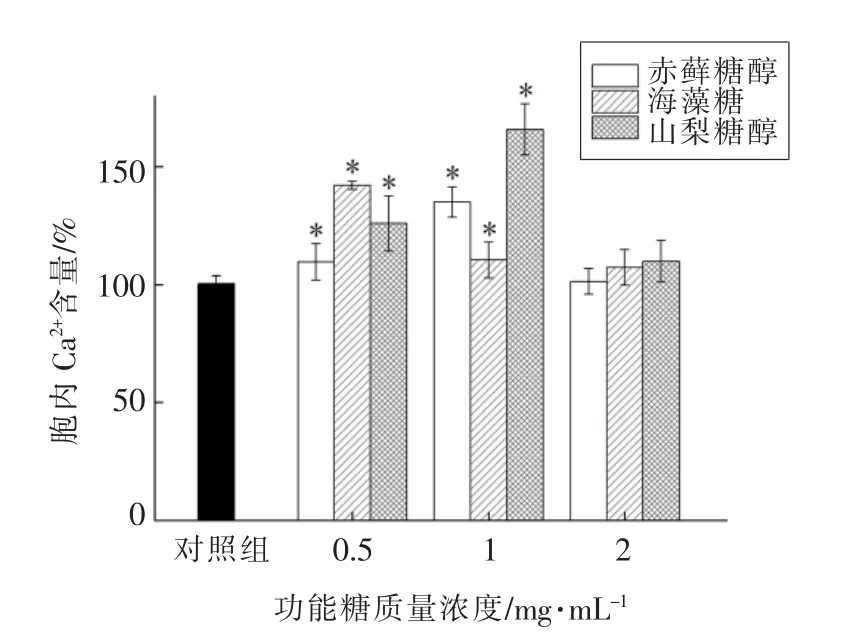
图5 功能糖对NCI-H716 细胞内Ca2+含量的影响Fig.5 Effects of functional sugars on Ca2+concentration in NCI-H716 cells
3 讨论
功能糖可引起PYY 的释放,而PYY 可以起到抑制肠道蠕动、胆囊收缩及延缓胃排空的作用。除此之外,PYY 作用于下丘脑对饱腹感产生影响,并在干预胰岛素抵抗、调节血糖、改善脂代谢等方面功能糖也有不俗的表现。李建文等[17]发现L-阿拉伯糖对减轻自发性II 型糖尿病大鼠的胰岛素抵抗及高脂血症具有显著疗效。Matsuo 等[18]研究表明D-阿洛酮糖可降低血糖,减少脂质积累。杨志远等[19]用木糖醇注射液作糖尿病人的营养用药改善了病人糖代谢,消除酮血症。由于功能糖的特殊功效,使得其在食品中既可作为一种功能性配料,又可作为蔗糖的替代品,降低食品中糖对特殊人群的影响[20-21]。除了功能糖以外,人参皂苷、苦瓜、龙胆根水提取物等均被证明通过促进GLP-1 分泌发挥抑制血糖升高、改善IR 和抗糖尿病的作用[22-26]。除了与肠道发生直接作用,功能糖还可以被肠道菌群利用发酵生成短链脂肪酸等小分子物质,短链脂肪酸也具有促进肠源性激素分泌的功能[27-28]。
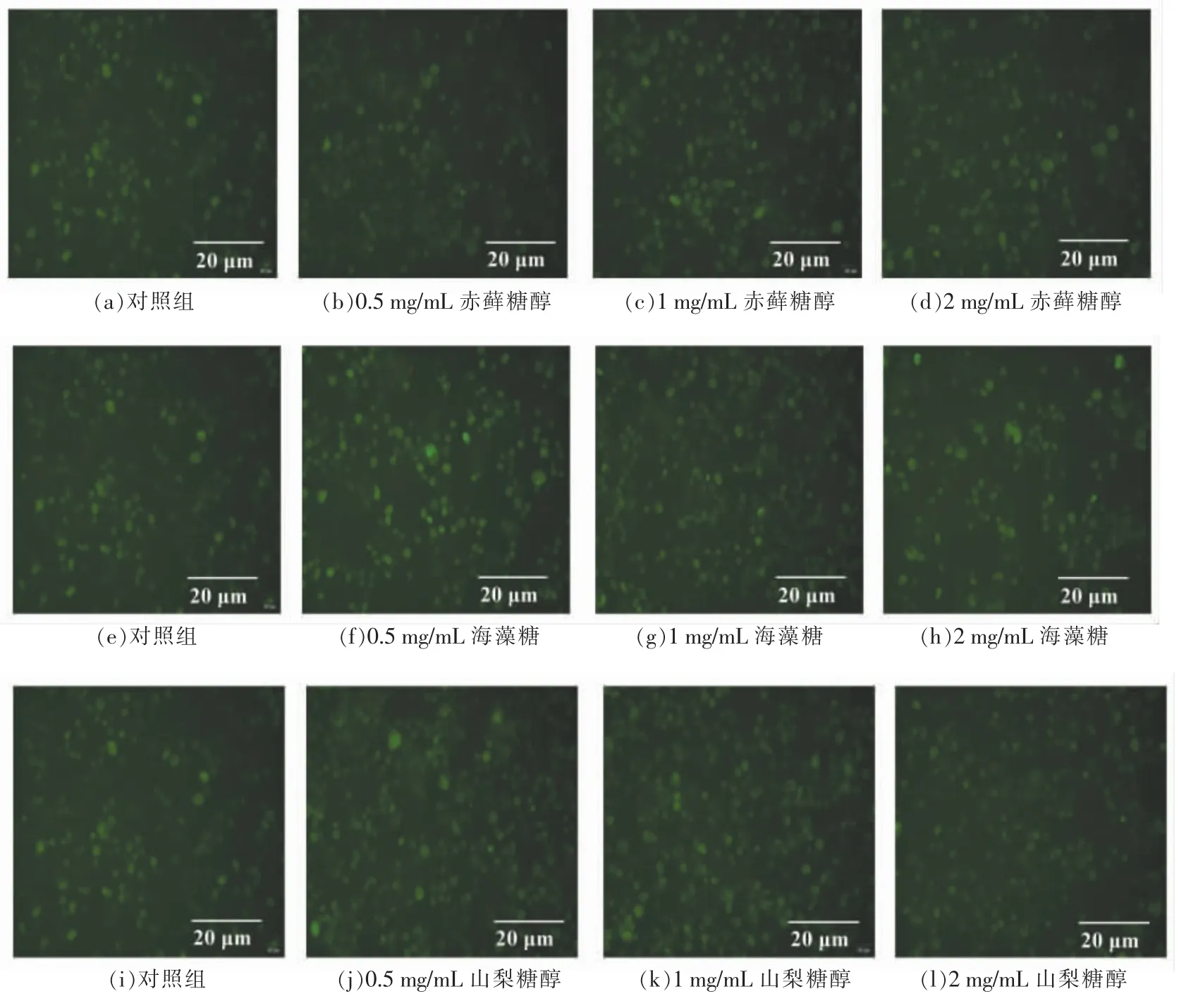
图6 功能糖对NCI-H716 细胞内Ca2+含量影响的荧光染色图Fig.6 Fluorescence staining of effects of functional sugars on Ca2+concentration in NCI-H716 cells
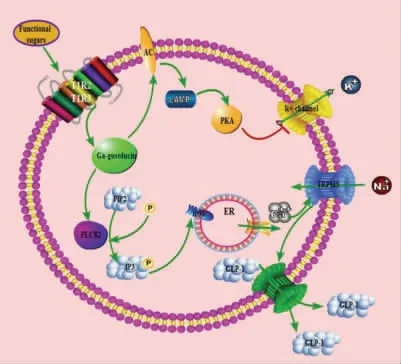
图7 功能糖激活甜味受体信号通路促进GLP-1 分泌Fig.7 Functional sugars activates sweet receptor signaling pathway to promote GLP-1 secretion
4 结论
利用NCI-H716 细胞证明了海藻糖、赤藓糖醇、山梨糖醇、木糖醇可以促进GLP-1、GLP-2、PYY 的分泌,并发现海藻糖、赤藓糖醇、山梨糖醇通过上调甜味受体信号通路关键基因T1R2、T1R3、Gα-gustducin、PLCβ2、TRPM5 mRNA 表 达量,增加胞内Ca2+浓度促进GLP-1 分泌。本研究为功能糖改善糖、脂代谢的机理研究提供了新思路,也为功能糖在食品中的应用提供了理论支持。除了激活甜味受体外,肠源性激素的分泌还受到食物状态、胃肠中营养物质含量及肠道消化吸收水平、肠道微生物等因素的影响。甜味受体信号通路的激活并不是影响GLP-1 分泌的唯一途径,本研究中仅考虑了功能糖对肠内分泌细胞的影响,存在一定的局限性。
