杂醇油酶法制备天然等同酯香料的研究
2021-06-07孟冠男刘国荣王成涛文雁君
孟冠男, 刘 亚, 雷 声, 刘国荣, 王成涛,*, 文雁君
(1.北京工商大学 北京市食品添加剂工程技术研究中心, 北京 100048;2.云南中烟工业有限责任公司 技术中心, 云南 昆明 650202;3.河南中大恒源生物科技股份有限公司, 河南 临颍 462600)
杂醇油是一种无色或淡黄色挥发性油状液体,其主要成分为异戊醇、异丁醇、正丙醇等[1],杂醇油是淀粉、糖蜜、纤维水解糖等原料发酵生产酒精的副产物之一[2],在酒精发酵过程中伴随产生,在酒精精馏提取时被分离出来,提取率约占酒精产量的0.24%~0.7%,据相关协会资料显示,2018年我国发酵酒精产量已达6.47×109L,近年由于燃料乙醇需求增加,国内发酵酒精产量不断增加,杂醇油产量也随之增长。因此,提高杂醇油资源利用率、附加值,具有重要经济和社会意义。
目前,我国对杂醇油的利用主要有两条途径:第一,杂醇油经精制分馏得到C2、C3、C4醇和异戊醇等,作为燃料或溶剂。第二,硫酸催化酯化杂醇油制备混合酯。浓硫酸具有强烈腐蚀性,不符合环境友好生产的要求,该工艺制备的酯香料不具有“天然性”、价格低,使其在香精香料配制应用时受到一定限制[3]。
非水相酶催化是利用生物酶在非水介质(如有机溶剂、超临界流体、气相、离子液体等)中进行的催化反应[4-5]。酶在非水相体系的催化具有许多特点[6-10]:酶的底物特异性、立体选择性、区域选择性、键选择性和热稳定性等都有所改变;酶热稳定性更高,如脂肪酶Novozym 435 FG在60~70 ℃时仍有较高酶活力;非水相体系中酶分子表面一层水化层对维持酶构象及活力是十分重要,需要保持分子有水的微环境;非水相反应抑制了水参与的副反应(如酯化、肽合成等),且有效提高有机底物的溶解度;反应条件温和,环境污染小,转化率高、产物易于分离纯化等。近年非水相酶催化研究方面取得较大进展[10-15],发现脂肪酶、蛋白酶、羟基化酶、过氧化物酶等在非水相体系中能进行酯化、酰基化、糖苷、聚合等,完成短链酯、糖酯、肽、手性醇、葡萄糖苷、生物柴油等合成转化。杂醇油酶法转化制备的酯香料,可称为“天然等同香料”[16],较化学合成香料价格高多倍。
本研究以发酵来源的乙酸和杂醇油为主要原料,筛选适宜脂肪酶,研究无溶剂体系中酶转化的影响因素,优化其酯化条件,以期为天然等同酯香料开发利用提供依据。
1 材料与方法
1.1 材料与试剂
乙酸异戊酯、乙酸异丁酯、乙酸丙酯均为分析纯,国药化学试剂公司;活性炭粒,国药化学试剂公司;正己烷、异戊醇、丙酮、丁酮、叔丁醇、乙醚均为分析纯,4A分子筛、小钢瓶,北京化学试剂公司;脂肪酶Novozym 435FG、Lipozyme TLIM、Lipozyme TL、Lipozyme 50BG、Greasex 200MG、LIPEX 100T、NovoCor ADL,丹麦诺维信公司;0.45 μm有机相滤膜,天津市津腾实验设备有限公司;杂醇油(发酵法制备酒精的副产物),山东裕方生物化工有限公司;去离子水、高纯水,实验室纯化自制。
1.2 仪器与设备
TGL- 10C型高速台式离心机,上海安亭科学仪器厂;HQ45型恒温摇床,中国科学院武汉科学仪器厂;DF- 101S型集热式恒温加热磁力搅拌器,巩义市予华仪器有限责任公司;BS200S- WE1型电子天平,北京赛多利斯天平有限公司; DHG- 9145A型鼓风干燥箱,上海一恒科仪有限公司;6890N- 5975C型气相色谱- 质谱仪,美国安捷伦公司;JXD- 02型超声仪,北京金星超声波设备技术有限公司。
1.3 实验方法
1.3.1杂醇油预处理
预制杂醇油的制备:200 mL杂醇油于旋转蒸发仪中90 ℃减压蒸馏脱色,收集物经40 g 4A分子筛150 r/min摇床10 h脱水。
1.3.2脂肪酶种类的筛选
依据脂肪酶对乙酸和异戊醇合成异戊酯的转化率筛选脂肪酶。分别取乙酸和预制异戊醇各3 mL混合均匀,加脂肪酶70 mg、4A分子筛2.0 g,密封,于45 ℃、140 r/min摇床反应36 h。
脂肪酶相对活力测定:按GB 601—2016《化学试剂 标准滴定溶液的制备》规定,0.01 mol/L NaOH溶液滴定,酚酞为指示剂,利用NaOH滴定计算反应剩余乙酸量,根据乙酸消耗量计算酯产率,以此表征脂肪酶相对活力,见式(1)。
酶促酯产率=(V1-V2)/V1×100%。
(1)
式(1)中,V1表示空白实验消耗NaOH的体积,mL;V2表示加入脂肪酶后所消耗NaOH的体积,mL。
1.3.3制备酯香料的方法及单因素实验
基本反应体系为预制杂醇油3 mL、脂肪酶Novozym 435FG 70 mg、4A分子筛2.0 g、乙酸1.5 mL分批次逐渐加入,水浴45 ℃、摇床140 r/min、密封反应36 h。对于上述基本反应体系和条件,采用固定其他、替换改变其中之一因素条件的方式,分别考察脂肪酶量(30、50、70、90、110 mg)、4A分子筛量(0、0.5、1.0、1.5、2.0、2.5 g)、乙酸加入次数(1~6次)、乙酸加入的间隔时间(0、1、2、3、4、5 h)、反应温度(30、35、40、45、50 ℃)、反应时间(12、18、24、30、36 h)、摇床转速(0、100、120、140、160、180 r/min)等单因素条件对酯产率的影响,每组3次平行重复,反应体系中不另加其他溶剂。
反应结束后用一次性注射器吸取1.5 mL上清液,0.45 μm有机相滤膜过滤,取100 μL,用正己烷定容至5 mL,用气相色谱- 质谱测定产物酯含量[6]。
1.3.4气相色谱-质谱测定条件
参照文献[16]确定气相色谱- 质谱测定条件。
DB-WAX毛细管色谱柱(60 m×0.32 mm×0.25 μm);进样器温度250 ℃;进样量1.0 μL;检测器温度250 ℃;柱温在60 ℃保持3 min,以3 ℃/min升至90 ℃,以20 ℃/min上升到230 ℃,保持3 min,共计23.5 min;载气为氦气,流速 4.6 mL/min, 压力为1.1×105Pa。
1.3.5标准曲线的绘制
配置不同浓度乙酸异戊酯(1、2、3、4、5、6、7、8、9、10 mg/mL)、乙酸正丙酯(0.06、0.08、0.10、0.12、0.14、0.16、0.18、0.20 mg/mL)、乙酸异丁酯(0.05、0.10、0.20、0.30、0.40、0.50 mg/mL)标准品溶液,用气相色谱- 质谱仪分析,绘制酯浓度与峰面积标准曲线。
杂醇油制得酯产率的计算见式(2)。
酯产率=(C1×50×b×1 000×M1)/ (2.38a×M2)×100%。
(2)
式(2)中,C1为产物乙酸异戊酯(或乙酸异丁酯、乙酸正丙酯)密度,mg/mL;M1为异戊醇(或异丁醇、正丙醇)的摩尔质量,g/mol;M2为乙酸异戊酯(或乙酸异丁酯、乙酸正丙酯)的摩尔质量,g/mol;a为异戊醇(或异丁醇、正丙醇)在预制杂醇油中所占体积分数;b为无溶剂反应体系的体积,为4.5 mL。
1.3.6制备酯香料的条件优化
结合单因素实验结果,采用正交试验方法优化杂醇油制备酯香料的条件,正交试验因素与水平见表1。气相色谱- 质谱联用测定产物酯含量,分析比较各因素的极差(R值),使用SPSS 16.0软件进行方差分析,检验显著性差异。

表1 正交试验因素与水平Tab.1 Factors and levels of orthogonal test
1.3.7超声处理的实验条件
反应体系中预制杂醇油3 mL、分子筛1.0 g、脂肪酶70 mg、1.5 mL乙酸分6次加入(间隔1 h),于45 ℃水浴,小钢瓶密闭反应6 h。超声频率28、50、135 Hz,超声功率0.1、0.3、0.5 W/cm2;对照组为无超声处理的摇床实验。采用气相色谱- 质谱联用测定产物酯含量。
2 结果与分析
2.1 实验条件对酯香料产率的影响
2.1.1脂肪酶种类的影响
采用气相色谱- 质谱联用分析预制杂醇油的组成成分,其异戊醇、异丁醇、正丙醇占比分别为93.50%、2.70%、1.65%。因此,选择异戊醇与乙酸为底物,考察脂肪酶催化合成乙酸异戊酯的转化率为对象,筛选适宜的脂肪酶。不同脂肪酶对酯产率的影响见图1。由图1可知,Novozym 435FG和Greasex 200MG的转化率较高,分别为92.62%、80.12%,其余脂肪酶的酯化活力很弱,甚至未见活性。由于脂肪酶Novozym 435FG测定酶活力约为8 000 U/g(此值接近商品宣称酶活力),且为固定化酶颗粒,也便于回收再利用,因此,选择Novozym 435FG作为实验研究用酶。
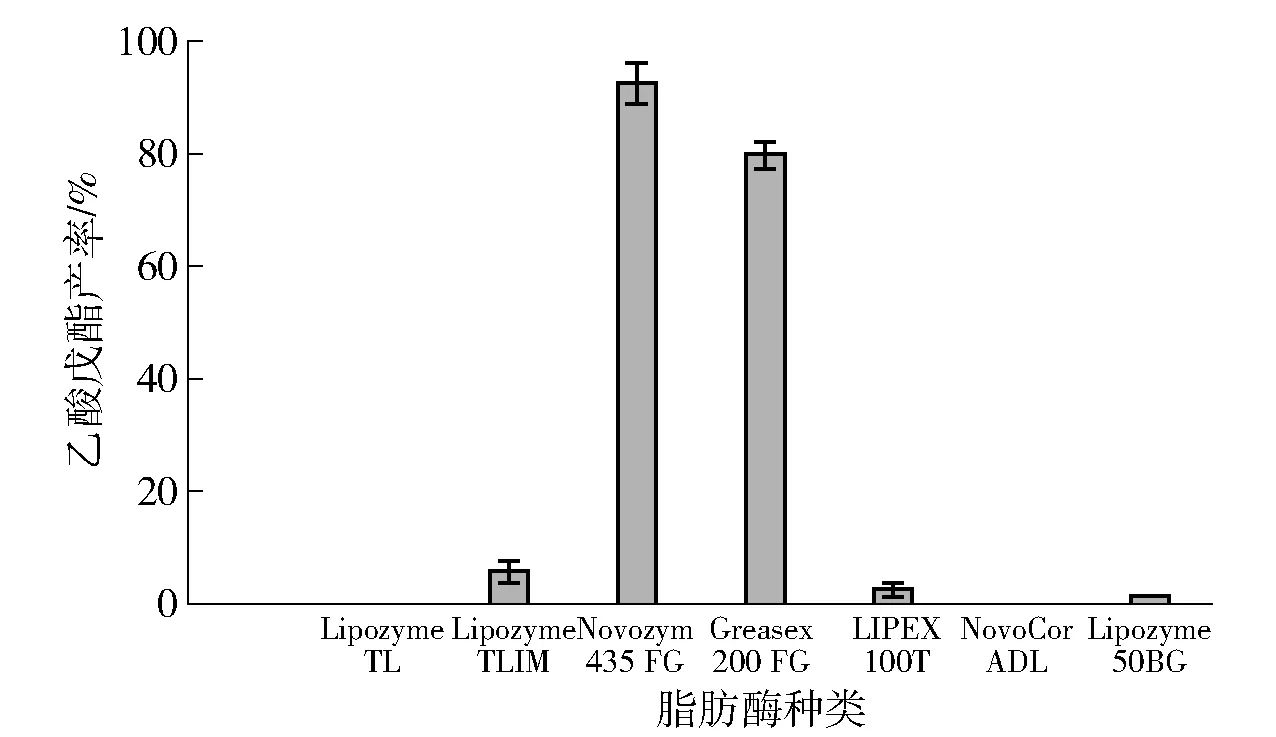
图1 脂肪酶种类的筛选Fig.1 Selection of lipases species
2.1.2脂肪酶加入量的影响
在预制杂醇油3 mL、4A分子筛2.0 g、乙酸1.5 mL分6次加入(每次间隔3 h),水浴45 ℃、摇床140 r/min,反应36 h的条件下,考察Novozym 435FG脂肪酶加入量对酯产率的影响,结果见图2和图3。由图2和图3可知,脂肪酶Novozym 435 FG加入到70 mg时酯产率达到80%以上,继续增加酶量,产率增加不大。一般认为酶催化反应速率与产量是随着脂肪酶增加而不断增加,但是这种理论在非水相中不一定适用,Habulin等[13]在研究果糖酯合成时,发现非水相中脂肪酶过量增加,由于酶本身之间的竞争作用争夺必需水,产物量反而下降,甚至停止反应。
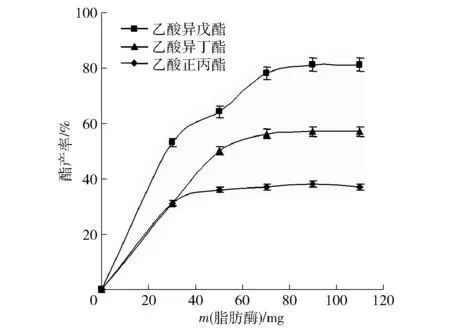
图2 脂肪酶加入量对酯产率的影响Fig.2 Effect of lipase addition on ester yield

图3 杂醇油制备酯香料反应产物的色谱Fig.3 Chromatogram of reaction products in preparation of ester aromas from fusel oil
2.1.3分子筛加入量的影响
酯化反应是生成水的可逆反应,产物水分子会改变酶的微环境,进而影响酶活性,水过多时将向逆向水解反应进行。分子筛是一种良好除水剂,吸收水分促使酯化反应进行。在预制杂醇油3 mL、Novozym 435FG脂肪酶70 mg,乙酸1.5 mL分6次加入(每次间隔3 h),水浴45 ℃、摇床140 r/min、反应36 h的条件下,考察4A分子筛加入量对酯产率的影响,见图4。由图4可知,分子筛加入量为1.0 g以上时,3种酯产率接近最大值,继续增加分子筛用量,产物量增加不明显。此结果与非水相酶学理论和大多数研究报道基本一致,非水介质并非完全没有水,酶催化活性需要靠着与之紧靠的一层左右的水分子来维持,如果没有水,将会导致酶构象的剧烈变化甚至完全失活[8];如分子筛过量,会吸收脂肪酶分子表面的结构水,容易夺去酶的“水保护层”,导致酶柔性丧失,降低酶活力,甚至酶失活。
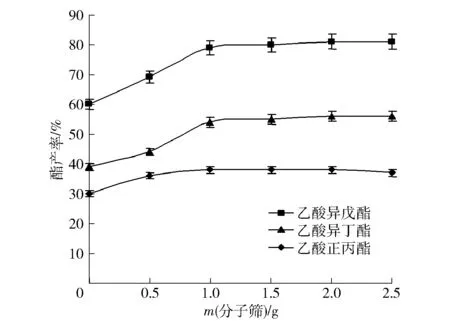
图4 分子筛加入量对酯产率的影响Fig.4 Effect of molecular sieve addition amount on ester yield
2.1.4乙酸加入次数和间隔时间的影响
在预制杂醇油3 mL、脂肪酶Novozym 435FG 70 mg、4A分子筛2.0 g,水浴45 ℃、摇床140 r/min反应体系中,反应36 h条件时,考察1.5 mL乙酸分加入次数对酯香料产率的影响,见图5。由图5可知,酯产率随乙酸加入次数增加而增加,可见分批加入底物乙酸,有利于缓解低pH值作用,最大限度地提高酯产率。Romeroa等[6]在研究酶法合成乙酸异戊酯时也发现过量乙酸或乙酸酐会降低脂肪酶活性,采用过量异戊醇可缓解此类问题。因为乙酸的强酸性及pH值影响了反应体系微环境,进而改变了脂肪酶的空间结构,使酶的活性位点被“盖”起来,导致酶活性降低[9];在无溶剂体系中,由于没有有机溶剂的“缓冲保护”,这种作用可能更为明显[16]。

图5 乙酸加入次数对酯产率的影响Fig.5 Effect of acetic acid addition times on ester yield
在预制杂醇油3 mL、脂肪酶Novozym 435FG 70 mg、4A分子筛2.0 g,水浴45 ℃、摇床140 r/min,1.5 mL乙酸分6次加入,考察间隔时间对酯香料产率的影响,结果见图6。由图6可知,乙酸加入间隔时间在1~3 h时,高浓度乙酸导致反应体系呈现低pH微环境,显著降低了酶活性,酯产率低;间隔时间3 h以上时,酯产率平缓增加,表明酶法酯化反应需要一定时间的酶与底物充分接触,乙酸间隔时间适当增加,反应底物的消耗,会增加酯产物生成;如果乙酸加入间隔时间短、积累过多,未反应乙酸的累积改变了微环境pH值,会降低酶活性及酯产率。
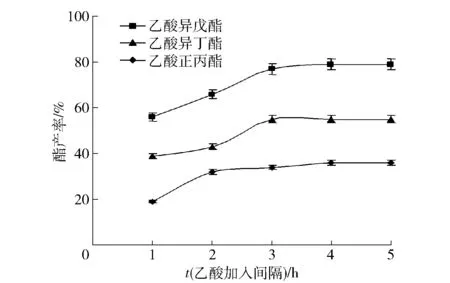
图6 乙酸加入间隔时间对酯产率的影响Fig.6 Effect of addition interval time of acetic acid on ester yield
2.1.5反应温度及反应时间的影响
一般认为酶活力受温度影响较大,酶活力在一定范围内会随着温度提高而增加,固定化脂肪酶热稳定性优于未固定化酶,Novozym 435FG脂肪酶可在60 ℃下保持较好热稳定性。在预制杂醇油3 mL、脂肪酶Novozym 435FG 70 mg、4A分子筛2.0 g,1.5 mL乙酸分6次加入,每次加入间隔时间3 h,摇床140 r/min反应条件下,考察反应温度和时间对酯香料产率的影响,结果分别见图7和图8。由图7可知,在30~50 ℃的温度范围内,酯产率基本相当,说明此温度范围内,酶的刚性结构变化不明显,酶活力和热稳定性变化不大,且45 ℃的酯产率接近高点,反应时间25 h以上时,酯产率已趋于稳定,因此,后续研究选择45 ℃及25 h继续研究。
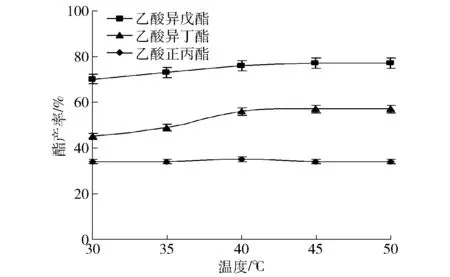
图7 反应温度对酯产率的影响Fig.7 Effect of reaction temperature on ester yield

图8 反应时间对酯产率的影响Fig.8 Effect of reaction time on ester yield
2.1.6摇床转速的影响
摇床转速影响反应体系的传质阻力,研究了不同摇床转速对酯产率的影响,见图9。由图9可知,摇床转速较低时,由于传质阻力的影响,酯产率较低;随着转速提高,体系中底物分散更充分,提高了固定化酶活性位点与反应底物接触概率。摇床速率在140 r/min时,酯产率达到接近最高值,继续提高摇床速度,酯产率升高不显著,可能是由于转速增快,固定化酶活性位点与反应底物接触不充分,导致产量下降。Romeroa等[6]在研究不同酰基供体对酯合成影响的动力学时也有类似结论,摇床转速从100 r/min提升至300 r/min,乙酸异戊酯产量未见提高,其结论与本研究结果也基本一致。

图9 摇床转速对酯产率的影响Fig.9 Effect of shaker speed on ester yield
2.2 影响因素的正交试验优化结果
2.2.1正交试验设计结果与分析
根据单因素实验结果,选择对酯产率影响较大的分子筛加入量、乙酸加入次数、乙酸加入间隔时间及反应时间4个因素,进行正交试验,正交试验设计及结果见表2。由极差(R值)分析可知,无溶剂体系中4个因素对酯产率影响顺序由大到小依次为总反应时间(C)、乙酸加入次数(A)、乙酸加入的间隔时间(B)、分子筛添加量(D)。用SPSS 16.0软件方差分析,发现反应时间、乙酸加入次数对乙酸异戊酯的影响显著(P<0.05),反应时间对乙酸异丁酯、乙酸正丙酯的影响显著(P<0.05)。因此结合直观分析、方差分析的结果,各因素的最佳组合确定为A3B2C3D3,其优化条件为V(杂醇油)3 mL、m(脂肪酶)70 mg、m(分子筛)2 g、1.5 mL的乙酸分6次加入、t(乙酸加入间隔)3 h、反应温度45 ℃、转速140 r/min、t(酯化反应)36 h。

表2 杂醇油酶法制备酯香料的正交试验及结果Tab.2 Orthogonal test and results of preparation of ester aromas by lipase catalysis of fusel oil
2.2.2优化条件结果验证
根据正交试验优化条件,进行3组实验验证,结果见表3。在优化条件下,乙酸异戊酯、乙酸异丁酯、乙酸正丙酯的产率分别为(89.2±0.7)%、(89.3±0.6)%、(76.8±0.9)%。较优化前有一定提高,该结果与前期研究有溶剂正丁烷反应体系中酯产率接近(分别为90.1%、91.3%、78.1%)[16],有利于酯产物的分离提取、节省了有机溶剂。
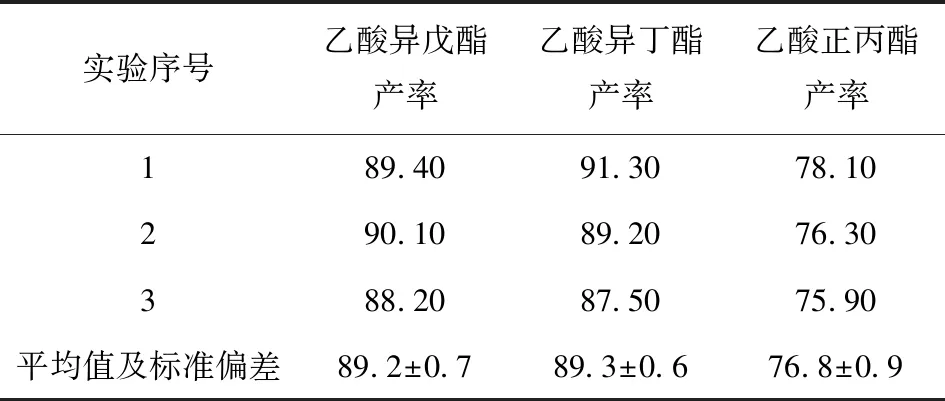
表3 优化条件下杂醇油酶法制备酯香料的产率Tab.3 Yield of ester aromas prepared by lipase catalysis of fusel oil under optimized conditions %
2.3 超声处理对酯香料产率、合成进程及稳定性的影响
2.3.1超声处理对酯产率的影响
以正交试验优化条件为基础,研究考察超声场强(超声频率28、50、135 Hz,单位面积超声功率0.1、0.3、0.5 W/cm2)对酯香料产率的影响,结果分别见图10和图11。由图10可知,在0.1~0.5 W/cm2时,随着单位面积超声功率增大,酯产率明显增加,其中超声频率50 Hz、单位面积超声功率0.5 W/cm2处理6 h时,酯香料产率85%,显著高于其他超声处理实验组,也接近正交试验设计优化条件的反应36 h时酯产率,但超声处理的酯香料最终产量和产率并未见增加。
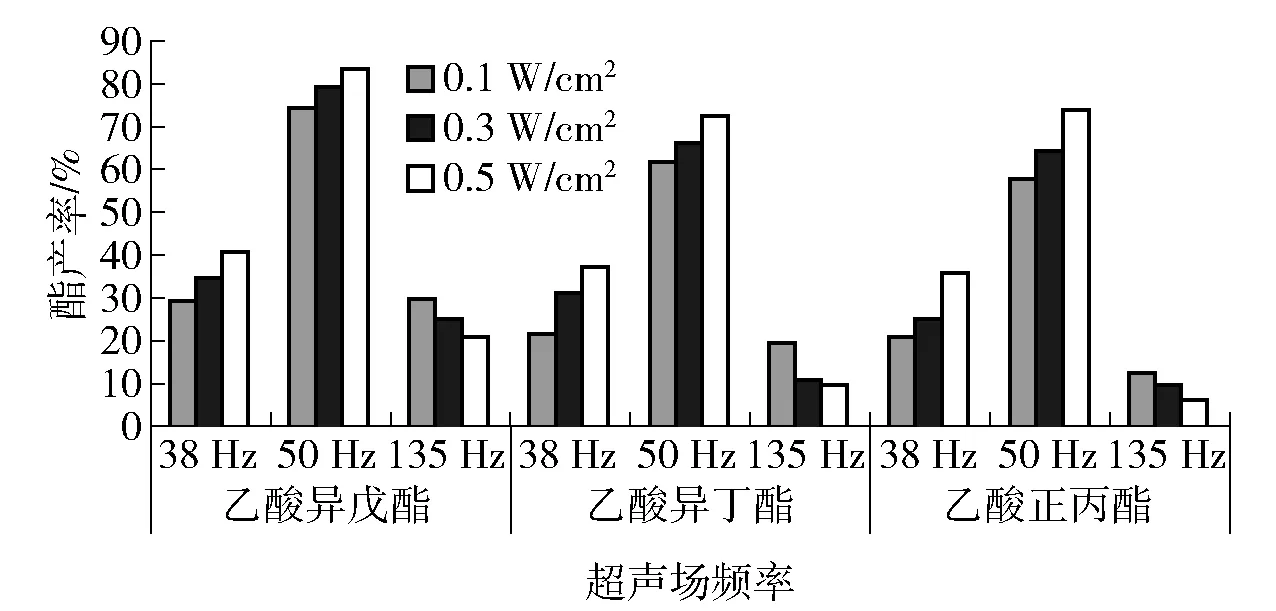
图10 单位面积超声功率和超声频率对酯产率的影响Fig.10 Effect of ultrasonic power per unit area and ultrasonic frequency on ester yield
2.3.2超声处理对酯合成进程的影响
研究不同超声处理对酯合成进程的影响,结果见图11。无溶剂体系中0.5 W/cm2以下的超声处理大大加速了反应进程,显著缩短了反应时间(与摇床条件相比,相同酯产率时其反应时间缩短近30 h)。表明适当超声处理产生的超声空化和升温作用,增强了酶活性中心与底物的充分接触概率、酯化反应加速,但超声频率过高或过低,会改变固定化脂肪酶的活性位点暴露或改变固定化酶孔径,影响酶活性中心与底物接触,尤其在135 Hz高频率下反应溶液出现变浑浊现象,这可能与脂肪酶从固定载体上脱落,而游离酶在高频率下易失活等,导致反应进程变慢。赵江[17]研究非水相酶合成乳酸乙酯时认为超声条件下达到反应平衡时间缩短了20 h,电镜扫描发现超声作用可使固定化脂肪酶的载体表面结构致密度降低,表面变得粗糙,可能使产物和底物的扩散能力增强,使反应速度加快、产率增加。胡爱军等[18]在研究超声酶法制备生物柴油时,发现超声处理的生物柴油产率比静态时提高了27%~32%,比摇床条件的产率提高了9%~12%。但超声频率、超声功率达到多少能改变脂肪酶的分子构象,还未见报道,有待深入研究。

图11 超声处理对酯合成进程的影响Fig.11 Effect of ultrasonic treatment on progress of ester synthesis
2.3.3超声处理对脂肪酶稳定性的影响
实验对比超声条件和摇床条件下的酶使用重复性、稳定性,结果显示,超声处理的脂肪酶反复使用8次,其最高产酯率由80%下降到40%,而摇床产酯率由90%左右下降到60%。超声能量比摇床高很多,长时间空化作用造成高温高压微环境会使脂肪酶的结构发生较大改变,脂肪酶失活速度加快;无溶剂体系中酶活性降低比正己烷等溶剂体系更快[16]。超声处理时体系温度会急剧上升,应采取适当降温措施,保护酶的热稳定性。
3 结 论
研究了无溶剂体系由杂醇油酶法制备天然等同酯香料的方法,并对影响因素进行了优化。结果表明,固定化脂肪酶Novozym 435FG在无溶剂体系中的酯化活力高,其乙酸异戊酯产率达到92.62%;分子筛、乙酸加入次数和间隔时间、反应温度和时间、摇床转速及超声处理等对酯化反应速率及酯香料产率有一定影响。较优的酯化工艺条件为V(杂醇油)3 mL、m(脂肪酶)70 mg、m(分子筛)2 g、1.5 mL的乙酸分6次加入、t(乙酸加入间隔)3 h、反应温度45 ℃、转速140 r/min、t(酯化反应)36 h,在该条件下杂醇油酶转化乙酸异戊酯、乙酸异丁酯、乙酸正丙酯的产率分别达到(89.2±0.7)%、(89.3±0.6)%、(76.8±0.9)%。在超声频率50 Hz、单位面积超声功率0.5 W/cm2处理6 h的酯香料产率达到85%,适当超声处理可大大加速酯化反应进程,显著缩短反应时间,但超声处理对酯香料最终产率并未增加;长时间超声空化作用造成体系微环境改变,固定化脂肪酶的稳定性降低,酶失活速度加快。
