博来霉素诱导建立硬皮病模型小鼠的肠道受累情况分析研究▲
2021-06-07周雪艳吕军影
周雪艳 吕军影
广西医科大学第一附属医院,南宁市 530021
硬皮病又称系统性硬化症,是一种以皮肤及各系统(特别是肺、心脏、肠道、骨骼肌和肌腱)胶原纤维硬化为特征的结缔组织疾病。硬皮病发病机制复杂,患者常伴有多器官损害,5年生存率为50%,目前被认为是不治之症,是所有风湿病中病亡率最高的疾病[1]。肠道是硬皮病患者最常累及的器官,约90%的硬皮病患者出现肠道症状[2-4]。硬皮病患者肠道并发症主要表现为食管运动障碍、胃瘫、小肠细菌过度生长、结肠运动障碍和大便失禁等,严重影响患者的生活质量,给患者家庭带来沉重的经济压力和心理负担。为探讨硬皮病的发病机制、病理生理过程和治疗手段等,学界就硬皮病进行了较多的基础实验研究和探索,但建立的硬皮病动物模型大多是模拟硬皮病的皮肤和肺部症状,而硬皮病肠道并发症动物建模的研究鲜有报道。为更好地研究硬皮病及其肠道并发症,构建一种与临床吻合度高且便捷、稳定、可复制的硬皮病肠道并发症动物模型,本研究采用博来霉素诱导雌性BALB/c小鼠建立了硬皮病小鼠模型,并探讨了小鼠肠道并发症的病理特征,现将结果报告如下。
1 材料与方法
1.1 材料
1.1.1 实验动物 雌性BALB/c小鼠20只,SPF级,6~8周龄,体重18~22 g,购自湖南斯莱克景达实验动物有限公司。将小鼠饲养于广西医科大学实验动物中心,让小鼠生活于安静、恒温、恒湿的环境中,自由饮水进食。实验方案及操作经广西医科大学动物实验委员会审查批准,符合实验动物伦理学要求。
1.1.2 主要实验试剂 注射用博来霉素磷酸盐缓冲液(浙江海正药业股份有限公司,批号:H20055883); HE染色和Masson染色试剂(来自广西医科大学免疫组化实验室);OLYMPUS正置四色荧光显微镜(日本Olympus公司,型号BX53)。
1.2 方法
1.2.1 动物分组及处理 将20只雌性BALB/c小鼠随机分为对照组和模型组,每组10只,用电动剃毛器剃除小鼠背部中央区相同部位面积约2 cm×2 cm的被毛。在对照组小鼠背部脱毛区皮下注射磷酸盐缓冲液(PBS)0.1 mL,1次/d;在模型组小鼠背部脱毛区皮下注射博来霉素磷酸盐缓冲液(500 μg/mL)0.1 mL,1次/d。两组小鼠均连续皮下注射4周[5]。注射结束后第2天开始,两组小鼠禁食不禁水24 h,之后给予每只小鼠半固体营养糊(黑芝麻糊与碳素墨水加水搅拌均匀,配成约75 g的黑色糊状物75 mL)0.5 mL灌胃,灌胃后20 min后脱颈处死小鼠。
1.2.2 模型处理和分析 (1)剪开两组脱颈处死小鼠腹腔,用细线分别在胃贲门和幽门处结扎,迅速分离胃贲门处至回肠末端胃肠。轻轻剥离肠系膜后,轻轻将胃肠铺直于实验台上,避免用力拉扯,用尺子测量幽门到黑色半固体糊前沿的距离和幽门至回盲部的小肠全长。(2)取两组脱颈处死小鼠背部注射部位的皮肤、肺组织、结肠组织,放入10%多聚甲醛溶液中固定,脱水、石蜡包埋,4 μm厚连续切片,进行HE染色和Masson染色。
1.3 观察指标
1.3.1 小鼠一般情况 造模第4周开始,观察比较两组小鼠的活动度、皮肤、毛发、体重、粪便等一般情况。
1.3.2 小肠推进率 小肠推进率=幽门至黑色半固体糊前沿的距离/幽门至回盲部全长的距离×100%。
1.3.3 组织病理学观察 光学显微镜下观察两组小鼠背部注射部位皮肤、肺组织、结肠组织切片的结构、炎性浸润情况、纤维化情况。
1.4 统计学处理 采用SPSS 23.0统计学软件进行数据分析。计量资料以x±s表示,两组间均数的比较采用独立样本t检验,以P<0.05为差异有统计学意义。
2 结 果
2.1 两组小鼠的一般情况比较 模型建立过程中无小鼠死亡。造模第4周,对照组小鼠精神良好,反应灵敏,进食和饮水量正常,未见消瘦,背部注射区皮肤无硬化,毛发柔软且有光泽,生长迅速,大便形状正常、量适中;模型组小鼠精神差,喜静懒动,厌食消瘦,背部注射区皮肤增厚变硬、弹性差且与皮下组织粘连,毛发未见生长,大便干结、量偏少。
2.2 两组小鼠的皮肤组织病理学比较 HE染色:对照组小鼠皮肤组织结构完整,真皮下可见毛囊,无明显炎症细胞浸润(见图1-A);模型组小鼠皮肤表皮棘层肥厚,真皮层明显增厚,皮肤附属脂肪层、肌肉层萎缩,周围可见炎症细胞浸润(见图1-B)。Masson染色:对照组小鼠皮肤胶原纤维未见明显增生(见图1-C);模型组小鼠皮肤胶原纤维明显增粗、膨大、数量增多、排列紧密、均质化(见图1-D)。
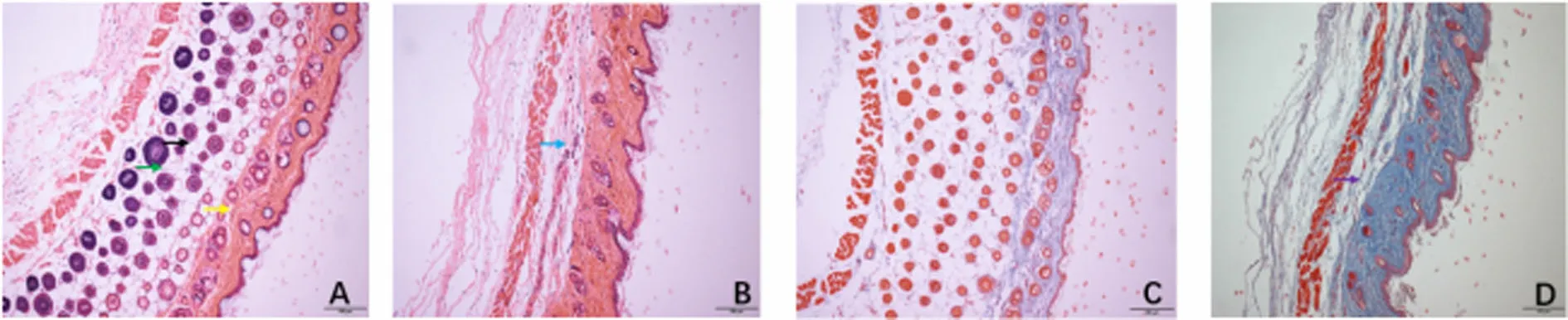
对照组(HE染色) 模型组(HE染色) 对照组(Masson染色) 模型组(Masson染色)
2.3 两组小鼠的肺组织病理学比较 HE染色:对照组小鼠肺部结构完整,肺泡间隔正常,无出血症状,支气管壁和小血管壁厚度正常,无明显细胞浸润现象(见图2-A);模型组小鼠肺部结构破坏,肺泡间隔增厚,肺泡内出血,小血管壁增厚,出现以淋巴细胞为主的炎症细胞浸润(见图2-B)。Masson染色:对照组小鼠肺间质、肺泡和支气管壁未见有蓝色胶原纤维大量沉积(见图2-C);模型组小鼠肺间质、肺泡和支气管壁纤维性增厚,胶原束在肺泡或血管内沉积,蓝色胶原纤维明显增多(见图2-D)。
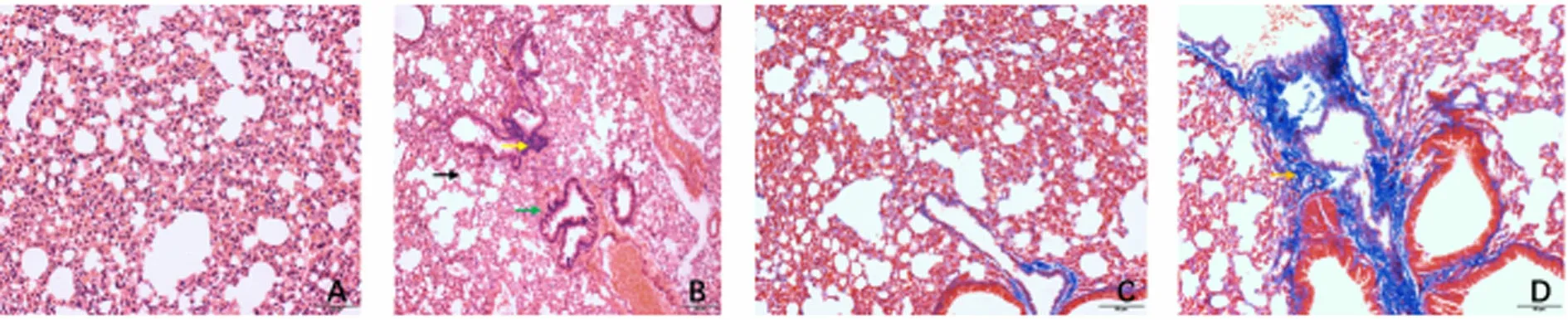
对照组(HE染色) 模型组(HE染色) 对照组(Masson染色) 模型组(Masson染色)
2.4 两组小鼠的结肠组织病理学比较 HE染色:对照组小鼠结肠黏膜上皮完整,腺体连续,结构清晰,固有层无炎性浸润(见图3-A);模型组小鼠结肠黏膜上皮结构破坏,腺体紊乱,固有层大量炎性细胞浸润(见图3-B)。Masson染色:对照组小鼠结肠肌层未见细胞间结合部位裂缝减少及胶原浸润、纤维化病理改变(见图3-C);模型组小鼠结肠平滑肌萎缩,大量胶原浸润,纤维化改变(见图3-D)。
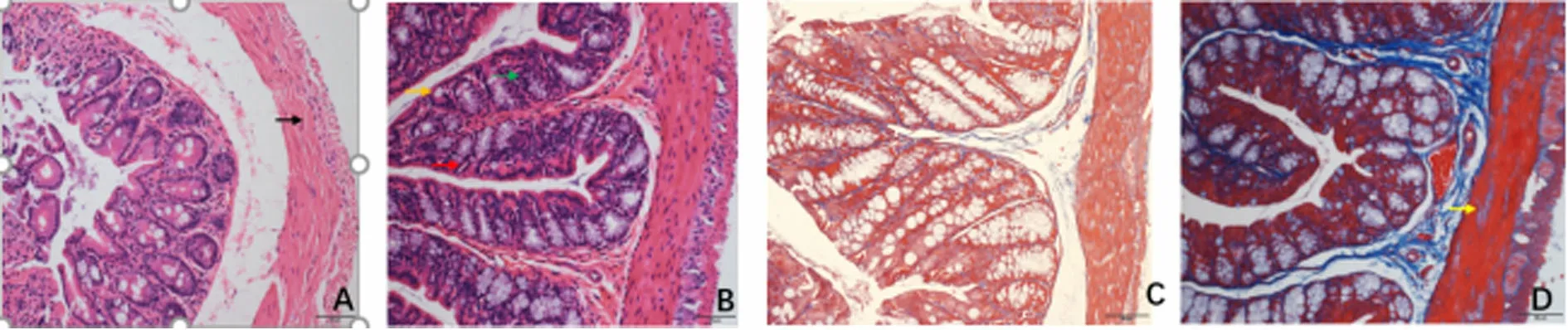
对照组(HE染色) 模型组(HE染色) 对照组(Masson染色) 模型组(Masson染色)
2.5 两组小鼠的小肠推进率比较 模型组小鼠的小肠推进率为(45.78±4.98)%,对照组小鼠的小肠推进率为(62.13±9.00)%,两组比较差异有统计学意义(t=5.027,P=0.000)。
3 讨 论
硬皮病又称系统性硬化症,是一种慢性自身免疫性疾病,炎症、血管病变和纤维化是其主要病理特征,最终可导致患者内脏功能丧失。硬皮病患者除表现为皮肤纤维化外,还会影响肺、心、肾、血管和肌肉骨骼系统,其并发症最易发生在肠道系统,结肠和肛门直肠区域受累者约占全部患者的50%~70%,主要表现为肠道动力减弱、贫血、肠道出血甚至肠道穿孔,同时伴大便异常[6]。肠道穿孔具有致命性,是硬皮病患者病亡率较高的主要原因;排便功能的异常如便秘、难以控制的腹泻等也会给患者的生活质量和精神健康造成巨大影响[7]。硬皮病患者的肠道病变部位多发生在其固有肌层,表现为进行性炎症浸润,平滑肌萎缩、破坏,肌层组织胶原浸润和纤维化。目前硬皮病患者肠道并发症的发病机制仍未明了,动物实验模型的建立研究已成为硬皮病基础研究的热门课题[8]。
现有硬皮病动物模型主要有诱导型(博来霉素诱导模型、活性氧簇性氧离子诱导模型、V型胶原重塑模型等)和基因型(Fra-2转基因小鼠、TBRICA转基因小鼠、Cre-ER转基因小鼠、TβRII△k转基因小鼠、Caveolin-1转基因小鼠等),模型动物主要有鼠、鸡、兔,其中鼠类模型的组织硬化与人类硬皮病的相似度较高。博来霉素诱导的硬皮病模型成本较低,重现性和维持能力较好,组织纤维化、胶原沉积、炎症反应方面的表现良好,是目前造模研究的主选模型。张瑞等[9]报道,博来霉素诱导的硬皮病小鼠模型,其胃肠蠕动减慢、便秘、腹泻方面的表现与临床上硬皮病患者表现的吻合度约为72%。为此,本研究采用博来霉素诱导建立硬皮病小鼠模型,并对小鼠模型肠道并发症的病理特征等进行了观察和分析,旨为建立良好的硬皮病胃肠并发症动物模型提供参考。
建模观察分析结果显示,硬皮病胃肠并发症模型小鼠出现胃肠动力减退、大便干结等症状;小鼠皮肤表皮棘层肥厚,真皮层明显增厚,皮肤附属脂肪层、肌肉层萎缩,炎症细胞浸润,胶原纤维明显增粗、膨大、数量增多、排列紧密、均质化;肺部结构破坏,肺泡间隔增厚,肺泡内出血,小血管壁增厚,出现以淋巴细胞为主的炎症细胞浸润,肺间质、肺泡和支气管壁纤维性增厚,肺泡或血管内胶原束沉积,蓝色胶原纤维明显增多,微血管减少;结肠黏膜上皮结构破坏,腺体紊乱,固有层大量炎性细胞浸润,平滑肌萎缩,大量胶原浸润,发生纤维化改变;小肠推进率明显降低。结果提示,博来霉素诱导建立的硬皮病小鼠模型,可有效模拟临床硬皮病患者的肠道并发症,为硬皮病胃肠并发症的深入研究奠定良好基础。
