随机尿游离型NMN、MN HPLC-ED检测方法的建立和临床应用
2021-06-07邹文毕王浩然张晓清
张 磊, 左 明, 邹文毕, 王浩然, 张晓清, 丁 敏
(1. 重庆医科大学附属第一医院医学检验科,重庆 400016;2. 重庆医科大学附属第二医院核医学科实验室,重庆 400016;3.重庆医科大学临床检验诊断学教育部重点实验室,重庆 400016)
嗜铬细胞瘤和副神经节瘤(pheochromocytoma and paraganglioma,PPGL)是起源于肾上腺髓质和肾上腺外交感神经系统的内分泌肿瘤,以分泌大量儿茶酚胺为特征,典型表现为“心悸、大汗、头痛”三联征和继发性高血压等[1]。PPGL最大的危害是并发高血压危象、急性左心功能衰竭和脑出血,严重者可危及生命[2]。有研究结果显示,甲氧基肾上腺素类物质,包括甲氧基去甲肾上腺素(normetanephrine,NMN)、甲氧基肾上腺素(metanephrine,MN)是诊断PPGL最好的指标[3]。目前,临床上常用的诊断嗜铬细胞瘤的方法是检测血浆游离型NMN、MN[4-5],但血浆游离型NMN、MN检测易产生假阳性结果[6]。有研究结果显示,24 h尿总NMN和总MN对嗜铬细胞瘤诊断的特异性优于血浆游离型NMN 、MN[7]。然而,在体内代谢过程中,总甲氧基肾上腺素类物质易受外源性和神经源性儿茶酚胺等因素的影响。此外,24 h尿存在收集困难、尿量计算不准确、患者依从性差等缺点。随机尿的采集方便、快速,患者依从性好,能够在门诊广泛普及。因此,本研究拟建立检测随机尿和血浆游离型NMN、MN浓度的高效液相色谱-电化学(high performance liquid chromatographyelectrochemical detection,HPLC-ED)方法,并评估其临床价值。
1 材料和方法
1.1 研究对象
选取2014年7月—2016年6月重庆医科大学附属第一医院确诊的嗜铬细胞瘤患者35例(嗜铬细胞瘤组,其中男15例、女20例,年龄15~71岁)、原发性高血压患者70例(高血压组,其中男34例、女36例,年龄16~72岁)、非嗜铬细胞瘤肾上腺占位患者78例(肾上腺占位组,其中男38例、女40例,年龄27~73岁)。嗜铬细胞瘤经过组织学检查或术后病理诊断证实;非嗜铬细胞瘤肾上腺占位经过组织学检查或者术后病理诊断证实;原发性高血压的确诊包括3个方面:(1)经B超或电子计算机断层扫描(computed tomography,CT)等影像学检查未发现占位现象;(2)经相关检查排除因其他疾病导致的继发性高血压;(3)患者在随后的1年内未出现任何相关的PPGL阳性结果(影像学、生化检测、病理检查等)。另选取同期重庆医科大学附属第一医院体检健康者44名(正常对照组),其中男20名、女24名,年龄15~73岁。所有研究对象均经血浆游离型NMN、MN筛查[9],且肝功能、肾功指标均无明显异常。
1.2 仪器与试剂
Waters 1525高效液相色谱仪(美国Waters公司),包括Waters 1525泵、Waters 2465电化学检测器和Waters 2707自动进样器。ZORBAX SB-C18色谱柱(3 mm×100 mm,3.5 μm;美国Agilent公司),C18保护柱(4 mm×3 mm,5 μm;美国Phenomenex公司),SampliQ Silica SCX萃取小柱(100 mg/mL,美国Agilent公司),Milli-Q超纯水机(美国Millipore公司)。NMN、MN和4-羟基-3-甲氧基苄胺盐酸盐(4-hydroxy-3-methoxybenzylamine hydrochloride,HMBA)标准品购自美国Sigma公司。甲醇和乙腈均为色谱纯(美国Tedia公司),其他试剂均为国产分析纯。
1.3 样本采集及处理
嘱所有对象在样本采集前5 d禁服对乙酰氨基酚类药物和抗抑郁类药物,样本采集前1 d禁食香蕉、浓茶和咖啡等,样本采集时先静息15 min,然后采用预冷的5 mL肝素抗凝管采集所有对象空腹静脉血4 mL,采集后立即冰上保存,以4 100×g离心5 min,分离血浆,-80 ℃保存,统一检测。血浆样本的采集、分离和保存需在2 h内完成。另收集所有对象10 mL随机尿,分装后-80 ℃保存,统一检测。所有对象的血浆和随机尿均为同时收集。
取200 μL随机尿,加入超纯水5 mL、0.2 mol/L醋酸200 μL、100 μg/L HMBA(内标)100 μL,混匀。采用10%氨水-甲醇(V∶V=1∶3)5 mL、10 g/L KOH-甲醇溶液2 mL、超纯水2 mL依次活化萃取小柱,将上述混匀样本上样,流速为1~2 mL/min。用10 mmol/L醋酸-甲醇溶液(V∶V=9∶1)2 mL、10 mmol/L磷酸铵溶液2 mL,超纯水2 mL依次淋洗萃取小柱。用2 mL 氨水-甲醇溶液洗脱。将洗脱液真空旋干,用0.2 mol/L醋酸溶液200 μL复溶,取50 μL进样检测。随机尿肌酐(creatinine,Cr)浓度采用BS-380全自动生化分析仪(深圳迈瑞公司)及配套试剂检测。血浆样本的预处理步骤参照文献[8]进行。
1.4 色谱条件
流动相为0.10 mol/L磷酸二氢钠(pH值3.2,含0.40 mmol/L 乙二胺四乙酸二钠和0.50 mmol/L辛烷磺酸钠)与乙腈的混合溶液(V∶V=95.5∶4.5)。流速为0.6 mL/min,柱温为30 ℃,电化学检测器检测电压为+0.85 V,进样量为50 μL,分析时间为18 min。
1.5 方法学评价
1.5.1 线性范围 将20 μL不同浓度的NMN和MN标准溶液(均为250、2 000、5 000、10 000、15 000、20 000、25 000 μg/L)加入180 μL正常对照者的混合尿液中,配置成系列浓度(25、200、500、1 000、1 500、2 000、2 500 μg/L)的工作液,按尿液样本处理及检测步骤进行处理并检测。以待测物峰面积/内标峰面积比值与基质中待测物峰面积/内标峰面积比值的差值为Y,标准品浓度为X,进行线性回归分析。
1.5.2 检测限 分别对250 μg/LNMN标准品溶液和250 μg/L MN标准品溶液进行倍比稀释,分别配制成50.00、25.00、12.50、6.25 μg/L标准品溶液,将测出的信号与空白样本的信号进行比较,以信噪比(signal-to-noise ratio,RSN)=3时对应的浓度为检测限。
1.5.3 精密度 选取嗜铬细胞瘤患者混合尿液(高浓度)和正常对照者混合尿液(低浓度),日内重复测定5次,连续测定5 d,进行精密度评估。
1.5.4 回收实验 在正常对照者混合尿液中分别添加低(25 ng/L)、中(625 ng/L)、高(1 250 ng/L)3个浓度的NMN、MN混合标准品,测定加标前后NMN和MN的浓度,每个浓度平行测定3次,计算相对回收率,计算公式为:相对回收率(%)=(加入标准品的样本浓度-未加入标准品的样本浓度)/加入标准品浓度×100%。
1.5.5 初步临床应用 采用建立的HPLC-ED法检测正常对照组、高血压组、肾上腺占位组及嗜铬细胞瘤组随机尿和血浆游离型NMN、MN浓度。同时检测尿Cr,计算尿NMN/Cr比值和尿MN/Cr比值。
1.6 统计学方法
采用SPSS 22.0软件和GraphPad Prism 5.01软件进行统计分析。呈非正态分布的数据以中位数(M)[四分位数(P25~P75)]表示,多组间比较采用非参数Kruskal-Wallis检验,2个组之间比较采用Mann-Whitney U检验。采用受试者工作特征(receiver operating characteristic,ROC)曲线评估各项指标诊断嗜铬细胞瘤的效能。以P<0.05为差异有统计学意义。
2 结果
2.1 方法学评价
2.1.1 线性范围 HPLC-ED法检测NMN和MN的线性范围均为25~2 500 μg/L。NMN的回归方程为Y=0.023X-0.139(r=0.999),MN的回归方程为Y=0.016X-0.075(r=0.999)。
2.1.2 检测限 以RSN=3时对应的浓度为检测限,NMN和MN的检测限分别为5.9 μg/L和11.3 μg/L。
2.1.3 精密度验证 NMN高、低2个浓度的批内CV分别为3.7%和2.2%,批间CV分别为5.6%和3.3%;MN高、低2个浓度批内CV分别为4.3%和2.7%,批间CV分别为5.1%和3.4%。见表1。
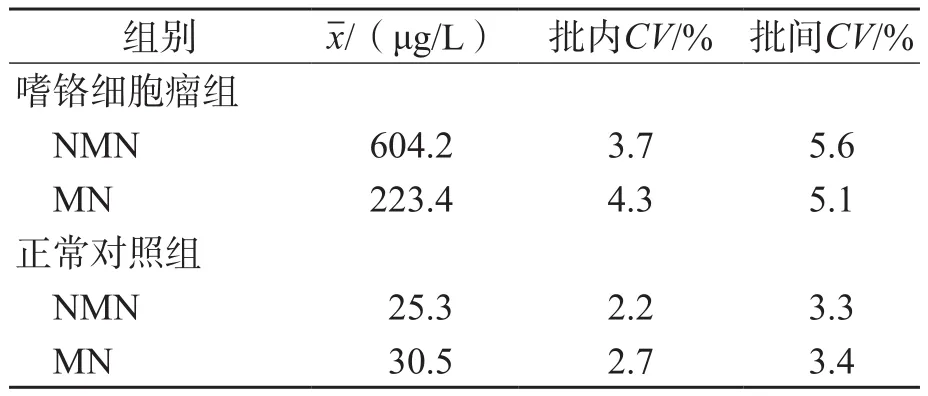
表1 精密度验证结果
2.1.4 回收实验 随机尿样本中NMN和MN的平均回收率为92.8%~103.4%。见表2。

表2 回收实验结果
2.2 各组随机尿及血浆游离型NMN、MN浓度检测
嗜铬细胞瘤组随机尿游离型NMN、MN浓度和尿NMN/Cr比值、尿MN/Cr比值明显高于高血压组、肾上腺占位组及正常对照组(P<0.001),高血压组、肾上腺占位组及正常对照组之间差异均无统计学意义(P>0.05)。嗜铬细胞瘤组血浆游离型NMN和MN浓度明显高于高血压组、肾上腺占位组及正常对照组(P<0.001)。见表3。HPLC-ED法检测随机尿游离型NMN、MN的色谱图见图1。
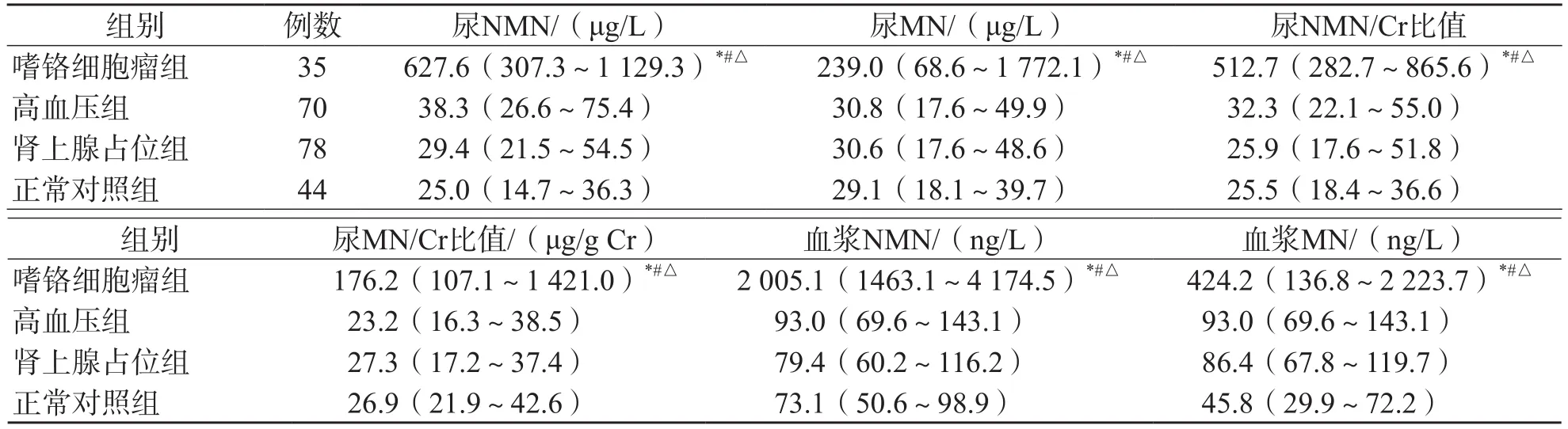
表3 各组随机尿和血浆游离型NMN、MN浓度及尿NMN/Cr比值、尿MN/Cr比值比较 M(P25~P75)
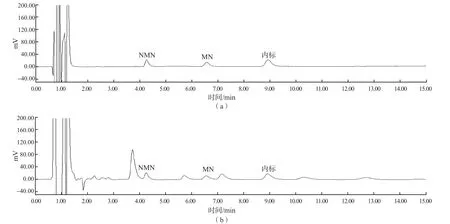
图1 HPLC-ED法检测随机尿游离型NMN、MN的色谱图
2.3 随机尿和血浆游离型NMN、MN诊断嗜铬细胞瘤的效能
ROC曲线分析结果显示,随机尿游离型NMN、随机尿游离型MN、尿NMN/Cr比值、尿MN/Cr比值、血浆游离型NMN、血浆游离型MN诊断嗜铬细胞瘤的曲线下面积(area under curve,AUC)分别为0.91、0.88、0.96、0.94、0.93和0.88。尿NMN/Cr比值和尿MN/Cr比值诊断嗜铬细胞瘤的最佳临界值分别为122.5和65.0 μg/g Cr,敏感性均为85.7%,特异性分别为98.3%、95.0%。血浆游离型NMN和MN诊断嗜铬细胞瘤的最佳临界值分别为431.4和131.2 ng/L,敏感性分别为82.9%、80.0%,特异性分别为92.7%、84.4%。见表4、图2。
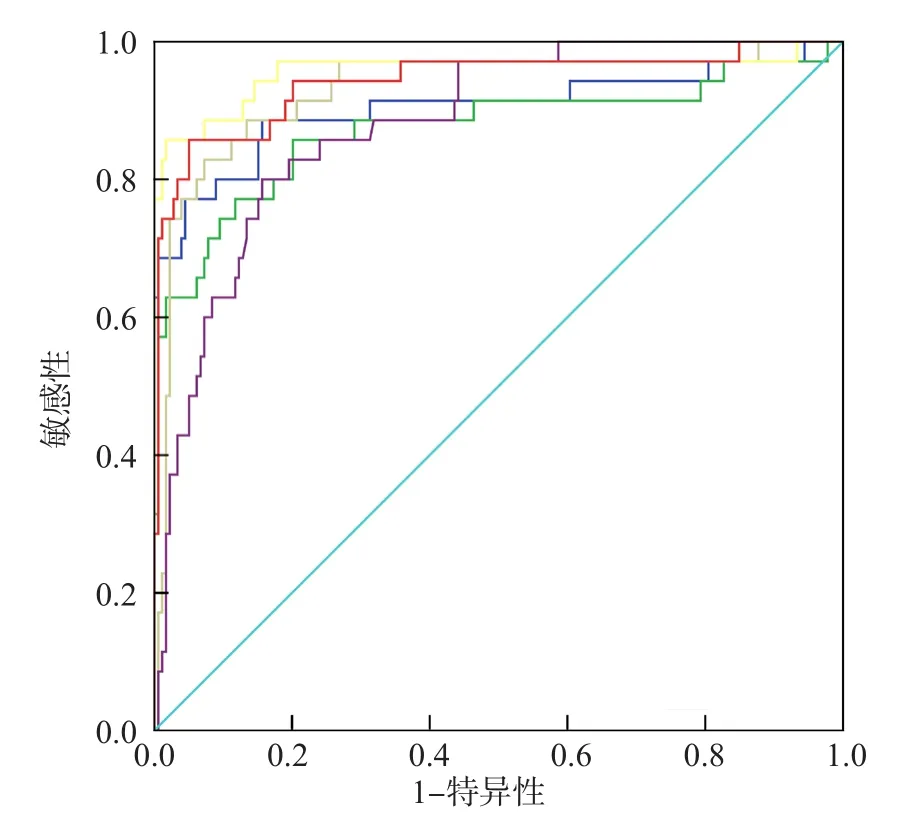
图2 随机尿和血浆游离型NMN、MN和尿NMN/Cr比值、尿MN/Cr比值诊断嗜铬细胞瘤的ROC曲线
在70例原发性高血压患者(阴性对照)中,有13例患者血浆游离型NMN、MN浓度高于最佳临界值,有4例患者的随机尿游离型NMN、MN浓度高于最佳临界值。
2.4 嗜铬细胞瘤患者术前、术后随机尿和血浆游离型NMN、MN浓度的变化
35例嗜铬细胞瘤患者中,有15例患者在术后1周检测了随机尿和血浆游离型NMN、MN浓度。结果显示,嗜铬细胞瘤患者术后1周,尿MN/Cr比值均降为正常,有2例患者术后血浆MN浓度高于术前,有1例患者术后血浆NMN浓度高于术前。见图3。
3 讨论
嗜铬细胞瘤与儿茶酚胺的分泌密切相关。嗜铬细胞瘤细胞合成的儿茶酚胺主要包括去甲肾上腺素(norepinephrine,NE)和肾上腺素(epinephrine,E)。NE和E中的一部分直接由肿瘤细胞分泌进入血液,另一部分在肿瘤细胞儿茶酚-O-甲基转移酶(catechol-O-methyltransferase,COMT)的作用下分别生成游离型NMN和MN,统称为甲氧基肾上腺素类物质。这些游离型NMN、MN由肿瘤细胞缓慢分泌进入血液循环[9],血液中游离的NMN、MN可以通过肾脏由尿液直接排出,或在肝脏通过单胺氧化酶(monoamine oxidase,MAO)代谢生成终末代谢产物香草扁桃酸(vanillylmandelic acid,VMA),随尿液排出体外。此外,游离型NMN、MN还可以在胃肠道器官经磺基转移酶作用生成硫酸结合型NMN和硫酸结合型MN,然后经尿液排出体外[10]。因此,血浆和尿液中游离型NMN、MN直接来源于肿瘤细胞,其水平的增高是儿茶酚胺长期大量合成的结果,能反映嗜铬细胞瘤患者儿茶酚胺合成的情况。
在本研究70例原发性高血压患者(阴性对照)中,有13例患者血浆游离型MN浓度高于最佳临界值,有4例患者的随机尿游离型MN浓度高于最佳临界值,血浆游离型MN的假阳性率为18%(13/70),而随机尿游离型MN的假阳性率为6%(4/70)。这提示服用降压药物也是影响嗜铬细胞瘤诊断的一个重要因素,而尿液游离型NMN、MN检测受上述因素影响较小,比血浆游离型NMN、MN更能反映嗜铬细胞瘤患者儿茶酚胺的代谢情况。本研究结果显示,尿NMN/Cr比值和尿MN/Cr比值诊断嗜铬细胞瘤的特异性分别为98.3%和95.0%,明显高于血浆游离型NMN、MN检测,与文献报道[6]基本一致。
本研究结果还显示,15例嗜铬细胞瘤患者术后随机尿和血浆游离型NMN、MN浓度均出现了不同程度的下降,随机尿游离型NMN、MN浓度和随机尿NMN/Cr比值、随机尿MN/Cr比值的下降幅度比血浆游离型NMN、MN浓度更大。由于血浆游离型NMN、MN易受外界因素影响,因此其下降的幅度小于随机尿游离型NMN、MN。在本研究中,有2例患者术后血浆游离型NMN、MN出现了较术前升高的现象,极易对临床的术后评估产生干扰。因此,相对于血浆游离型NMN、MN,随机尿游离型NMN、MN能更准确地反映嗜铬细胞瘤术后效果。
综上所述,本研究建立了检测随机尿游离型NMN、MN浓度的HPLC-ED方法,该法具有良好的灵敏度和回收率。尿NMN/Cr比值和尿MN/Cr比值诊断嗜铬细胞瘤的效能均优于血浆游离型NMN、MN,在嗜铬细胞瘤的术后评估中也有较好的价值。由于本研究的样本量较小,检测时间较长(从样本处理到报告结果需要8 h),因此后续除扩大样本量,进一步验证本研究结论外,还要对检测流程进行优化,以缩短检测时间,更好地服务于临床。
