MiR-34a可双向调控感染及非感染状态成骨样细胞的成骨分化
2021-06-05高涵林崇韬
高涵 林崇韬
牙周炎是发生于牙齿周围组织的慢性炎症性疾病,以牙龈卟啉单胞菌(porphyromonas gingivalis,Pg)为代表的牙周致病菌可以分泌多种毒力因子,激发宿主固有免疫应答,引起炎症性牙槽骨吸收[1]。牙周炎导致的结缔组织丧失与牙槽骨吸收已成为成人失牙的首要原因,严重影响患者生活质量。因此,抑制炎症进程中牙槽骨吸收并促进牙槽骨再生有着重要意义。
MicroRNAs是在真核生物中发现的一类内源性具有调控功能的非编码RNA,研究显示很多miRNA可以调节骨发育,成骨分化,及骨质疏松等病理生理进程[2],其中miR-34a是较受关注的miRNA之一,其编码基因位于染色体1p36.23区域[3]。近年来研究人员发现miR-34a可以促进间充质干细胞的成骨分化,并且体内实验证实miR-34a可以促进大鼠颅骨缺损区新骨形成[4,5]。另有研究提示miR-34a可能具有抗炎作用,例如Jiang[6]等证明巨噬细胞中脂多糖(lipopolysaccharide,LPS)诱导的炎症应答反应受miR-34a抑制,Ogata[7]等发现炎症牙龈组织中miR-34a表达量是健康牙龈组织的0.51倍。为此,我们设计本实验旨在探索miR-34a是否具有促进骨形成、抑制炎性牙槽骨吸收的作用。
资料和方法
1.主要材料和仪器:Pg W83(首都医科大学口腔医学院口腔医学研究所惠赠),MG63细胞(ATCC®CRL-1427TM),Lipofectamine2000(Invitrogen公司,美国),miR-34a拟态物及阴性对照(吉玛公司,苏州),RNA提取试剂盒(Magen公司,广州),普通逆转录及实时定量PCR试剂盒(Takara公司,日本),miR-34a特异性逆转录及实时定量PCR试剂盒(吉玛公司,苏州),胰酶(Hyclone公司,美国),HG-DMEM培养基(Hyclone公司,美国),胎牛血清(PAA公司,奥地利),厌氧菌培养皿(康泰公司,温州),脑心浸液(Gibco公司,美国)。
2.细胞培养:复苏MG63细胞于HG-DMEM培养基(含10%胎牛血清和1%双抗)中,置入培养箱中培养(5% CO2,37℃),每隔2天观察细胞生长状态并换液,待细胞约铺满底面积80%时按1:3传代。
3.细菌培养:复苏Pg模式株W83并划线法接种于厌氧菌培养皿中,37℃厌氧(80% N2,10% H2,10% CO2)培养一周。挑取单个菌落接种于液体培养基中,置厌氧环境中培养48h后达对数生长期时离心收集细菌,PBS洗涤并重悬,分光光度计测量于600nm处吸光度值,以感染复数MOI=100∶1感染细胞。
4.转染:以3×105细胞/孔为密度接种MG63细胞于6孔板,孵育24h后按试剂盒说明书进行转染。转染步骤简述如下:转染前用1.5ml无血清培养液饥饿各组细胞30min,将5ul的Lipofectamine2000和5ul的miR-34a mimics、miR-34a mimic NC分别稀释于250ul无血清培养液中,室温静置5min后将二者轻柔混匀,再静置20min后加入相应组别中,放入培养箱孵育6h后更换为有血清培养液,继续培养进行后续实验。
5.荧光照相:将miR-34a FAM转染MG63细胞,转染方法如前,转染后放入培养箱孵育6h后弃液,PBS轻轻冲洗,调节倒置荧光显微镜至激发光为蓝光,镜下观察转染后细胞的荧光。
6.荧光定量PCR:收集各组细胞后按试剂盒要求提取总RNA并逆转录为cDNA,利用相应RT-PCR试剂盒进行PCR扩增,检测miR-34a及其内参U6基因表达量的PCR反应程序为95℃预变性3min后,95℃12s,62℃40s共40个循环,检测成骨相关因子基因表达量的PCR反应程序为95°C预变性30s后,95℃5s,60℃20s共40个循环。每组目的基因相对于对照组的表达量以2-ΔΔct(ct值表示达到检测荧光阈值时的循环数)表示。引物序列见表1。

表1 RT-PCR引物基因序列
7.统计分析:应用SPSS 17.0软件进行统计学分析,行组间配对t检验,检验水准为双侧α=0.05。以P<0.05为有统计学差异,P<0.01为有显著统计学差异。
结 果
1.荧光显微镜下观察转染效果:向健康MG63细胞中转染FAM标记的miR-34a拟态物,6h后置于倒置激发光为蓝光的荧光显微镜下观察,可见明显绿色荧光(图1)。
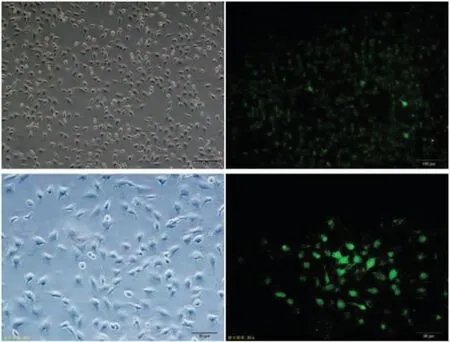
图1 荧光显微镜下观察转染效果(×40,×100)
2.将miR-34a拟态物转染至MG63细胞内,转染后miR-34a拟态物组成骨相关因子mRNA表达量升高:向MG63细胞中转染miR-34a拟态物及其阴性对照物48h、72h后,RT-PCR检测发现实验组较阴性对照组中miR-34a基因表达量明显升高,表明miR-34a模拟物成功转染至实验组(图2A,miR-34a vs NC:*P<0.05,**P<0.01)。
为明确miR-34a对成骨样细胞成骨分化的影响,我们向MG63细胞中分别转染miR-34a拟态物及其阴性对照物,并检测两组细胞中特异性成骨相关因子Runx2、SP7及COLⅠ基因表达水平。实验结果表明,与阴性对照组相比,实验组转染miR-34a拟态物48h、72h后,细胞内成骨标志因子基因表达水平均较对照组高(图2B,miR-34a vs NC:*P<0.05,**P<0.01)。
3.感染MG63细胞中miR-34a表达水平升高,且向这种感染细胞中转染miR-34a拟态物后,成骨相关因子mRNA表达量降低:对受Pg感染48及72h的MG63细胞进行RT-PCR检测,发现感染细胞中miR-34a表达量较对照组高(图3A,Pg vs Control:*P<0.05,**P<0.01)。

图2 A:转染miR-34a拟态物48及72h后,RT-PCR检测细胞中miR-34a表达水平;B:转染48,72h后,COLⅠ、Runx2及SP7基因表达水平

图3 A:受Pg感染48及72h后,MG63细胞中miR-34a表达水平;B:转染48,72h后,受感染细胞中COLⅠ、Runx2及SP7基因表达水平
向受Pg感染的MG63细胞中转染miR-34a拟态物及其阴性对照物,RT-PCR检测发现48及72h时间点实验组细胞内成骨相关因子基因表达水平均较对照组低(图3B,miR-34a+Pg vs NC+Pg:*P<0.05,**P<0.01)。
讨 论
MiR-34家 族 包 括MiR-34a,miR-34b和miR-34c,它们在进化过程中相对保守,其中miR-34a因其抗肿瘤作用而被大家熟知[8]。早在2014年,有学者指出miR-34a可以通过抑制破骨细胞内Tgif2靶点抑制破骨细胞形成,进而抑制癌症骨转移和骨质疏松[9],从而将miR-34a与骨代谢联系在一起。
本实验中我们发现miR-34a可以促进MG63细胞成骨分化。Runx2与Sp7是成骨细胞分化特异性转录因子[10],COLⅠ的合成和分泌是成骨细胞活化的重要标志[11]。向MG63细胞内转染miR-34a拟态物后,与对照组相比,实验组细胞内COLⅠ、Runx2及SP7基因表达水平均升高,证明miR-34a可以促进其成骨分化。miR-34a对成骨分化的促进作用可能通过调节多种信号通路实现。有研究认为miR-34a可以促进受地塞米松抑制的鼠骨髓间充质干细胞及人脂肪干细胞成骨分化,且这种促进作用是通过靶向抑制Notch信号通路实现的[12,13]。目前已确认miR-34a可靶向抑制Notch基因,尽管Chen[14]等认为Notch信号通路的激活可促进成骨分化,但更多研究结果显示激活Notch信号通路对成骨分化有抑制作用[15~17]。最近有团队指出青蒿酯可以通过提高miR-34a表达水平调节miR-34a/DKK1/Wnt通路,进而提高人骨髓间充质干细胞成骨分化水平[18]。
同时,miR-34a在炎症的发生发展过程中有重要调节作用。肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)是一种促炎细胞因子,并且参与骨量调节。Xin[19]等发现TNF-α可以降低鼠骨髓间充质干细胞中miR-34a表达,而miR-34a表达增加可以逆转TNF-α造成的间充质干细胞细胞中成骨分化抑制。LPS是Pg的重要毒力因子,它可以诱导促炎因子生成并造成组织破坏,同时,它可以诱导破骨细胞分化,抑制成骨细胞分化进而导致骨吸收。有研究表明LPS可抑制巨噬细胞内miR-34a表达,而且miR-34a可抑制受LPS诱导的巨噬细胞炎症应答反应[6,20]。另有研究证实miR-34a可能减轻LPS介导的人上皮细胞及人脐静脉内皮细胞损伤[21,22]。我们设计实验探索miR-34a具有的抑制炎症因子表达及促进骨形成作用是否有利于Pg感染状态下MG63细胞的成骨分化。在本实验中MG63细胞受Pg刺激后细胞内miR-34a表达升高,向炎症细胞内转染miR-34a拟态物后,实验组COLⅠ、Runx2及SP7基因表达水平均较对照组降低,表明在感染状态时,miR-34a抑制MG63细胞成骨分化。
