辛烯基琥珀酸酯化琼脂对海藻酸钠微胶囊包埋效果的改善作用
2021-06-04陈福泉陈会景洪清林郭东旭肖琼翁惠芬肖安风
陈福泉,陈会景,洪清林,郭东旭,肖琼,翁惠芬,肖安风
(1.集美大学食品与生物工程学院,福建厦门 361021)(2.国家红藻加工技术研发专业中心,福建厦门 361021)(3.福建省食品微生物与酶工程重点实验室、福建省海洋功能食品工程技术研究中心,福建厦门 361021)(4.绿新(福建)食品有限公司,福建漳州 363100)
微胶囊技术可提高敏感性物质的稳定性并延长其保存期,而具有静电作用的蛋白质或多糖往往适合作为微胶囊的壁材[1]。海藻酸钠(Alg)是提取于褐藻的多糖,具有独特的pH敏感性[2],可与二价阳离子形成 “ 蛋壳 ” 型的凝胶结构,因此以海藻酸钠为微胶囊壁材已广泛用于益生菌群、香气物质、油脂类物质的包封[3,4]。然而海藻酸钠微胶囊仍存在乳化性能差、高渗透性、低机械稳定性与吸附性等缺陷[5,6]。从而常将海藻酸钠与其他多糖或蛋白类物质,如阿拉伯胶、果胶、纤维素、壳聚糖以及明胶等进行复配,形成多层壁材包封活性物质,以增强海藻酸钠微胶囊的包埋效果[7,8]。琼脂在微胶囊化中的应用也有报道:程文健[9]制备了琼脂、淀粉-琼脂以及麦芽糊精-琼脂微胶囊包埋油脂,均具有较好的隔绝氧的作用,可以显著减少氧气引起的油脂氧化现象;Usha等[10]以聚丙烯酰胺接枝琼脂为材料包封可治疗炎症性结肠炎的5-氨基水杨酸,结果表明接枝琼脂包埋的药物在酸性环境中释放率较低而在中性环境下释放率较高,故接枝琼脂可作为新型材料应用于构建消化道靶向药物的递送系统。而具有双亲性的琼脂衍生物与海藻酸钠复配用于微胶囊壁材鲜有文献报道。
大豆油属于多不饱和油脂,其中含有饱和脂肪酸(15%),单不饱和脂肪酸(24%),多不饱和脂肪酸(61%),其中亚油酸和亚麻酸的含量分别为53.2%和7.8%。此外大豆油是维生素E的重要来源,有助于降低血清胆固醇与低密度脂蛋白水平,预防动脉粥样硬化和心脏病等功效[11]。然而植物油脂中存在的多不饱和脂肪酸极易受到环境因素的影响,尤其在热、光、氧气的作用下氧化形成的过氧化物可继续分解,产生醛、酮、酸等物质[12]。导致油脂的理化性质改变,缩短产品保质期,并对油脂的营养价值、质地、感观产生恶劣影响。因此,需借助技术手段用于提高油脂在加工或储存过程中的氧化稳定性,以降低对其品质的损害程度。据报道利用酪蛋白酸钠或乳清蛋白经喷雾干燥制备了大豆油微胶囊,发现后者的包封率较前者低;在以豆科蛋白为壁材包埋大豆油的过程中,发现大豆分离蛋白的保油率、再分散性和溶解性等微胶囊化性能明显优于菜豆、红豆和绿豆分离蛋白[13]。
辛烯基琥珀酸酯化琼脂结构中含有亲水性羧基基团与亲油性烯基长链,是一种具有双亲特性的胶体,相对于原琼脂,其凝胶温度降低,有利于与其他物质复配。本实验将OSAR与海藻酸钠作为复配壁材,以大豆油为芯材,通过复合凝聚法制备微胶囊。考察不同因素对微胶囊包埋效果、乳液与微球状态、氧化稳定性、包埋效率等性能差异,并分析琼脂衍生物在微胶囊化中的作用效果,以期提高活性物质的稳定性,延长其贮存期。
1 材料与方法
1.1 材料与试剂
大豆油,益海嘉里食品营销有限公司;琼脂,绿新(福建)食品有限公司;辛烯基琥珀酸酸酐,深圳市思利凯贸易有限公司;无水氯化钙、海藻酸钠,西陇化工股份有限公司;石油醚(沸点30~60 ℃)、氢氧化钠、盐酸、乙醇、异丙醇、冰醋酸、三氯甲烷、胰蛋白酶、胃蛋白酶,国药集团化学试剂有限公司。
1.2 主要仪器与设备
D-16手持式高速均质/分散机,大龙兴创实验仪器(北京)有限公司;OS20-S LED数显顶置电子搅拌器,大龙兴创实验仪器(北京)有限公司;MASTERSIZE 2000激光粒径分析仪,英国马尔文仪器有限公司;ZXRD-B5210鼓风干燥箱,上海智城分析仪器制造有限公司。
1.3 方法
1.3.1 辛烯基琥珀酸酯琼脂及其取代度
参考Chen H等[14]报道辛烯基琥珀酸酯琼脂制备方法及其取代度的测定。
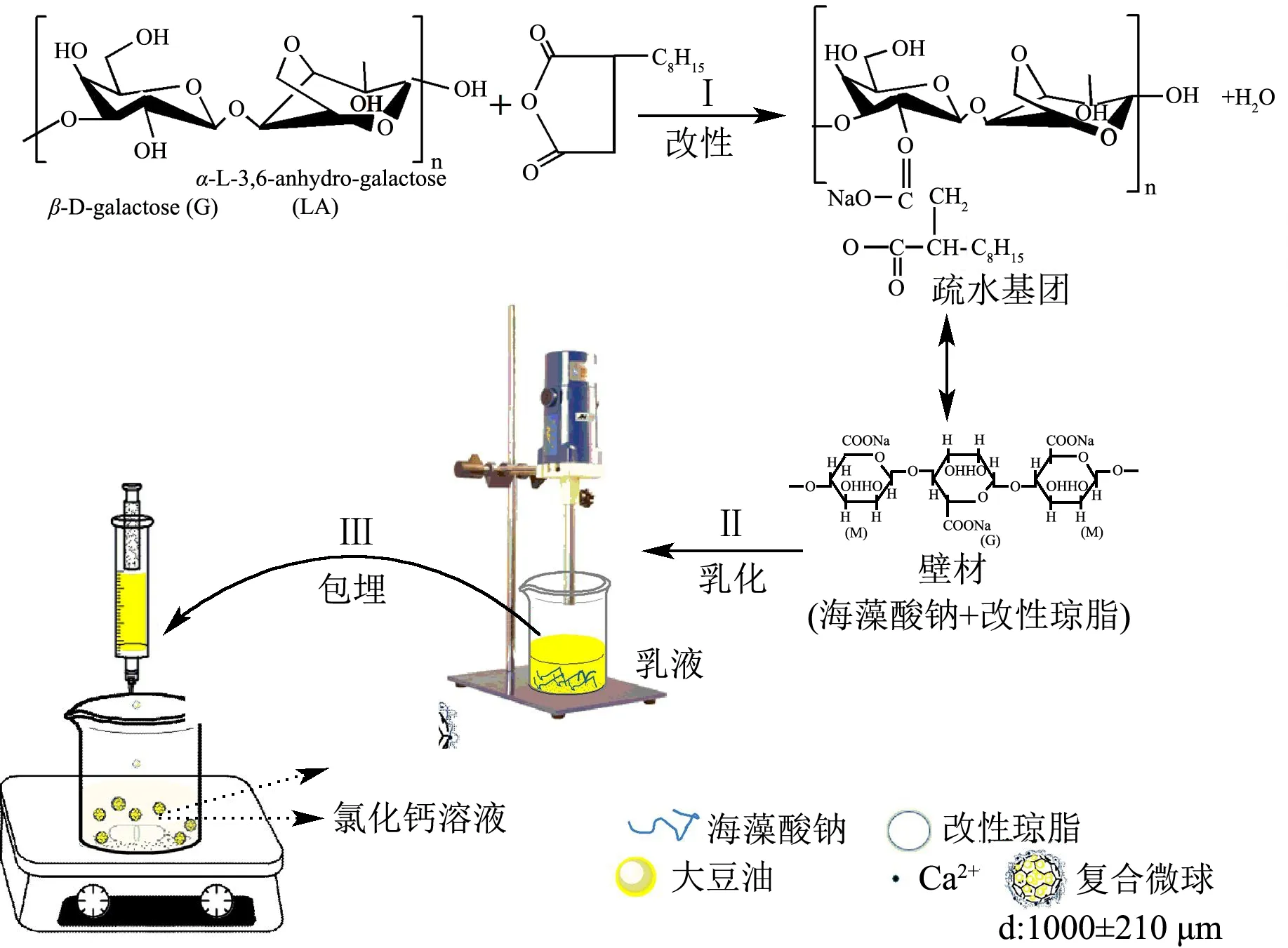
图1 微球的合成工艺路线Fig.1 Preparation process of encapsulation beads
1.3.2 微胶囊的制备方法
微胶囊乳液→混合→均质乳化(大豆油)→造球→固化→分离→洗涤→烘箱干燥→微胶囊成品
具体工艺路线见图1。
1.3.3 包埋影响因素
1.3.3.1 不同壁材
以单因素试验结果作为微球的较优制备工艺,分别以海藻酸钠(Alg)、原琼脂-海藻酸钠(NAAR/Alg)、改性琼脂-海藻酸钠(OSAR/Alg)为壁材,包埋大豆油并比较三者的包埋效果差异。
1.3.3.2 复配比例
制备复配比分别为0.5:1、1:1、1.5:1、2:1、2.5:1、3:1的改性琼脂(DS=0.06)/海藻酸钠复合溶液,待温度达到50 ℃后再加入3%的大豆油均质3 min(12000 r/min)形成乳液。在温和搅拌的条件下,将乳液滴加至浓度为3% CaCl2溶液,待微球形成后继续固化20 min,最后过滤、洗涤、收集微球后在45 ℃下烘干,获得产品。
1.3.3.3 芯材(大豆油)的添加量
制备比例为1:1的改性琼脂/海藻酸钠的溶液,分别添加1%、2%、3%、4%、5%(W/V)的大豆油,均质3 min后形成均匀的乳液再滴加至浓度为3%的CaCl2溶液中。待凝胶微球成型之后继续搅拌固化20 min,过滤洗涤后在45 ℃下烘干,获得产品。
1.3.3.4 乳化温度
将新制备的壁材溶液分别放置在温度为40、45、50、55、60 ℃的恒温水浴锅中保存,待溶液温度达到设定温度后,加入大豆油均质3 min后再滴加至3%的CaCl2溶液中。待凝胶微球成型之后,继续搅拌固化20 min,经洗涤后在45 ℃下烘干,获得产品。
1.3.3.5 氯化钙浓度
将混合乳液分别滴加至浓度为1%、2%、3%、4%、5%(W/V)的CaCl2溶液中,待凝胶微球成型后,继续搅拌固化20 min,过滤收集微球并用去离子水洗涤,置于45 ℃下烘干,获得产品。
1.3.4 微胶囊产品性能
1.3.4.1 乳化性与乳化稳定性
参考别平平[15],Wang等[16]的方法测定多糖溶液的乳化性能,其测定方法如下:分别制备0.5%(W/V)的Alg,NAAR/Alg,OSAR/Alg溶液,加入10%的大豆油后在55 ℃下高速剪切均质(12000 r/min,3 min)制备乳液,在不同时间段里从容器底部抽取200 μL乳化液,与10 mL十二烷基硫酸钠0.1%溶液混合摇匀后读取乳液在500 nm处的吸光度。乳化性能的计算公式如下:
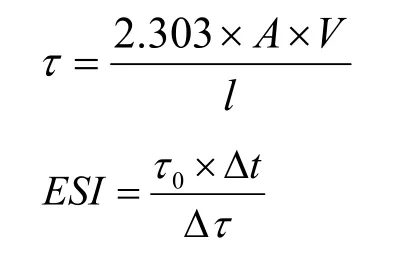
式中:τ为乳化液的浊度(cm-1),ESI代表乳化稳定性(h),A为所测的吸光度,V为稀释因子,l为比色皿的光程长度(0.01 μm),τ0为制备后立即测定的乳液浊度,△τ是在时间间隔为△t(24 h)内浊度的变化值。
1.3.4.2 总油含量、表面油及包埋效率的测定
根据国标[17]GB5009.6-2016测定微球的总油含量。
表面油的测定参考SHARIF等[18]的方法并稍作修改。试验步骤:将10 mL的石油醚倒入盛有2.0 g微球的带盖玻璃瓶中,摇晃2 min后过滤,收集滤液将并在80 ℃条件下蒸发残留的石油醚直至恒重,称重记为S0。根据以下公式计算包埋效果:

式中:OL:有效载油量,%,OY:产率,%;EE:包埋效率,%,T0:微球中大豆油总量,g;S0:微球表面大豆油的量,g;M1:微球的质量,g;M2:微球中大豆油总量,g;M3:加入的大豆油总量,g。
1.3.4.3 乳液及微球的形态
将新制备的乳液与干燥后的微球分别放置于光学仪器下观察其形态。
1.3.4.4 微胶囊的体外消化分析
参考Wang等[19]的方法并稍做改动测定微球在模拟肠胃液中的释放情况。步骤如下:准确称取2.0 g微球与20 mL模拟胃液(SGF)混合后在放置于摇床(37±0.5 ℃,100 r/min),待2 h结束后滤除SGF溶液,收集微球,再将微球投入至20 mL模拟肠液(SIF)中放置在摇床里温育3 h。待温育结束后再将微球烘干,采用1.3.3.2中所述的方法测定油脂的含量。释放率(Oil released,OR,%)的计算公式如下:
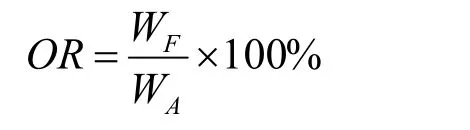
式中:WF为微球释放的油量,g;WA为微球的总油含量,g。
模拟肠胃液的配制方法为:配制模拟肠液(SIF):准确称取6.8 g的KH2PO4用无菌去离子水溶解之后,用1 mol/L的NaOH调节pH至7.4,再加入10.0 g的胰蛋白酶,混合后定容至1 L;配制模拟胃液(SGF):将氯化钠(0.2%,W/V)溶于无菌蒸馏水后,用1 mol/L的HCl调节至2.0,再将3.2 g的胃蛋白酶溶解至该溶液,定容至1 L。
1.3.4.5 过氧化值的测定
参考Tatar等[20]的方法并做稍微改动,测定氧化过程中 (60 ℃,7 d)大豆油的氧化稳定性。步骤如下:将2.0提取于微球的大豆油与30 mL三氯甲烷-冰醋酸溶液混匀,加入1 mL饱和的KI溶液后振荡0.5 min并继续在暗处静置3 min,随后再加入去离子水(100 mL),摇匀后立即在恒定搅拌的条件下使用0.0020 mol/L Na2S2O3溶液滴定至淡黄色,再加入0.5 mL淀粉溶液作为指示剂,继续滴定至溶液紫色消失即为滴定终点,记录样品所消耗的Na2S2O3溶液体积。过氧化值的计算公式如下:
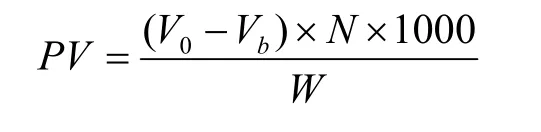
式中:PV代表过氧化值(m mol/kg),V0和Vb分别代表滴定对照组和包封大豆油样品所消耗的硫代硫酸钠溶液的体积(mL),N代表硫代硫酸钠溶液的浓度,W为样品的质量。对照组为未包埋的大豆油。
1.3.5 数据处理
上述实验数据在采集过程中,至少重复测量三次,Origin软件对分析数据作图,采用SPSS软件,对数据进行单因素方差分析,并以邓肯检验比较各组之间的差异,显著性水平为p<0.05,以不同字母代表差异显著。
2 结果与分析
2.1 包埋影响因素
2.1.1 不同壁材
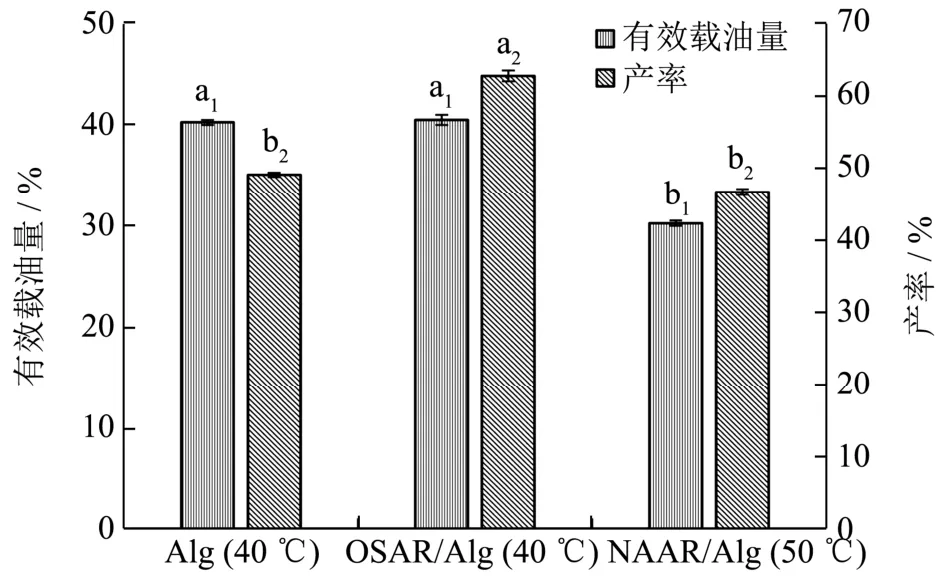
图2 不同壁材的包埋效果Fig.2 Encapsulation efficiency of beads under the optimum conditions
分别以Alg(1%)、NAAR/Alg(0.5%:0.5%)、OSAR/Alg(0.5%:0.5%)为壁材,考察三者间包埋效率的差异,试验结果如图2所示。从图可知,单位质量的Alg与OSAR/Alg复合微球的载油量间并无显著差异,但明显高于NAAR/Alg微球的载油量,而就产率而言,OSAR/Alg微球的产率(62.77%)明显高于其它两者,分别高出27.83%和34.48%,这是由于双亲辛烯基琥珀酸酯化琼脂混入海藻酸钠体系后,提高了海藻酸钠微胶囊的亲油性,即增强了微胶囊与大豆油界面亲和能力,从而提高了微胶囊对大豆油的包埋产率。对于Alg与OSAR/Alg两者的载油量而言,在相同微胶囊壁材占微胶囊比例及形状大小相同时,理论上前者载油率低于后者;但从两者形成的微球粒径(见表1)来看,前者大于后者,这可能是导致两者微球的载油量持平的原因。

表1 乳液与微球的物理性质Table 1 Physical properties of microbeads produced by different wall materials
另一方面,在微球的制备过程中,由于原琼脂的凝固温度较高,当环境温度较低时(≤45 ℃)其溶液因受温度的影响而发生凝固,故对操作的温度要求较高,而OSAR或Alg在40 ℃时具有保持溶液状态的优势,可进行造粒操作。NAAR/Alg复合微球包埋效果均低于Alg和OSAR/Alg复合微球,这可能与NAAR加入降低了体系中海藻酸钠与Ca2+交联形成凝胶网络比例有关。
2.1.2 复配比
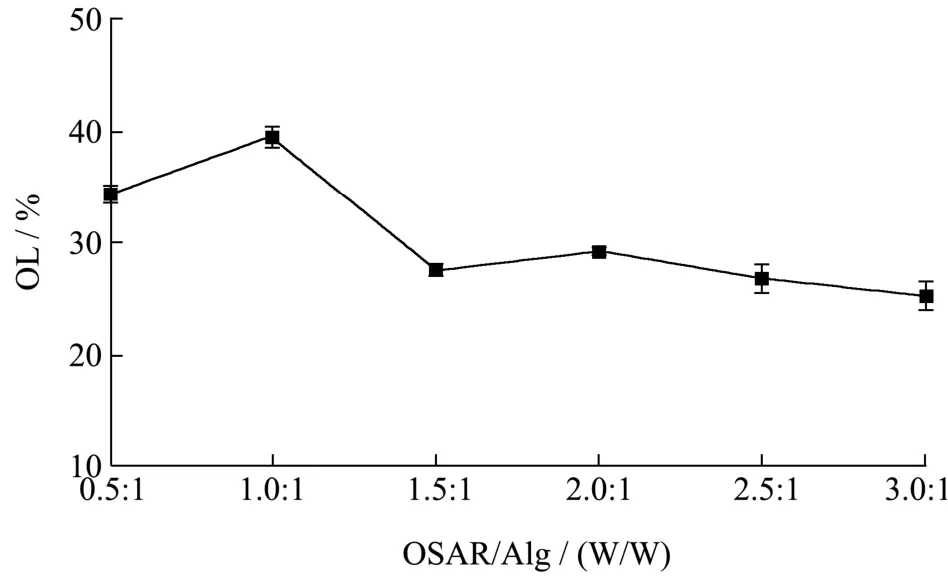
图3 改性琼脂与Alg比例对包埋的影响Fig.3 Effect of the ratio of OSAR and Alg on encapsulation
改性琼脂与海藻酸钠复配比对载油量的影响如图3所示。随着复配比例的增大,微球载油量呈现出先上升后下降最终趋于稳定。当琼脂与海藻酸钠的比例为1:1时,微球的载油量达到最大值(39.50%)。若继续增大琼脂比例,由于高浓度琼脂可能会阻碍海藻酸钠与Ca2+间的交联,影响包封凝胶网络结构的形成,进而导致载油量降低。另外,由于复配比例不同,本身存在静电作用的大豆油滴对带有电荷的壁材溶液表现出不同的吸引力,故亲油性不同而影响载油量。此外不同聚合物间复配的协同作用不同,导致包埋效果存在差异。例如,张华等[21]发现将2%的海藻酸钠与0.1%的壳聚糖复配时包埋鞣花酸的效果达到最佳,而当比例超过上述值时,均会降低包埋效率。
2.1.3 芯材添加量
由表9可知,白砂糖的最佳添加量为8%。这是因为白砂糖会使酸奶最终获得较好的糖酸比,当添加量为6%时,最终酸奶的甜味不足,但甜味剂过多,会严重影响口味。
根据图4可知,在1%~4%范围内,载油量随着大豆油添加量的增加而显著提高,当达到4%时,复配微球有效载油量最高可达到41.81%。若继续增加大豆油的添加量反而会降低载油量。究其原因是由于多糖的亲油能力有限,过量的大豆油并不能与复配溶液充分混合相溶,而未与壁材溶液混匀的大豆油则会悬浮在溶液的表面或残留在容器内壁,而不能被包裹在微球中,造成芯材损失。

图4 大豆油添加量对包埋的影响Fig.4 Effect of oil addition on encapsulation
2.1.4 乳化温度

图5 乳化温度对包埋的影响Fig.5 Effect of emulsifying temperature on encapsulation
海藻酸钠与琼脂均为热敏性胶体,两者加热溶解后其分子链会随着温度的降低发生缠绕交联,因此多糖溶液在低温时粘度较大。不同乳液温度对载油量的影响如图5所示,当乳液的温度在40~60 ℃之间时,有效载油量在38.21%~46.83%,而温度为50~60 ℃时,载油量之间并无显著差异。温度不仅影响乳化效果,同样对造球操作影响显著。低温时的复配乳液较为粘稠,需要施加更大的压力来挤压乳液才能使其通过微孔,同时部分乳液也会凝结在容器内壁,使微球的产率降低。类似于Lee等[22]的报道,其将酪蛋白酸钠与麦芽糖糊精复配包封红棕榈油,发现当操作温度为40 ℃时,乳液的粘度较大导致流动性较差,需要提供更大的压力方能进行包埋操作。由于改性琼脂的凝胶温度降低,当两者的比例为1:1,乳液温度为40 ℃时,其混合体系仍能保持流动的溶液状态,可进行造粒操作,这一特性将会开拓琼脂作为添加剂应用于生物行业,保护热敏性物质。
2.1.5 氯化钙浓度
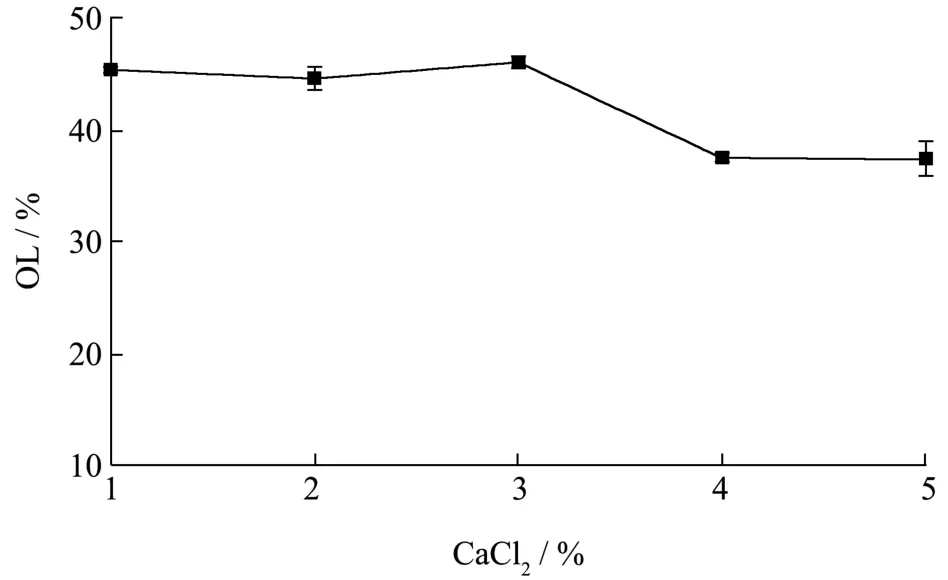
图6 氯化钙浓度对包埋的影响Fig.6 Effect of CaCl2 concentration on encapsulation
氯化钙作为交联剂其浓度对大豆油包埋的效率的影响如图6所示。海藻酸钠与二价阳离子发生置换交联形成三维网络结构的 “ 蛋盒 ” 型凝胶。当CaCl2浓度在1%~3%时,其对微球的载油量并无显著影响,其值均在44.50%~46.26%之间,而当其浓度上升至3%时,其有效载油量呈现下降趋势,其原因是当CaCl2溶液浓度过高时,海藻酸钠与其的交联反应较为活跃,导致网络结构密度增大,吸附作用降低导致微球的载油量降低[23]。同样,李培培等[24]也发现较高浓度的交联剂可导致芯材的渗漏而降低微球的载药量。
综上,当改性琼脂与海藻酸钠的复配比例为1:1,芯材添加量为4%,温度为40 ℃,氯化钙浓度为3%为制备高载油量微球的较优工艺。
2.2 微胶囊包埋效果
乳液与微球的物理性质见表1。据表可知,OSAR/Alg与NAAR/Alg所形成乳液的稳定性明显高于纯Alg所形成乳液的稳定性,分别高出56.86%和29.41%,这是由于琼脂本身具有一定的乳化能力。而同比于原琼脂,OSAR的乳化稳定性改善是琼脂结构中引入的酯基的静电斥力作用具有增强稳定乳液的能力[25]。Alg微球表面油含量高于其他复合微球且其包埋效率最低(94.15%),这是由于Alg亲脂能力有限且包埋在微球内部的油脂容易通过微孔泄漏。此外,OSAR/Alg与油脂的包裹能力要优于Alg和NAAR/Alg,包埋效率达到97.59%,分别高出3.65%和2.41%,表面油含量为1.02%,分别低59.36%和31.54%,由于经过OSA疏水改性后在原本亲水性结构中引入烯基碳氢长链,赋予了OSAR亲油的性能,与脂质芯材有良好的相容性。故OSAR/Alg可作为一种新型壁材应用于耐温性能差的脂类物质微胶囊化。
2.2.2 乳液与微球的外观形态
壁材与芯材混合经乳化均质后形成不同粒径大小的O/W乳液。如图7,OSAR/Alg所形成的乳液中的油滴尺寸要小于纯Alg所形成的乳液油滴尺寸,表明油脂能够更均匀地分散在混合壁材溶液中;而OSAR/Alg与NAAR/Alg所形成的乳液油滴尺寸间并无显著差异。
不同壁材所形成的微球经两种不同方式干燥后,其尺寸大小无显著的差异。在色泽方面,鼓风干燥后的NAAR/Alg微球的色泽要深于其他壁材所形成的微球。冷冻干燥方式对三种壁材形成微球的外观造成显著差异。Alg或NAAR/Alg所形成的微球在冷冻干燥的过程中会发生剧烈的收缩,出现显著的干瘪现象。这是因为由Ca2+交联的具有多孔凝胶结构的藻酸盐基微珠在冷冻干燥过程中其凝胶层结合水的能力差而造成微球在脱水过程中收缩变形[26]。Belščak-Cvitanović等[27]也发现藻酸盐基微球经过冷冻干燥处理后形状受损并出现塌陷和不均匀的表面。而OSAR/Alg所形成的微球颗粒饱满,球形形状保留完好,说明OSAR在冷冻过程中发挥了类似于冷冻保护剂的效果,可降低物质在干燥脱水过程中的损害程度。

图7 乳液形态和微胶囊微球形态Fig.7 Micrographs of different emulsions and different microspheres
2.2.3 微球的微观结构

图8 微球的微观结构Fig.8 Micrographs of oils microencapsulated
图8显示了凝胶微球经鼓风干燥后的基本形状与表面形态。从图可知,纯Alg或OSAR/Alg作为复配壁材所形成的微球形态完整,且均具有球形的几何形状。在较高放大倍数下可观察到所有微球均出现崎岖和不均匀的表面甚至出现裂缝或破裂的现象,这与Volić等[28],Arab等[29]所报道的海藻盐基微球表面出现的收缩甚至破裂的现象类似。然而,相比于OSAR/Alg所形成的复合微球,Alg微球的表面出现多个不同大小的孔洞,这将导致藻酸盐基微球仅能提供有限的阻氧效果,同样也会导致芯材易于从内部渗出[30]。尽管OSAR/Alg微球表面出现凸起现象,但并未发现微孔的存在,这可能是由于添加琼脂后填充了海藻酸钠微球的孔隙,而孔洞的存在则可能会加大氧气与芯材的接触机率,降低微球氧化稳定性。
2.2.4 微球的模拟体外消化
包埋在不同微球内部的大豆油在模拟肠胃液中的释放情况如图9所示。结果表明三种壁材所形成的微球在模拟肠液中的释放率相比于其在胃液中的释放率显著提高,这与其在不同pH中的膨胀率结果一致。类似于Morales等[31]的研究结果,其发现以海藻酸钠与虫胶为材料包埋葵花籽油时,复合微球经过模拟胃肠道消化处理后,相比于处理之前的微球油脂含量分别降低了4.7%、47.9%,说明在肠道中的释放率要高于在胃部的消化率。导致差异的原因是由于具有pH敏感性的海藻酸钠的pKa值分别为3.65和3.38,当其处于模拟肠液中时,体系pH值为7.4,羧酸部分比模拟胃液体系(pH值为2.0)更容易被去质子化,导致微球易于膨胀至被解囊而发生破裂,包封的油脂析出[32]。此外,OSAR/Alg微球在模拟肠、胃液中的释放率分别为30.93%与15.21%,均高于Alg微球的释放率(7.58%,12.79%)与NAAR/Alg的释放率(12.67%,24.61%),这可能是由于海藻酸钠微球的大豆油释放率主要取决于海藻酸钠与Ca2+间的交联形成的凝胶网络结构密度,网络结构密度越大豆油释放率越小;琼脂在NAAR/Alg复合微球阻碍了海藻酸钠与Ca2+间的交联作用,因此相对于纯Alg微球网络结构密度小,前者大豆油释放率比后者大;而OSAR/Alg复合微球相对于NAAR/Alg复合微球,由于其琼脂分子结构上接枝上亲油性的官能团,进一步阻碍了海藻酸钠与Ca2+间的交联作用,导致OSAR/Alg微球大豆油释放率大于NAAR/Alg复合微球。

图9 大豆油在模拟肠胃道的释放Fig.9 Release of soybean oil from the microbeads prepared with different wall material under simulated gastrointestinal conditions
2.2.5 氧化稳定性
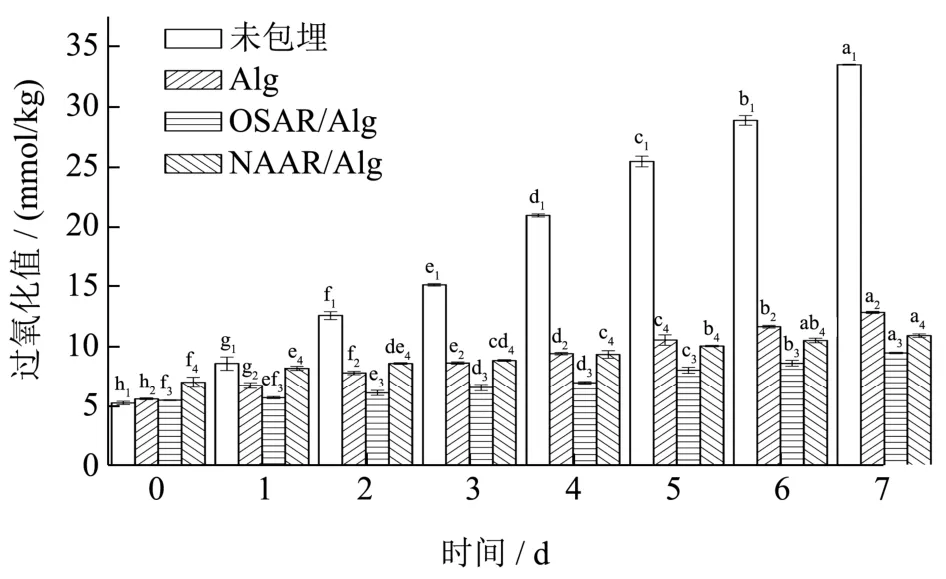
图10 未包埋/包埋的大豆油的过氧化值Fig.10 Peroxide value of unembedded and embedded soybean oil
包埋与未包埋的大豆油的过氧化值如图10所示。在加速氧化试验之前,原大豆油的初始过氧化值为5.22 mmol/kg,经过OSAR/Alg微胶囊化后的大豆油过氧化值为5.53 mmol/kg,而NAAR/Alg包埋后的大豆油过氧化值为7.01 mmol/kg,说明在包埋过程中的短期处理操作对油脂的过氧化值并无过多的负面作用。伴随着加速氧化的进行,附着在微球表面的大豆油中的不饱和物质开始发生氧化酸败,导致大豆油的过氧化值逐渐增加。当贮藏时间达到第7天时,未经包埋的大豆油的过氧化值高达33.47 mmol/kg,而Alg、NAAR/Alg、OSAR/Alg微球包埋大豆油的过氧化值分别为12.82、10.91与9.53 mmol/kg,均低于未包埋大豆油的过氧化值,大豆油经包埋后,贮藏时间延长,与程文健[9]的研究结果类似。上述结果表明相比于纯壁材,由复合壁材包封的油脂具有更高的氧化稳定性。这是由于Alg微球的表面油含量要高于复配微球的表面油含量,而表面油直接接触空气后易氧化,故过氧化值升高。此外,OSAR/Alg复合壁材表面并无孔洞结构,具有优越的阻隔氧气的效果,避免了包埋在微球内部的油脂与大气中的氧气直接接触,故其复配壁材包埋的油脂其氧化稳定性提高。
3 结论
3.1 研究了辛烯基琥珀酸酯化琼脂占比、芯材添加量、乳化温度、氯化钙浓度等因素对微胶囊载油率的影响,发现OSAR/Alg为1:1(W/W),芯材添加量为4%(W/V),乳化温度40 ℃,氯化钙浓度为3%(W/V)条件下,以OSAR/Alg为壁材的载油量达到40.50%,产率为62.77%,包埋效率达到97.59%,包埋效果均优于以分别以Alg,NAAR/Alg为壁材的包埋效果。
3.2 乳化性能测定结果表明琼脂的加入能够改善纯海藻酸钠的乳化性能,相比于未添加OSAR的乳液,OSAR/Alg乳液的乳化稳定性改善。此外,体外模拟消化试验表明以OSAR/Alg为复合壁材包埋的大豆油在模拟肠胃道中的释放率(30.93%)同比要高于Alg(12.79%)与NAAR/Alg(24.61%)的释放值。
3.3 扫描电镜结果表明OSAR的加入可填补纯海藻酸钠微球表面的孔洞。此外,与未经包埋的大豆油相比,加速氧化试验表明OSAR/Alg包埋可以提高油脂的氧化稳定性(未包埋、Alg包埋、OSAR/Alg包埋以及NAAR/Alg包埋的大豆油的过氧化值分别为33.47 mmol/kg、12.82 mmol/kg、9.53 mmol/kg、10.91 mmol/kg)。
3.4 以上结果表明辛烯基琥珀酸酯化琼脂极大地改善了海藻酸钠微胶囊包埋效果,适合应用于构建脂性物质的包封与递送系统。
