蓝莓酵素中复合菌种添加比例的确定及发酵工艺优化
2021-06-04白琳茹先古丽买买提依明丁帅杰许俊锋徐兵洁郑霞艾合买提江艾海提刘军
白琳,茹先古丽·买买提依明,丁帅杰,许俊锋,徐兵洁,郑霞,艾合买提江·艾海提,刘军
(新疆大学生命科学与技术学院,新疆乌鲁木齐 830046)
蓝莓(Vaccinium spp.)又名越橘、笃斯、都柿等,属杜鹃花科越橘属多年灌木果树。原产于北美洲与东亚,主要分布于朝鲜、日本等国家,在我国主要分布在黑龙江、安徽怀宁县、吉林长白山等地区[1,2]。蓝莓果实呈小而圆的颗粒状,果皮为蓝紫色,果味酸甜可口,香味独特。果实中富含花青素、SOD(超氧化物歧化酶)活力、各种维生素、蛋白质以及糖类等[3,4]。
中华人民共和国轻工行业标准QB/T 5323-2018对植物酵素的定义是指可以用于食品加工的植物为主要原料,添加或不添加辅料,经微生物发酵制得的含有特定生物活性成分的用于种植业、养殖业、土壤改良的酵素产品[5]。传统的发酵食品多种多样,例如泡菜[6]、奶制品[7,8]、果酒[9]、豆腐乳[10]等都与人们的生活息息相关。近年来,随着发酵产品的发展,酵素产品也逐渐走进了人们的生活,引起人们的重视。李国英等人[11]用酵母菌制备了木瓜酵素,王领等人[12]用酵母菌制备了火龙果酵素,郭艳萍等人[13]用酵母菌制备了葡萄酵素,李飞等人[14]由多种有益菌制备了苹果酵素,蒋增良等人[15]通过自然发酵得到具有天然微生物酵素的功能性产品。酵素中含有SOD(超氧化物歧化酶)活力,它是一种以超氧阴离子为底物的酶[16],具有抗氧化、抗衰老[17]功效。发酵液中的糖和酸的含量是判断菌种的发酵速度及感官评价的重要指标。不同的菌种在发酵过程中对发酵液的影响不同。植物乳杆菌可以为发酵液提供独特的酸味[18],乳酸片球菌能维持肠道微生态平衡、提高机体生长性能、辅助增强机体免疫力[19],嗜酸乳杆菌具有抗菌性能[20],报道称副干酪乳杆菌可以提高蓝莓的抗氧化活性[21],鼠李糖乳杆菌具有耐胆汁盐、耐酸和耐抗生素生物学特性,能够很好地耐受宿主消化道环境,帮助宿主调节肠道菌群平衡[22]。
植物酵素多种多样,学者们对发酵过程中工艺参数的优化研究颇多[23,24],但对于蓝莓酵素的研究非常少,并且很少有多种菌种发酵蓝莓果汁的研究。本文利用五种不同的菌种发酵蓝莓果汁,以超氧化物歧化酶(SOD)活力、可溶性固形物含量(TSS)、pH值为指标,首先通过均匀设计确定发酵菌种接种体积比例,然后设计不同的发酵时间、温度、发酵液初始菌密度以及初始可溶性固形物含量的单因素实验,最后通过响应面法优化发酵工艺,以期发酵出SOD活性高且使消费者满意的蓝莓酵素产品。通过对蓝莓进行发酵,对充分利用蓝莓资源、发展特色经济具有重大意义。
1 材料与方法
1.1 材料与试剂
蓝莓,购自安徽怀宁县;SOD试剂盒,南京建成有限公司;冰乙酸、碳酸钠(均属于分析纯),天津市盛奥化学试剂;MRS肉汤培养基,北京奥博星生物技术有限公司;果胶酶(500 u/mg)、纤维素酶(50 u/mg)、半纤维素酶(20 u/mg),诺维信有限公司;植物乳杆菌bio-52467、乳酸片球菌bio-56623、嗜酸乳杆菌bio-53058、副干酪乳杆菌bio-03644、鼠李糖乳杆菌bio-52962,中国微生物菌种保藏中心。
1.2 仪器与设备
高端破碎料理机MD-767,中山市韩菱电器有限公司;分析天平FA 1004,上海越平科学仪器有限公司;GXZ智能型光照培养箱,宁波市科技园区新江南仪器有限公司;721G可见分光光度计、DHP-9052电热恒温培养箱,上海齐欣科学仪器有限公司;酸度计PHS-3C,上海杲森仪器设备有限公司;高精度手持式色差仪3 nh,致芯电子五金工具。
1.3 指标测定方法
1.3.1 菌种的活化与培养
将购买得到的菌种在无菌操作台上倒入装有30 mL的无菌MRS肉汤培养基中,在37 ℃下活化16~24 h,保证培养基中的细胞密度达到 8.00~9.00 log(CFU/mL)(利用血球计数板在显微镜下计数)。培养至2~3代用于接种。
1.3.2 蓝莓酵素制备过程
将蓝莓解冻后用高端破碎料理机破碎(蓝莓果汁的初始TSS含量为9 °Brix),然后在55 ℃下加酶酶解3 h。果胶酶、纤维素酶、半纤维素酶的总添加量(质量)为0.8%,添加比例为2:1:1。酶解后在85 ℃下灭菌15 min。待温度冷却至37 ℃,将菌种接入蓝莓果汁中。最后用棉花将瓶口塞紧后在37 ℃恒温培养箱中静态发酵。
1.3.3 菌种中细胞密度计数
发酵液中的菌密度利用血球计数板进行计数。计数后,将细胞密度以CFU/mL表示。所有操作均重复三次。计算公式如下:

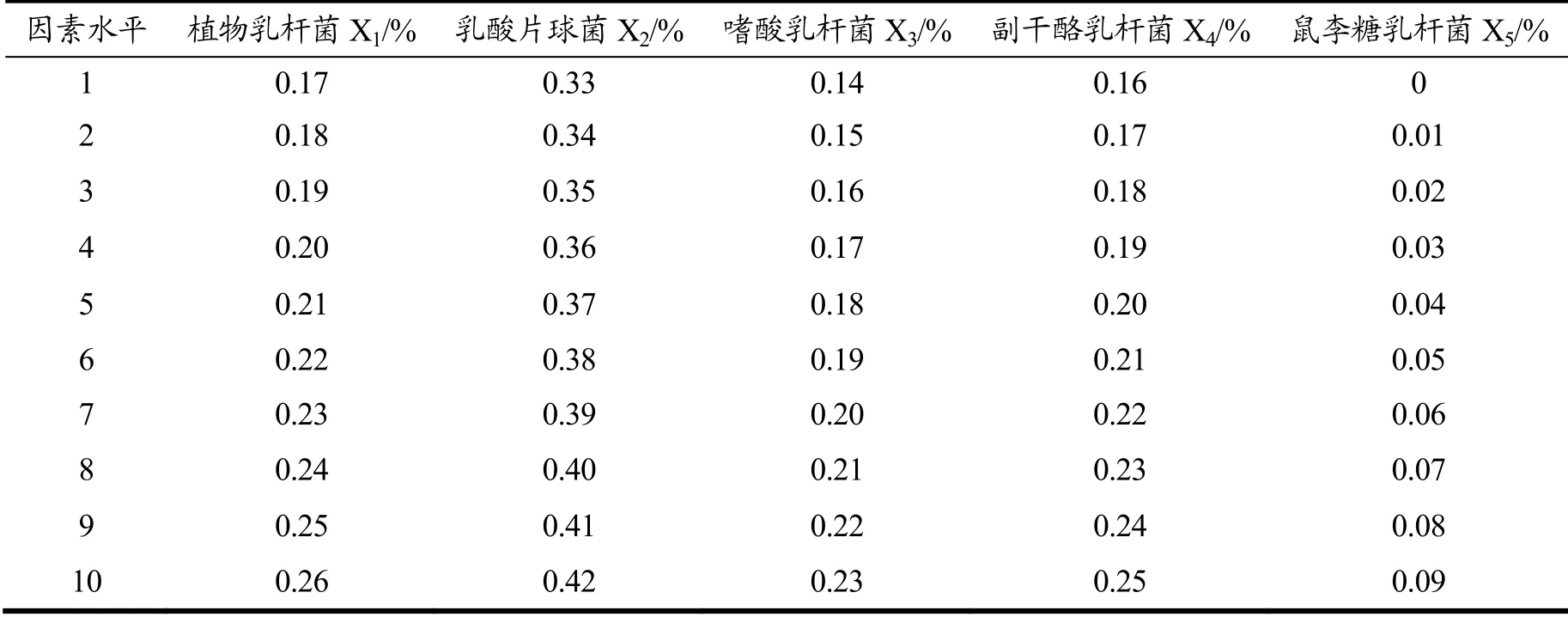
表1 均匀设计因素水平表Table 1 Uniform design factor level table
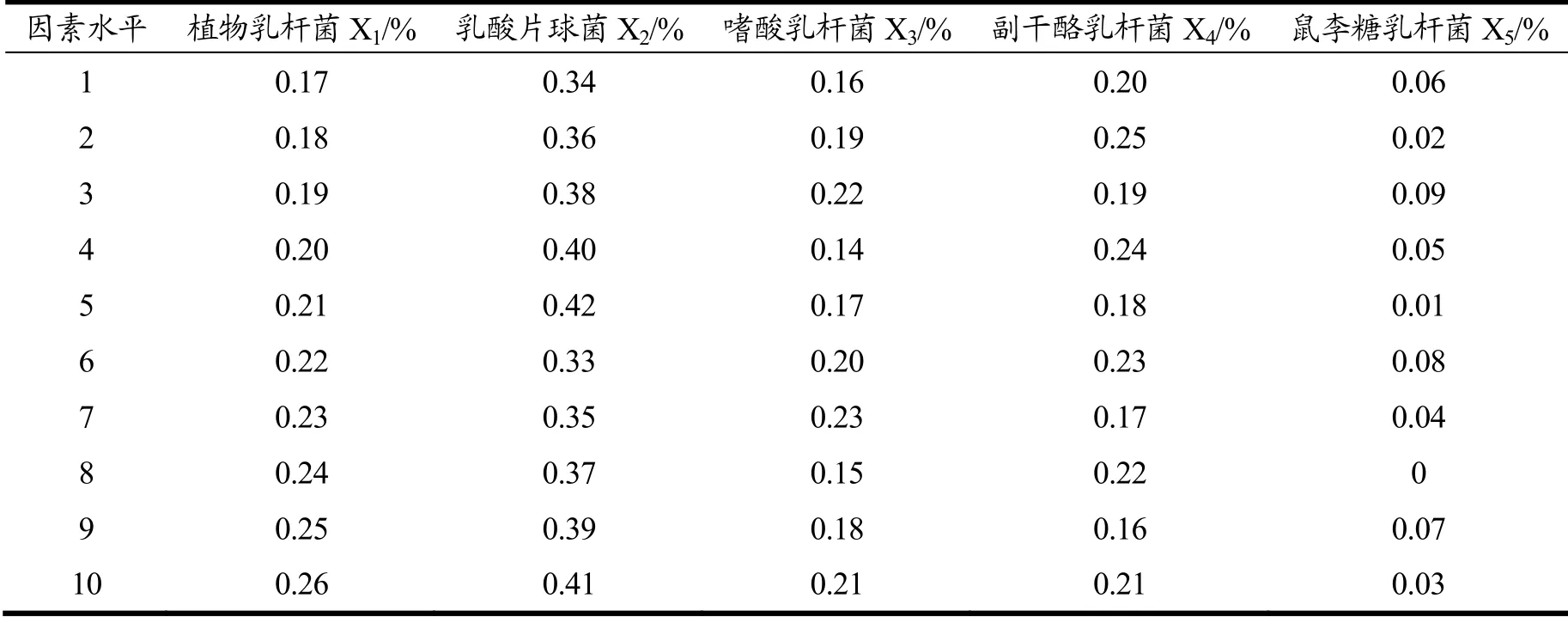
表2 均匀设计试验方案Table 2 Uniform design table of the experiment
1.3.4 pH值的测定
利用台式酸度计进行pH值的检测。检测前,将酸度计用pH4.00、6.86、9.10的标准缓冲液在25 ℃下进行校准。参照GB 10468-1989方法进行检测[25]。所有操作均重复三次。
1.3.5 总可溶性固形物(TSS)含量的测定
利用手持糖度计来检测总可溶性固形物(TSS)含量,检测前将糖度计用蒸馏水调零。所有操作均重复三次。
1.3.6 超氧化物歧化酶(SOD)活性的检测
根据试剂盒检测方法,将蓝莓汁发酵液在4000 r/min下离心15 min,取上清液进行测定。将取得的上清液用0.1 mol/L pH 7.0~7.4的磷酸缓冲液稀释成不同浓度进行最佳取样量的摸索。最后按照操作表进行试验。所有操作均重复三次。
1.4 均匀设计确定接种体积比例
均匀设计具有使所有实验点均匀分散,没有整齐可比的特点。它使得试验次数最小化,试验简单化。本试验根据吉梦雯[26]的研究方法进行略微的修改进行了五因素十水平(U11(1110))的实验设计。均匀设计中,以SOD活性、pH值、TSS含量为响应值,以五种菌种(包括植物乳杆菌、乳酸片球菌、嗜酸乳杆菌、副干酪乳杆菌、鼠李糖乳杆菌)的接种体积比例为因素。在37 ℃下,将初始TSS含量调整为11 °Brix,以下面十种不同菌种比例进行试验,发酵36 h。均匀设计因素水平表如表1所示。根据均匀设计因素水平表得出十组均匀设计试验方案如表2所示。
1.5 单因素试验
1.5.1 发酵时间对蓝莓酵素指标的影响
将蓝莓发酵液在37 ℃、初始菌密度为106CFU/mL(接种体积比例为植物乳杆菌22.45%、乳酸片球菌42.86%、嗜酸乳杆菌14.29%、副干酪乳杆菌16.33%、鼠李糖乳杆菌4.1%)以及初始可溶性固形物含量控制在11 °Brix,分别发酵24、28、32、36、40 h,测定每组发酵液的SOD活力、pH值、TSS含量。
1.5.2 发酵温度对蓝莓酵素指标的影响
将蓝莓发酵液初始菌密度控制在106CFU/mL(接种体积比例为植物乳杆菌22.45%、乳酸片球菌42.86%、嗜酸乳杆菌14.29%、副干酪乳杆菌16.33%、鼠李糖乳杆菌4.1%)、初始可溶性固形物含量为11 °Brix,将蓝莓发酵液在23、30、37、44、51 ℃下发酵36 h,测定每组发酵液的SOD活力、pH值、TSS含量。
1.5.3 发酵液中初始菌密度对蓝莓酵素指标的影响
将蓝莓发酵液初始可溶性固形物含量控制为11 °Brix,将蓝莓发酵液的初始菌密度分别控制为5×105、106、5×106、107、5×107CFU/mL(接种体积比例为植物乳杆菌22.45%、乳酸片球菌42.86%、嗜酸乳杆菌14.29%、副干酪乳杆菌16.33%、鼠李糖乳杆菌4.1%),在37 ℃下发酵36 h,测定每组发酵液的SOD活力、pH值、TSS含量。
1.5.4 初始可溶性固形物含量对蓝莓酵素指标的影响
将蓝莓发酵液的初始菌密度控制为106CFU/mL(接种体积比例为植物乳杆菌22.45%、乳酸片球菌42.86%、嗜酸乳杆菌14.29%、副干酪乳杆菌16.33%、鼠李糖乳杆菌4.1%)。初始可溶性固形物含量为9°Brix,在此基础上将发酵液初始TSS含量调整为9、11、13、15、17 °Brix,在37 ℃下发酵36 h,测定每组发酵液的SOD活力、pH值、TSS含量。
1.6 响应面法优化最佳发酵工艺
以发酵时间、发酵温度、发酵液初始菌密度、初始可溶性固形物含量为因素,SOD活力为响应值利用Design-Expert.V8.0.6软件依据Box-Behnken的原理进行四因素三水平的响应面试验设计。响应面实验的因素水平表如表3所示。
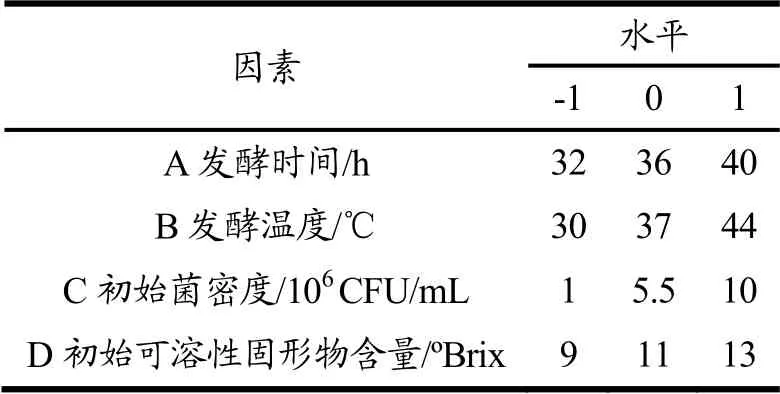
表3 因素水平表Table 3 Factors and levels of the experiment
1.7 色差测定
色差的测定根据苗文娟等人[27]的描述稍作修改。首先在50 mL离心管中放入试管2/3体积左右发酵液,用离心机在4000 r/min下离心20 min。然后取上清液用色差仪测定发酵液的L*、a*、b*值,用下列公式计算:
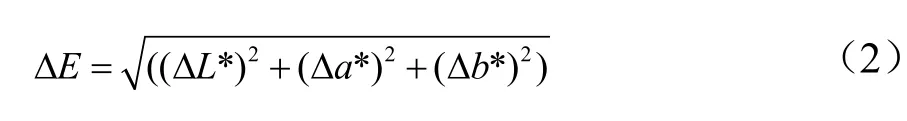
其中,L代表明暗度,a代表红绿色,b代表黄蓝色,ΔE值越大,代表发酵液在发酵前后生物颜色变化越大。
1.8 数据处理
使用Design-Expert.V8.0.6进行响应面分析,利用Origin 2019b 64Bit版本和Excel 2016软件进行作图。使用SPSS 24.0进行二次多项式回归分析,确定p<0.05的统计学上的显著性差异。所有数据分析均重复三次。
2 结果与分析
2.1 均匀设计确定菌种比例结果与分析
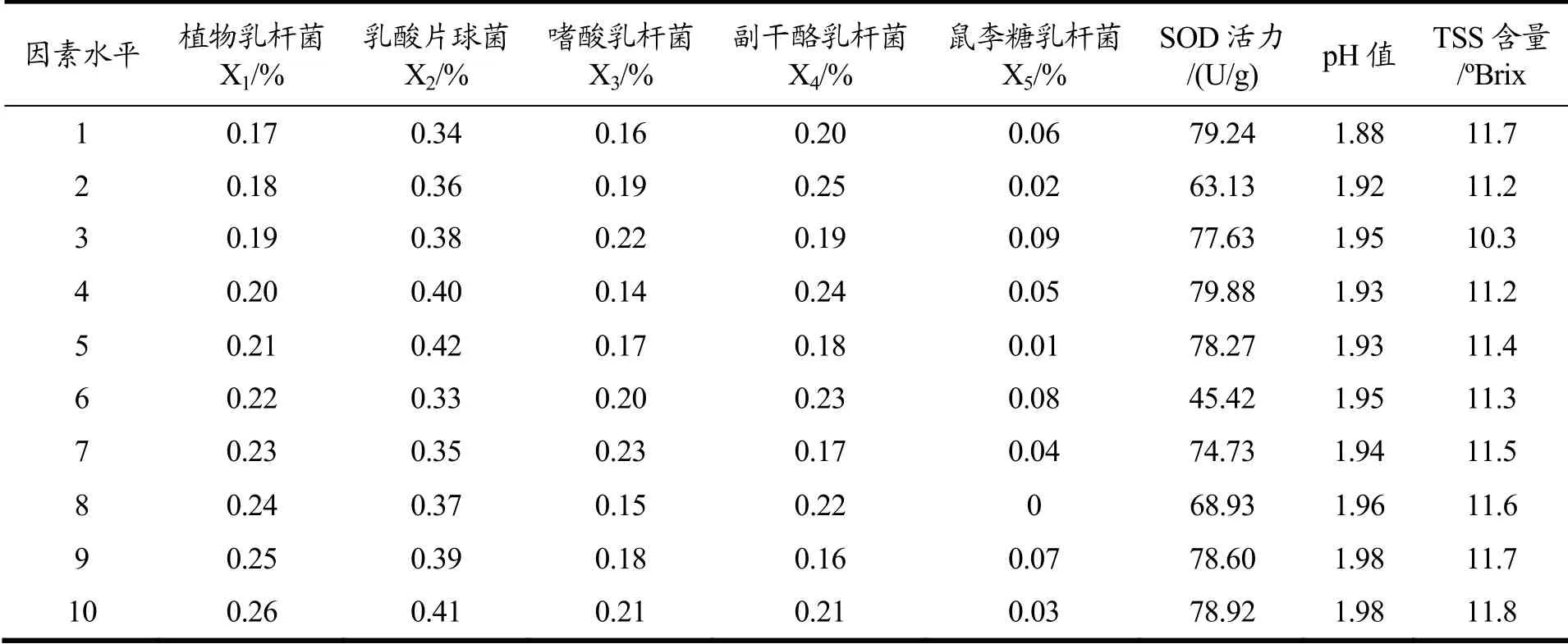
表4 均匀设计实验结果Table 4 Results of uniform design experiments
由于在十组试验中,每组试验的pH值基本不变,TSS含量同样也基本保持不变,故以SOD活力为响应值运用SPSS 24软件进行二次多项式逐步回归方程分析,建立回归方程如下所示:
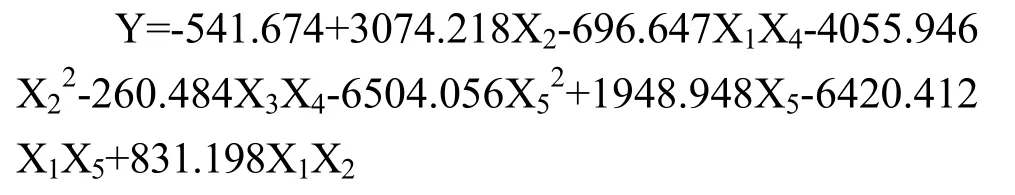
回归方程中R2=0.99,F=99.85,P=0.08<0.1(由于样本量小,达到了边缘性显著),证明方程可以较准确的预测出最佳条件。综上,预测出蓝莓酵素的最佳接种体积比例分别为植物乳杆菌22.45%、戊糖片球菌42.86%、嗜酸乳杆菌14.29%、副干酪乳杆菌16.33%、鼠李糖乳杆菌4.1%,此时SOD活力达到89 U/g。根据预测出的最佳条件进行验证试验,得出蓝莓酵素发酵后的SOD活力为82 U/g。
2.2 响应面法优化最佳发酵工艺
2.2.1 单因素实验结果
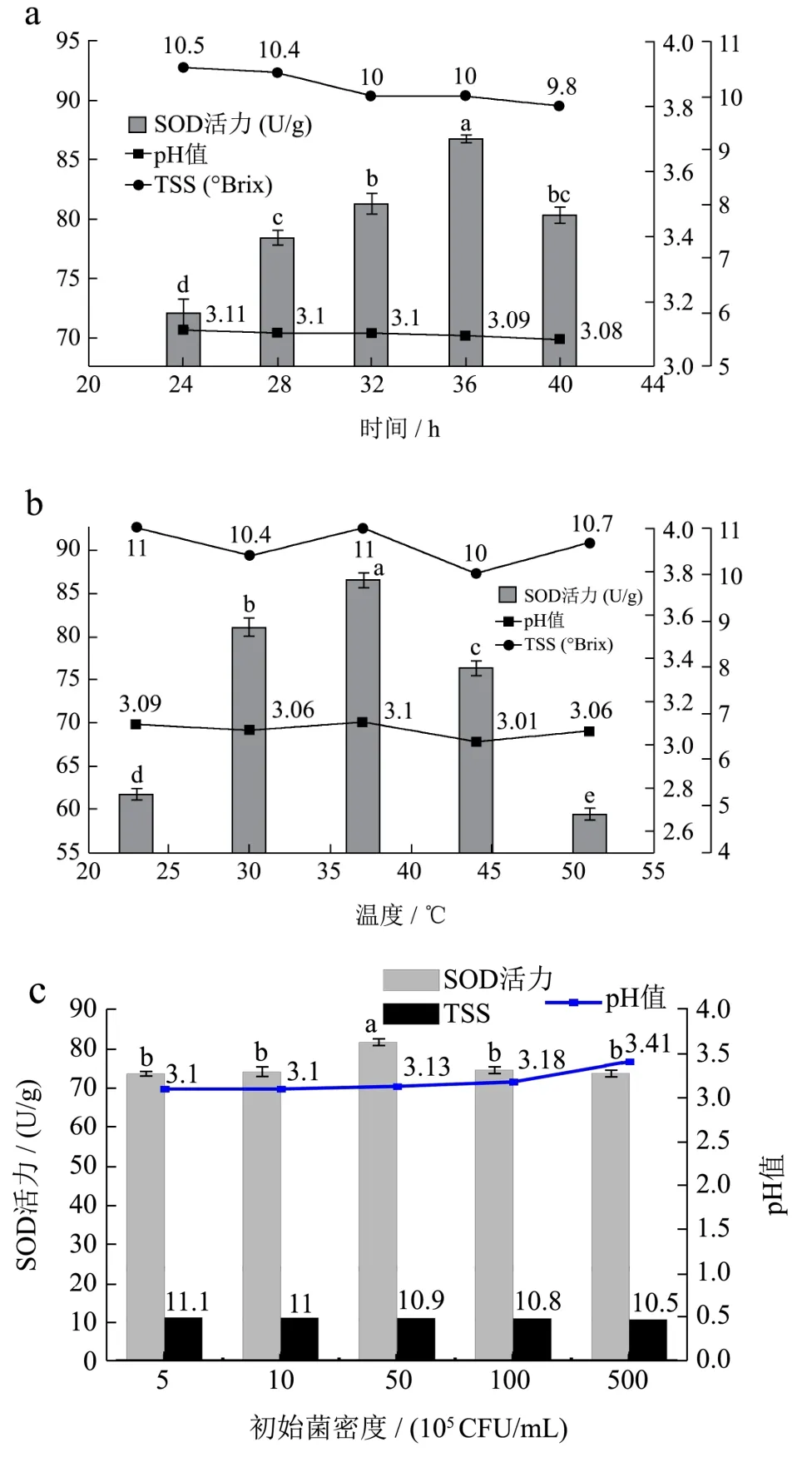
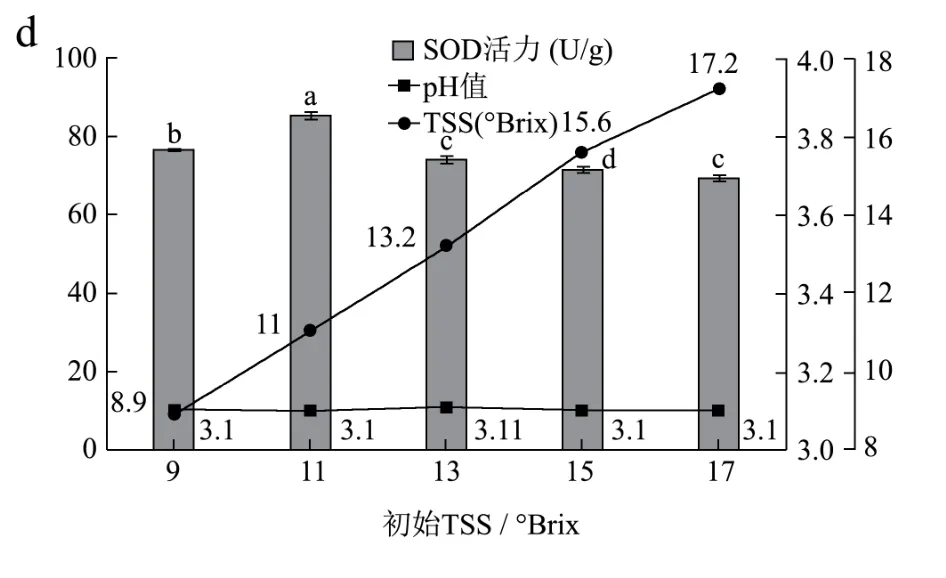
图1 发酵时间、温度、初始菌密度及初始TSS含量对蓝莓酵素SOD活力、pH值及TSS含量的影响Fig.1 The influence of fermentation time, temperature, initial bacterial density and initial soluble solid content on the SOD activity, pH value and TSS content of blueberry juice
发酵时间、温度、初始菌密度及初始TSS含量对蓝莓酵素SOD活力、pH值及TSS含量的影响如图1所示。从图1中可以看出,在不同的发酵条件下,pH值与TSS含量基本保持不变。图1d的TSS含量变化幅度大,这是因为初始TSS含量的不同。因而,将SOD活力作为主要指标进行单因素实验。由图1a所知,发酵到36 h时,SOD活力达到最高为86.67 U/g。当发酵时间小于36 h时,菌种的发酵速度正在加快,SOD活力未达到最大值。当发酵时间超过36 h时,由于发酵液中的菌种所利用的碳水化合物减少,使得发酵速度减慢,因而SOD活力下降。综上所述,当发酵到36 h时可以停止发酵。由图1b所示,当发酵温度为37 ℃时,SOD活性达到最高为86.44 U/g。当发酵温度低于或者高于37 ℃时,都不利于菌种的生长,使得SOD活力下降,因而37 ℃最适合发酵蓝莓酵素,这与梁贵秋等人[28]的研究结果(发酵最适温度为35~40 ℃)基本一致。由图1c可以看出,当发酵液中菌密度为5×106CFU/mL时,SOD活性最高达到81.64 U/g。当初始接种量低于5×106CFU/mL时,菌种不能充分利用发酵液中的碳源等营养物质使得SOD活力未达到最高值。当高于5×106CFU/mL时,菌密度因过饱和快速发酵,产大量的有机酸使得SOD活力下降[20]。因而可以将发酵液中的初始菌密度调整为为5×106CFU/mL。由图1d可以看出,当发酵液的初始可溶性固形物含量为11 °Brix时,SOD活性达到最高为85.49 U/g,当TSS含量低于11 °Brix时,菌种所需要利用的碳源不够,发酵速度下降因而使得SOD活力降低,当高于11 °Brix时,发酵液中糖量过高抑制了菌种的生长和代谢,使得SOD活力降低。因而将发酵液中的初始TSS含量调为11 °Brix。
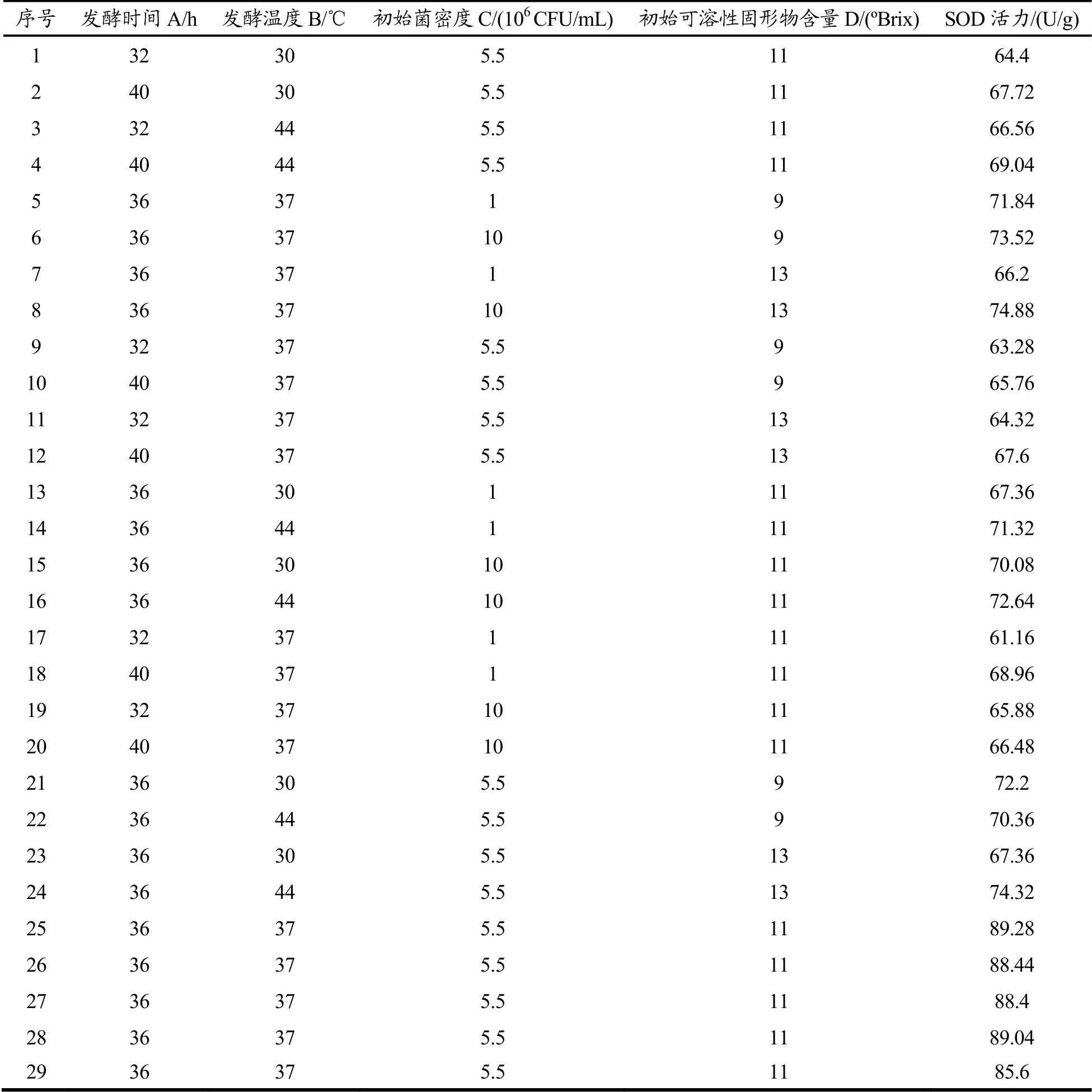
表5 响应面优化蓝莓酵素发酵工艺实验次数及结果Table 5 The experiments and results of response surface optimization of blueberry jiaosu fermentation process
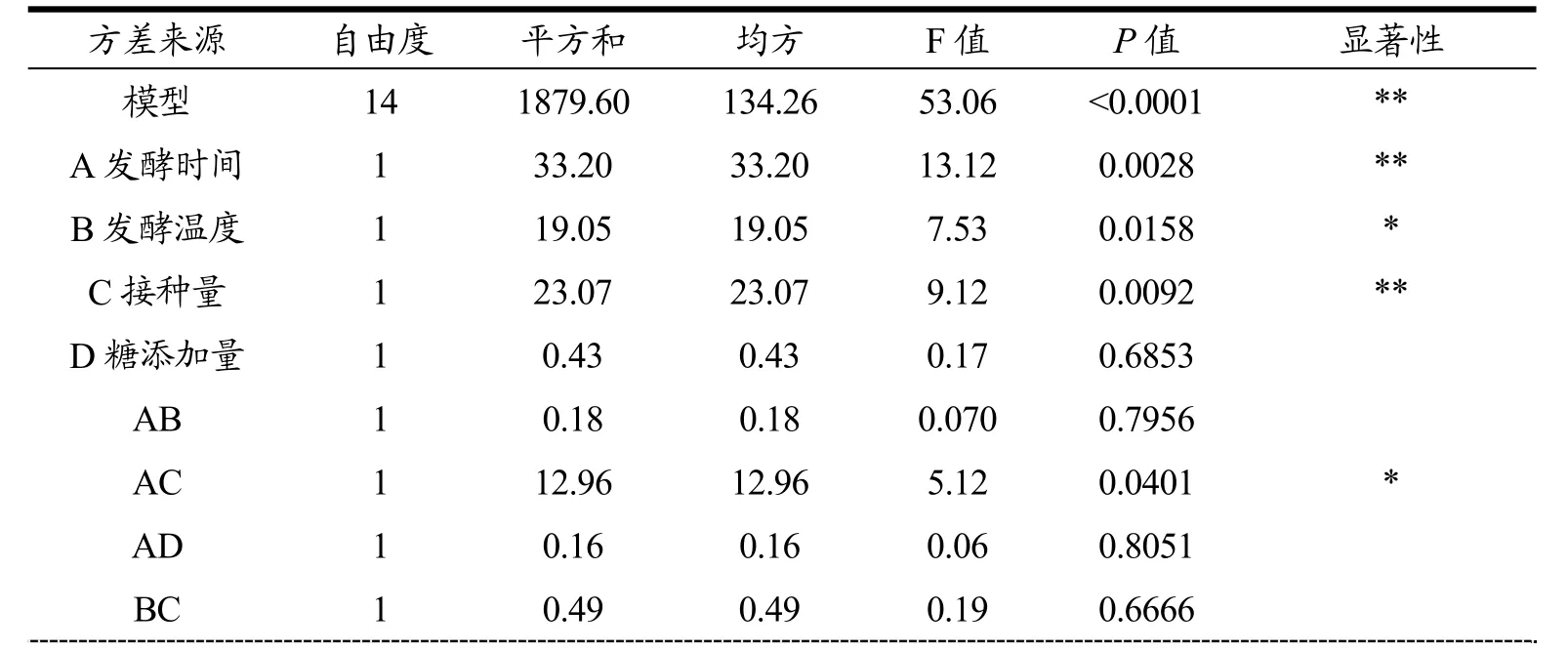
表6 蓝莓酵素SOD活力的多项式模型的方差分析Table 6 Analysis of variance to blueberry jiaosu of SOD activity
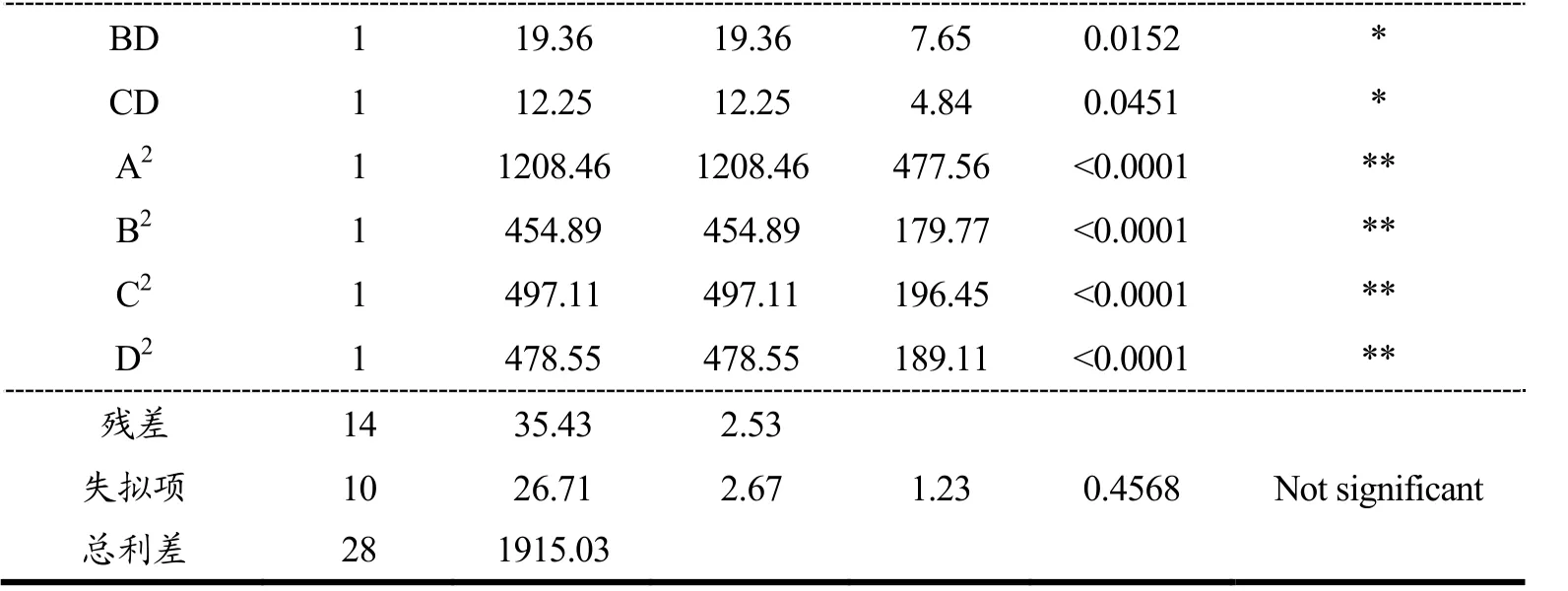
注:**具有高度显著性(p<0.01);*具有显著性(p<0.05);(*)较显著(0.05<p<0.1);R2=0.9815,RAdj=0.9630。
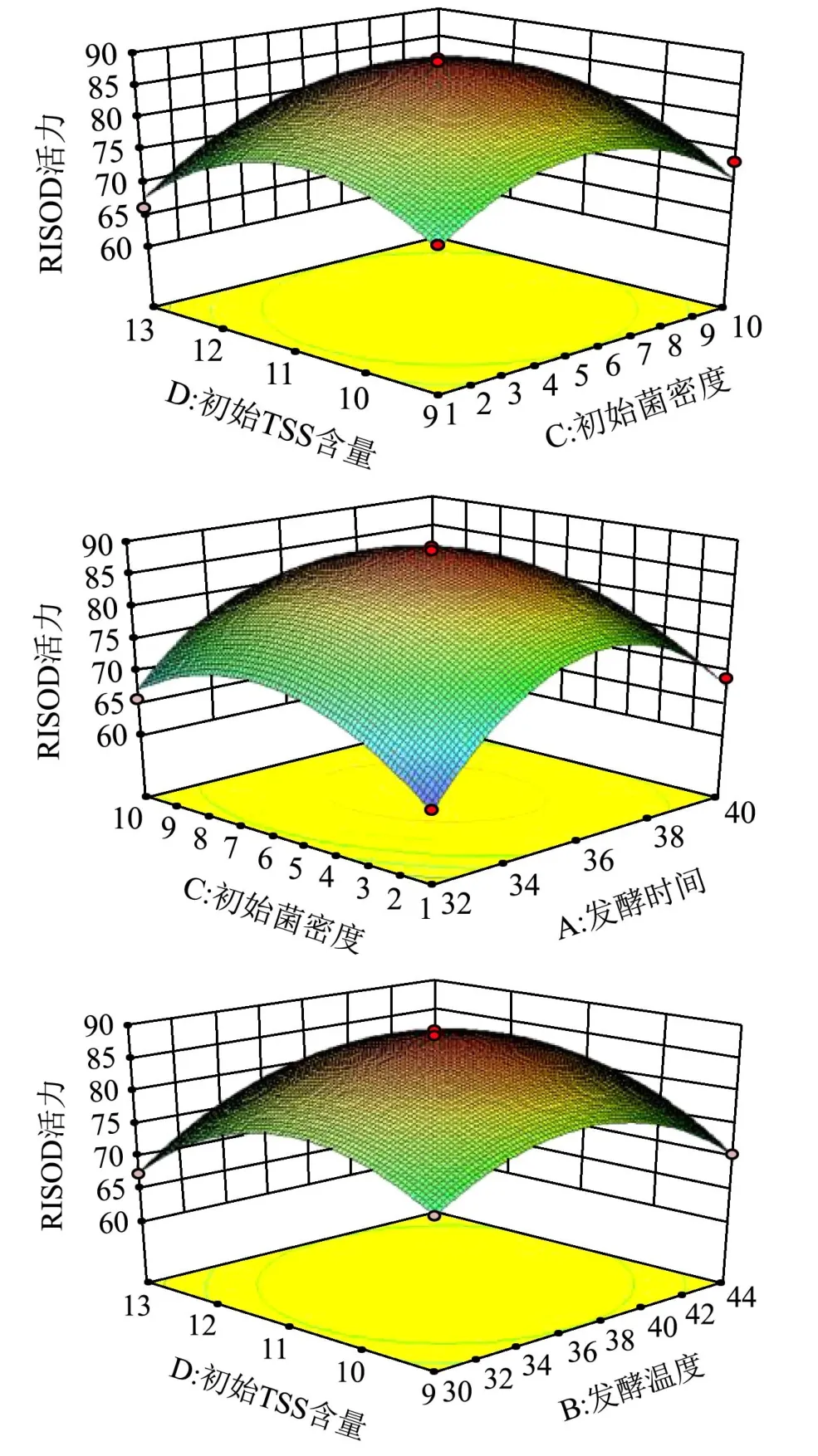
图2 因素相互作用对蓝莓酵素SOD活力的影响Fig.2 The influence of the interaction of factors on the SOD activity of blueberry juice
2.2.2 响应面法优化发酵工艺
依据单因素实验结果,可以看出各个单因素对蓝莓酵素的pH值及TSS含量影响基本一致,因而在进行响应面设计时,将SOD活力选择为响应值进行响应面实验设计。本研究设计了四因素三水平共29次试验的响应面分析,采用Box-Behnken原理对试验结果进行分析[29],得到蓝莓酵素SOD活力的二次回归方程为:

由方差分析图(表5)可以看出,模型的p<0.0001,具有高度显著性,证明该模型能很好的预测及优化发酵工艺。而失拟项的P值为0.4568(p>0.05),证明该模型对试验拟合度好。从表中还可以看出,发酵时间和接种量对蓝莓酵素SOD活力的影响具有高度显著性(p<0.01),发酵温度对SOD活力影响具有显著性(p<0.05),而糖添加量对蓝莓酵素SOD的影响不具有显著性(P=0.6853)。从表5及图2可以看出当某两个因素保持不变时,另外两个因素相互作用时对蓝莓酵素SOD活力的影响。可以看出,A因素与C因素、B因素与D因素、C因素与D因素之间的相互作用曲线变化趋势比较明显,这说明这几个因素的相互作用对蓝莓酵素SOD活力的影响具有显著性(p<0.05)。根据响应面结果预测出蓝莓酵素的最佳发酵工艺为发酵时间36.22 h,发酵温度37.52 ℃,初始接种量调整为5.82×106CFU/mL,初始可溶性固形物含量调整为11.01 °Brix,在此工艺条件下,蓝莓酵素的SOD活力最终可以达到88.29 U/g。为了验证响应面法优化的结果的准确性,本研究用优化出的工艺条件进行了5次试验。试验过程中为了方便操作,将蓝莓酵素的发酵工艺调整为发酵时间36 h,发酵温度37 ℃,初始接种量为5.5×106CFU/mL,初始可溶性固形物含量为11 °Brix,发酵后蓝莓酵素的SOD活力平均达87.45 U/g,与预测值很接近,由此证明,该模型可以很好的预测蓝莓酵素的发酵工艺。刘鑫[2]等人用植物乳杆菌和酵母菌发酵蓝莓酵素,发酵出的酵素中SOD活力达到81.27 U/g<87.45 U/g,由此说明,多菌种发酵可以提高蓝莓酵素的SOD活力。除此之外,实验得出蓝莓果实的SOD活力为59.05 U/g<87.45 U/g,增加了48%,这说明发酵有效增加了蓝莓果实的SOD活性。
2.3 蓝莓酵素色差分析
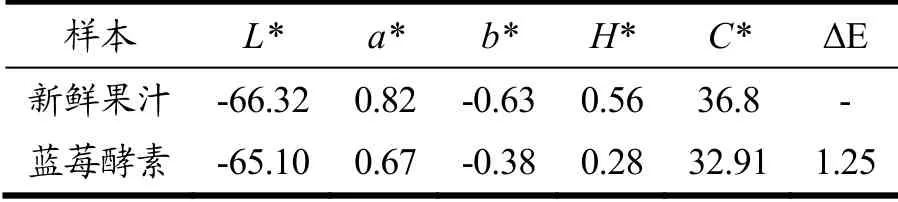
表7 蓝莓酵素在发酵前后的颜色特性的变化Table 7 Changes in the color characteristics of blueberry jiaosu before and after fermentation
表7展示了蓝莓酵素在发酵前后的颜色特性的变化,包括L*(亮度)、a*(红绿色)、b*(黄蓝色)、H*(透明度)、C*(色彩角)、ΔE(色差)。蓝莓酵素颜色的变化与花青素的含量相关[30]。从表中可以看出,发酵后,蓝莓酵素的L*、b*值下降,这与花青素含量密切相关。而a*值也呈现了轻微的下降趋势,这可能是由于在发酵过程中的灭菌过程对花青素的分子结构造成了破坏,使得花青素含量下降从而导致a*值降低,但发酵后的果汁总体呈现暗红色[31]。然而,ΔE值只有1.25,这表明在发酵前后蓝莓酵素的颜色改变并不明显。
3 结论
五种不同的菌种被用于发酵蓝莓酵素,以SOD活性、pH值、TSS含量为指标,首先通过均匀设计确定每种菌种接种体积比例为植物乳杆菌22.45%、乳酸片球菌42.86%、嗜酸乳杆菌24.29%、副干酪乳杆菌16.33%、鼠李糖乳杆菌4.1%。接着通过响应面法优化出最佳发酵工艺为发酵时间36 h,发酵温度37 ℃,初始接种量为5.5×106CFU/mL,初始可溶性固形物含量调整为为11 °Brix,发酵后蓝莓酵素的SOD活力最终达到87.45 U/g。通过对蓝莓进行发酵,不仅提高了蓝莓产业的经济效益,而且对于蓝莓的营养价值有一定的提高。适合于发酵蓝莓酵素的有益菌种多种多样,本研究仅挑选了五种菌种,还有大量的菌种等待我们去探索研究。
