乳酶生片中乳酸菌的分离鉴定及其增殖培养条件优化
2021-06-04苑园园龚建刚王子娇郭凯元封龙宽季明月
苑园园,龚建刚,王子娇,郭凯元,孙 炜,封龙宽,季明月
(1.衡水学院 生命科学学院,河北 衡水 053000;2.河北农业大学食品科技学院,河北 保定 071001;3.天津市红桥区市场监督管理局,天津 300131)
乳酶生也叫食母生,是一种微生态活菌制剂,其在肠道中能分解乳糖生成乙酸和乳酸,进而降低pH值。同时,通过分解乳糖产生的细菌素能够抑制有害微生物的繁殖,起到缓解消化异常、减轻腹泻腹胀等作用[1-2]。乳酶生生产菌种开始时命名为“乳酸肠球菌”,后更改为肠链球菌(Streptococcus faecalis)、粪肠球菌(Enterococcus faecalis)[3]。近年来,许多研究发现[4-6],由于早期鉴定手段落后或命名不规范等原因,乳酶生生产菌株粪肠球菌有可能为屎肠球菌(E.faecium)。2015年中国药典二部正文品种第一部分已对该问题进行了正式更改[7]。16S rDNA在原核生物中具有高度保守性,可通过比较其序列同源性高低来判断微生物种属关系,是菌种鉴定中常用的分子生物学方法[8],也是传统形态和生理生化鉴定法的补充和佐证。
屎肠球菌是一种农业部允许作为饲料添加剂使用的乳酸菌,能促进营养物质吸收、抑制其他有害菌生长[9-12],如果开发成动物微生态制剂会有很大的应用前景。实现工业化生产的关键是提高其生物量即活菌量,但由于屎肠球菌作为乳酸菌的一种,常使用的MRS培养基价格高,难以推广应用。
本试验通过传统培养分离法从乳酶生片中分离乳酸菌,采用生理生化试验及分子生物学技术对分离菌株进行鉴定,并以活菌数为响应指标,采用单因素试验及响应面试验对其增殖培养条件及培养基成分进行优化,以期降低制造成本的同时,为工业生产提供理论依据。
1 材料与方法
1.1 材料与试剂
1.1.1 培养基
基础增殖培养基[13]:葡萄糖20 g,蛋白胨10 g,酵母浸粉20 g,硫酸镁0.28 g,硫酸锰0.18 g,加蒸馏水至1 L。固体培养基中添加20 g琼脂粉。121 ℃高压蒸汽灭菌15 min。
1.1.2 主要试剂
乳酶生片(15 g):桂林南药股份有限公司;TIANamp细菌基因组脱氧核糖核酸(deoxyribonucleic acid,DNA)提取试剂盒:北京天根生化科技有限公司;葡萄糖(分析纯):天津市北方天医化学试剂厂;蛋白胨(生化试剂):北京双旋微生物培养基制品厂;酵母浸粉、乳糖(均为生化试剂):北京索莱宝科技有限公司;硫酸镁、硫酸锰(均为分析纯):北京奥博星生物技术有限责任公司;乳清粉(食品级):河南郑州万盛食品添加剂公司。其他试剂均为国产分析纯。
1.2 仪器与设备
FLC-3型超净工作台:哈尔滨市东联电子技术开发有限公司;YXQ-SG46-280S型高压蒸汽灭菌锅、SPX-250B-Z型生化培养箱:上海博讯实业有限公司医疗设备厂;CP214型电子天平:奥豪斯仪器(上海)有限公司;ZHWY-2102C型恒温培养振荡器:上海智城分析仪器制造有限公司;QL-861型旋涡振荡器:海门市其林贝尔仪器制造有限公司;ST300型便携式pH计:奥豪斯仪器(常州)有限公司;DYY-10C型电泳仪:北京市六一仪器厂;SimpliAmpTM热循环仪:美国ABI公司;070-851型聚合酶链式反应(polymerase chain reaction,PCR)仪:德国Biometra公司。
1.3 方法
1.3.1 乳酸菌的分离
用无菌镊子夹取一粒乳酶生片,加入灭菌生理盐水中溶解,按10倍梯度稀释,选择合适稀释度的稀释液涂布到基础增殖培养基平板中,37 ℃倒置培养1 d。选取形态一致的单菌落反复纯化后,冻存于甘油管,并命名为Y1。使用前在基础增殖液体培养基中37 ℃、200 r/min条件下活化2次。
1.3.2 乳酸菌的鉴定
形态观察:将菌株Y1划线接种于基础增殖培养基平板,37 ℃条件培养24 h,观察菌落形态,并进行革兰氏染色,采用显微镜观察其细胞形态。
生理生化试验[14]:对菌株Y1进行触酶、精氨酸产氨、耐胆盐、耐盐性、糖发酵等生理生化试验。
分子生物学鉴定:采用TIANamp细菌基因组DNA提取试剂盒提取菌株Y1的DNA,以其为模板,采用16S rDNA通用引物27F(5'-AGAGTTTGATCCTGGCTCAG-3')和1541R(5'-AAGGAGGTGATCCAGCCGCA-3')进行PCR扩增。PCR扩增条件:94 ℃预变性10 min;94 ℃变性45 s,55 ℃退火45 s,72 ℃延伸90 s,共30个循环;72 ℃再延伸5 min。PCR扩增产物经1%琼脂糖凝胶电泳检测合格后送至华大基因公司进行测序,将测序结果提交至美国国家生物技术信息中心(national center for biotechnology information,NCBI)的GenBank数据库中进行基本局部比对搜索工具(basic local alignment search tool,BLAST)比对搜索,选取同源性较高的模式菌株的16SrDNA基因序列,采用MEGA 5.0软件中的邻接(neighbor-joining,NJ)法构建系统发育树。
1.3.3 增殖培养条件优化
将菌液按3%(V/V)的接种量接种到pH 7.0的基础增殖培养基中,于200 r/min、不同温度(23 ℃、30 ℃、37 ℃、44 ℃)条件下培养24 h后测定活菌数,考察温度对活菌数的影响,确定最适培养温度。在此基础上,依次考察不同接种量(1%、3%、5%)、不同初始pH值(4.0、5.0、6.0、7.0、8.0、9.0)对活菌数的影响。
1.3.4 增殖培养基优化
单因素试验:选取不同碳源(乳糖、乳清粉、蔗糖、糖蜜、红糖、可溶性淀粉)代替基础增殖培养基中葡萄糖,将菌液按1%(V/V)的接种量接种,37 ℃、200 r/min条件下培养24 h,测定活菌数。在此基础上,依次考察碳源添加量(0、1 g/L、5 g/L、10 g/L、20 g/L)、氮源种类(乳清粉、牛肉膏、硫酸铵、豆饼粉代替蛋白胨)及添加量(0、5 g/L、10 g/L、20 g/L、30 g/L)、生长因子种类(番茄汁、胡萝卜汁[15]、玉米浆代替酵母浸粉)及添加量(0、2.5 g/L、5 g/L、10 g/L、20 g/L、30 g/L)对活菌数的影响。
响应面试验:在单因素试验的基础上,选择乳糖添加量(A)、乳清粉添加量(B)及酵母浸粉添加量(C)为考察因素,活菌数(Y)为响应值,进行Box-Behnken响应面试验,试验因素与水平见表1。

表1 增殖培养基优化响应面试验因素与水平Table 1 Factors and levels of response surface tests for proliferation medium optimization
1.3.5 菌体活菌计数方法
将发酵液10倍梯度稀释,取0.1 mL适宜稀释度液体涂布于基础增殖固体培养基平板上,37 ℃培养48 h,根据GB/T 4789.35—2016《食品安全国家标准食品微生物学检验乳酸菌检验》,采用平板菌落计数法测定菌液中的活菌数。
1.3.6 数据处理及统计学分析
试验处理均包括3次平行试验,结果为3次试验的平均值,以“平均值±标准偏差”的形式表示。采用Design Expert V8.0.6软件拟合试验结果,对拟合方程做显著性检验及方差分析。
2 结果与分析
2.1 乳酶生片中乳酸菌的鉴定
2.1.1 形态学鉴定
通过传统培养分离法从乳酶生片中分离得到一株菌株,编号为Y1,其在基础增殖培养基上的菌落及细胞形态见图1。
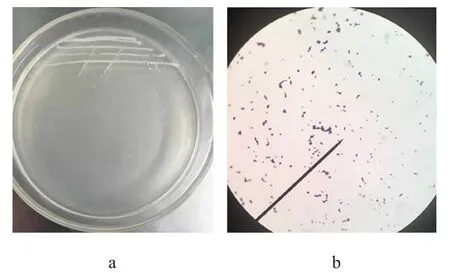
图1 菌株Y1的菌落形态(a)和细胞形态(b)Fig.1 Colony morphology (a) and cell morphology (b) of strain Y1
由图1可知,菌株Y1的菌落呈圆形,直径约1 mm,乳白色,边缘整齐,稍隆起;经镜检菌体为球形,成双或短链状排列,革兰氏阳性菌。
2.1.2 生理生化试验
菌株Y1的生理生化试验结果见表2。由表2可知,菌株Y1不能产过氧化氢,不能利用鼠李糖,能利用果糖、麦芽糖、蔗糖、乳糖、阿拉伯糖、纤维二糖等,说明该乳酸菌能够利用大部分单糖及二糖。此外,该菌株能够在6.5%NaCl和40%胆盐环境中生长,参考《伯杰细菌鉴定手册》[16]和《乳酸细菌分类鉴定及实验方法》[17],初步判断分离到的菌株Y1为肠球菌属(Enterococcussp.)。

表2 菌株Y1的生理生化试验结果Table 2 Results of physiological and biochemical tests of strain Y1
2.1.3 分子生物学鉴定
基于16S rDNA基因序列菌株Y1的系统发育树见图2。
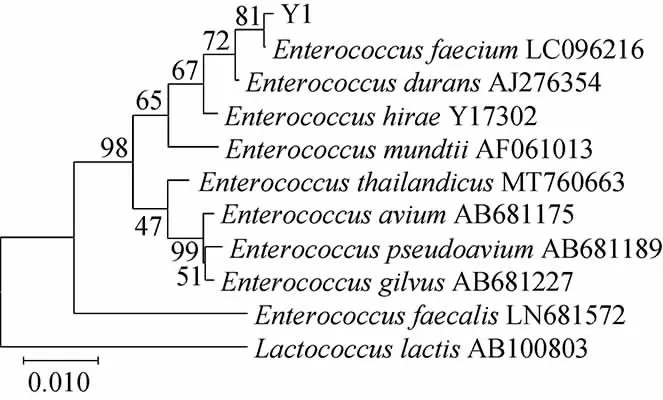
图2 基于16S rDNA基因序列菌株Y1的系统发育树Fig.2 Phylogenetic tree of strain Y1 based on 16S rDNA gene sequences
由图2可知,菌株Y1与屎肠球菌(Enterococcus faecium)聚于一支,亲缘关系最近,序列相似性为99.79%。结合形态特征、生理生化特性,判定菌株Y1为屎肠球菌(Enterococcus faecium)。
2.2 屎肠球菌Y1增殖培养条件的优化
2.2.1 最适培养温度的确定
由图3可知,随着培养温度的升高,菌株Y1的活菌数呈先升高后下降的趋势。菌株Y1在23 ℃、30 ℃、37 ℃条件下生长较好,具有较强的适应性。当培养温度达到37 ℃时,菌株Y1的活菌数最高为1.16×109CFU/mL;但当温度升高到44 ℃时,活菌数最低为1.65×108CFU/mL,这些结果符合屎肠球菌生长温度范围在10~45 ℃之间的特征[18]。因此,选择37 ℃作为最适培养温度。

图3 不同培养温度对屎肠球菌Y1生长的影响Fig.3 Effect of culture temperature on Enterococcus faecium Y1 growth
2.2.2 最适接种量的确定
由图4可知,当接种量为1%时,菌株Y1的活菌数最高为1.21×109CFU/mL,接种量为3%和5%时,活菌数均有所下降,可能是因为次级代谢产物的产生,影响了菌种的生长。因此,选择接种量1%为最适接种量。
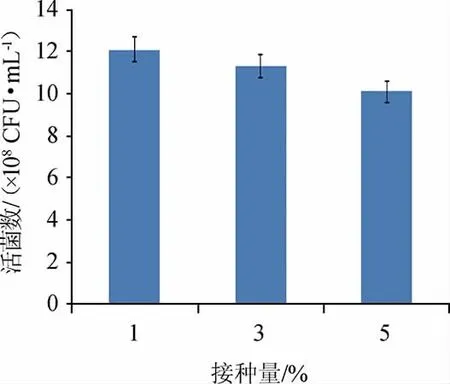
图4 不同接种量对屎肠球菌Y1生长的影响Fig.4 Effect of different inoculum on Enterococcus faecium Y1 growth
2.2.3 最适初始pH值的确定
由图5可知,随着初始pH值的增大,菌株Y1的活菌数呈先升高后降低的趋势,当初始pH值为8.0时,活菌数最高,达1.23×109CFU/mL。说明随着初始pH值的升高,菌种中和发酵过程中的有机酸的能力增强[19],减轻了对菌体的毒害作用。当初始pH值为4.0时,平板上没有菌生长,其原因可能是发酵产生的大量乳酸积累,抑制了菌体的生长,这一结果也恰好符合屎肠球菌生长的初始pH范围在4.5~9.6之间的特征,为菌株Y1是屎肠球菌的鉴定结果提供了一个证据。因此,确定该菌株的最适初始pH值为8.0。

图5 培养基初始pH值对屎肠球菌Y1生长的影响Fig.5 Effect of initial pH of medium on Enterococcus faecium Y1 growth
2.3 菌株Y1增殖培养基的优化
2.3.1 碳源种类对屎肠球菌Y1生长的影响
由图6可知,当碳源为乳糖时,活菌数最高,为1.3×109CFU/mL,原因可能是屎肠球菌Y1对单糖和双糖利用速度较快[18]。因此,确定最佳碳源为乳糖。
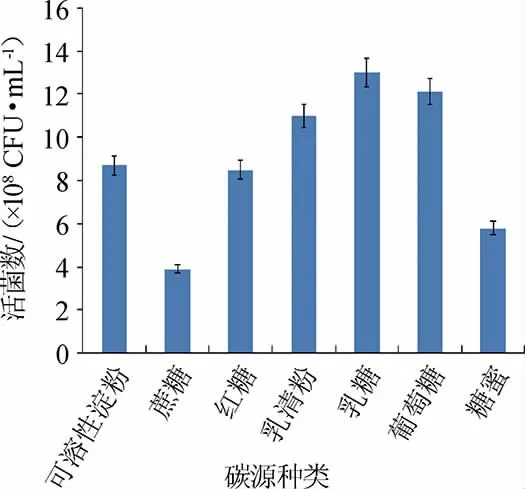
图6 碳源对屎肠球菌Y1生长的影响Fig.6 Effect of carbon sources on Enterococcus faecium Y1 growth
2.3.2 乳糖添加量对屎肠球菌Y1生长的影响
碳源的浓度直接影响培养基中微生物的生长[20-21],由图7可知,随着乳糖添加量的增加,菌株Y1的活菌数呈先升高后下降的趋势,分析原因可能是当乳糖含量过低时,菌体生长缓慢,而当乳糖含量过高,随培养时间延长,pH值过快下降,进而导致营养成分离子化程度受到影响,微生物生长趋势减缓[22]。当乳糖添加量为10 g/L时,活菌数最高为1.49×109CFU/mL。因此,确定最佳乳糖添加量为10 g/L。
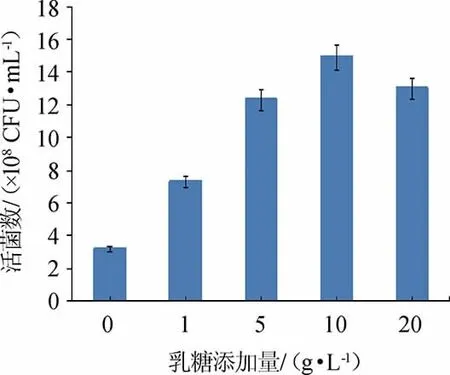
图7 乳糖添加量对屎肠球菌Y1生长的影响Fig.7 Effect of lactose addition on Enterococcus faecium Y1 growth
2.3.3 氮源种类对屎肠球菌Y1生长的影响
由图8可知,当氮源为乳清粉时,活菌数明显高于其他氮源。可能因为乳清粉营养丰富,含有屎肠球菌生长所需乳清蛋白、氨基酸等物质。乳清粉是干酪素或干酪生产过程中的副产物,经济实惠,来源广泛易得[23]。因此,确定最佳氮源为乳清粉。
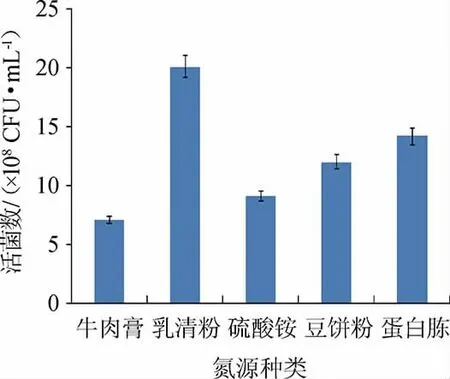
图8 氮源对屎肠球菌Y1生长的影响Fig.8 Effect of nitrogen sources on Enterococcus faecium Y1 growth
2.3.4 乳清粉添加量对屎肠球菌Y1的影响
由图9可知,随着乳清粉添加量的增加,菌株Y1的活菌数呈先升高后趋于平缓的趋势,当乳清粉添加量为10 g/L时,活菌数最高为2.07×109CFU/mL。因此,确定最佳乳清粉添加量为10 g/L。
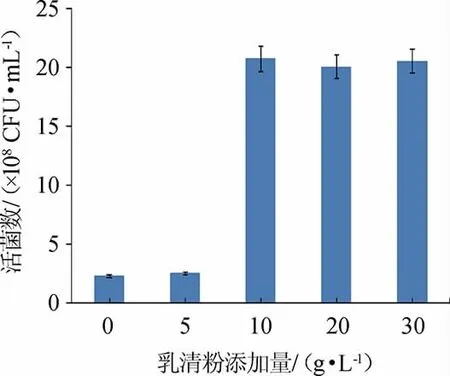
图9 乳清粉添加量对屎肠球菌Y1生长的影响Fig.9 Effect of whey powder addition on Enterococcus faecium Y1 growth
2.3.5 生长因子对屎肠球菌Y1生长的影响
由图10可知,当以酵母浸粉为生长因子时,活菌数高于其他组。同时考虑到酵母浸粉来源和质量稳定,微生物利用和增殖稳定[24]。因此,确定酵母浸粉为最佳生长因子。
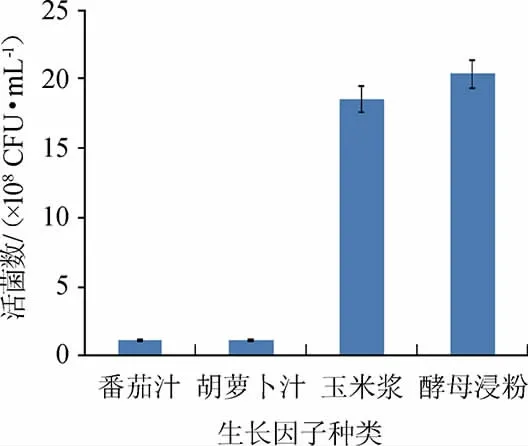
图10 生长因子对屎肠球菌Y1生长的影响Fig.10 Effect of growth factors on Enterococcus faecium Y1 growth
2.3.6 酵母浸粉添加量对屎肠球菌Y1生长的影响
由图11可知,随着酵母浸粉添加量的增加,菌株Y1的活菌数呈先升高后趋于平缓的趋势。当酵母浸粉添加量为20 g/L时,活菌数最高,为2.05×109CFU/mL。因此,确定最佳酵母浸粉添加量为20 g/L。
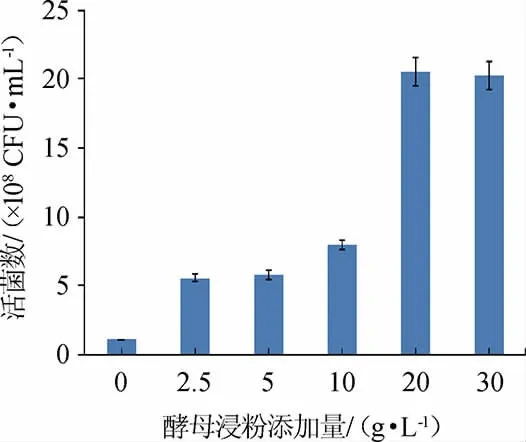
图11 酵母浸粉添加量对屎肠球菌Y1生长的影响Fig.11 Effect of yeast extract powder addition on Enterococcus faecium Y1 growth
2.4 屎肠球菌Y1增殖培养基优化响应面试验
2.4.1 响应面结果及方差分析
屎肠球菌Y1增殖培养基优化响应面试验设计及结果见表3,方差分析结果见表4。
借助Design-Expert V8.0.6软件对表3的试验数据进行处理,拟合得到三元二次回归方程:
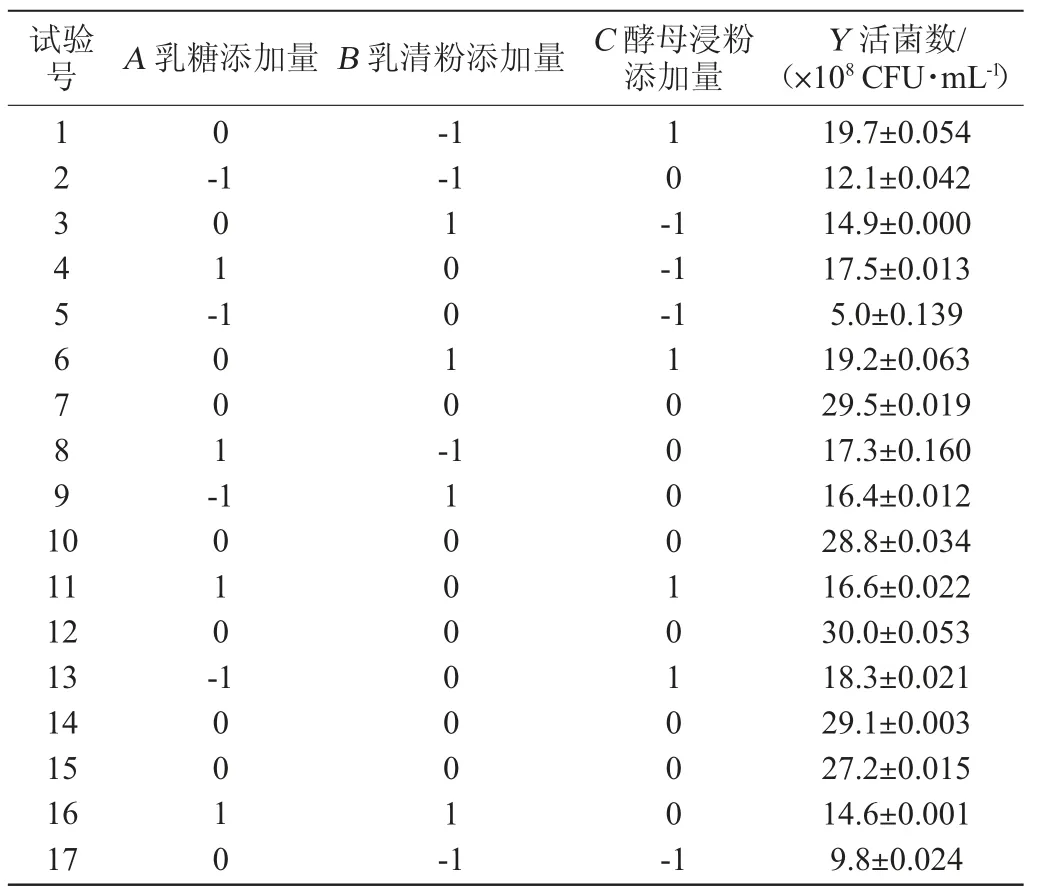
表3 屎肠球菌Y1增殖培养基优化响应面试验设计及结果Table 3 Design and results of response surface experiments for proliferation medium optimization of Enterococcus faecium Y1
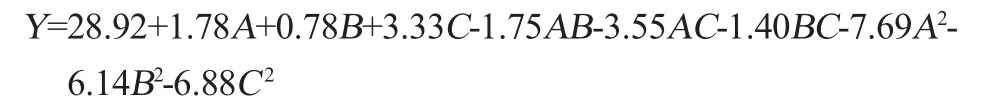
由表4可知,模型的P值<0.000 1,极显著,失拟项P值>0.05,不显著,说明该模型能较好地模拟和验证试验结果,试验误差较小。决定系数R2=0.985 3,调整决定系数R2Adj=0.966 5,说明试验结果与模型预测结果有98.53%的符合度,只有1.88%不能由该模型来解释。方程中一次项A和C、交互项AC及二次项A2、B2、C2对结果影响极显著(P<0.01),二次项AB对结果影响显著(P<0.05),其他项对结果影响不显著(P>0.05)。
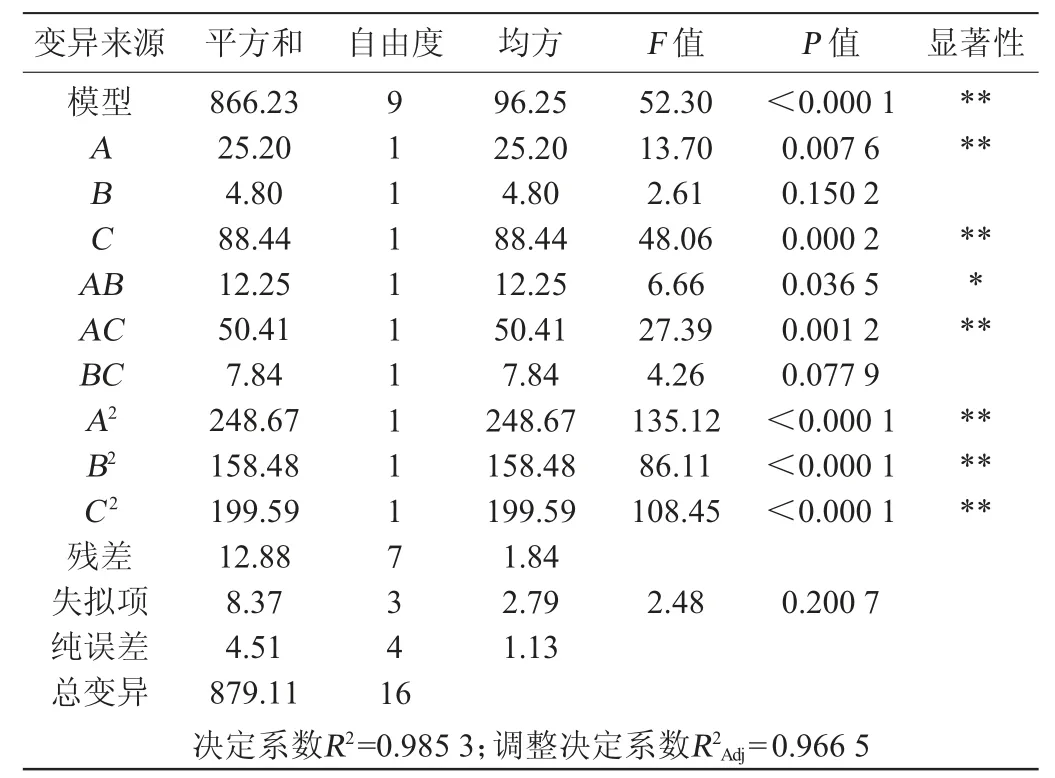
表4 回归模型的方差分析Table 4 Variance analysis of regression model
2.4.2 响应面交互作用分析
响应曲面越陡峭,说明在固定一个因素不变时,其余两个因素的交互作用对屎肠球菌Y1活菌数影响越大;相反响应曲面越平滑,说明对屎肠球菌Y1活菌数影响越小[25]。由图12可知,乳清粉添加量(B)和酵母浸粉添加量(C)等高线图呈圆形,表明两因素间的交互作用不显著。乳糖添加量(A)和乳清粉添加量(B)、乳糖添加量(A)和酵母浸粉添加量(C)的等高线呈椭圆形,表明两因素之间交互作用显著,与方差分析结果一致。

图12 各因素间交互作用对屎肠球菌Y1活菌数影响的响应面及等高线Fig.12 Response surface plots and contour lines of effects of interaction between each factor on the viable bacteria count of Enterococcus faecium Y1
由Design Expert V8.0.6软件分析得到屎肠球菌Y1增殖培养基的最佳配方为乳糖添加量10.60 g/L,乳清粉添加量10.30 g/L,酵母浸粉添加量22.23 g/L,理论上预测屎肠球菌Y1的活菌数为2.94×109CFU/mL。
2.4.3 验证优化结果
为便于实际操作,将最优培养基配方修订为乳糖添加量11 g/L,乳清粉添加量10 g/L,酵母浸粉添加量22 g/L。为验证试验结果的可靠性,对优化的最佳配方进行3次平行试验,得出屎肠球菌Y1活菌数的平均实际值为2.90×109CFU/mL,与理论值相差不大,说明该模型的分析准确度和可信度较高,重复性和可操作性较强。
3 结论
本研究采用传统培养分离法从乳酶生片中生分离得到一株乳酸菌Y1,经形态学观察、生理生化试验及分子生物学技术鉴定为屎肠球菌(Enterococcus faecium),其最适培养条件为初始pH 8.0,生长温度37 ℃,接种量1%,最优增殖培养基为乳糖11 g/L,乳清粉10 g/L,酵母浸粉22 g/L,硫酸镁0.28 g/L,硫酸锰0.18 g/L。在最佳培养条件及最佳培养基培养所得E.faeciumY1的活菌数为2.90×109CFU/mL,比优化前活菌数提高了80.12%。
