红树莓果汁降酸发酵过程中活性成分的变化
2021-06-04陈思睿何红英王金玲
陈思睿,唐 莹,董 丹,蒋 莹,何红英,王金玲,2,*
(1.东北林业大学林学院,黑龙江 哈尔滨 150040;2.黑龙江省森林食品资源利用重点实验室,黑龙江 哈尔滨 150040)
红树莓属蔷薇科(Rosaceae)悬钩子属(RubusL.)植物,果实中含有丰富的类黄酮、酚酸、丹宁等酚类化合物[1],具有抗氧化[2]、抗炎、降血脂、降血糖等多种功效[3]。树莓酮是红树莓的特征性香气成分,能够提供甜果香并具有一定预防肥胖和降血脂作用[4]。这些成分是影响红树莓功能和营养特性的重要因素[5]。
红树莓适合进行多类型的食品开发利用,然而高柠檬酸含量[6]影响了其口感风味,限制了相关产品的开发。生物降酸是指利用能以有机酸为碳源的微生物,分解果汁或果酒中的有机酸,是一种有效的降酸方法,同时还能够增加果汁或果酒的风味[7]。降酸菌发酵动态过程中,果汁中营养成分会随之发生变化。生物降酸的研究集中在总酸和有机酸含量的变化,而降酸对活性成分影响的研究很少。马旭艺[8]对山葡萄酒采用化学法协同生物法降酸,仅研究了有机酸含量和比例组成的变化。李静[9]在猕猴桃酒中接入植物乳杆菌降解苹果酸,仅对成品的总酚含量进行了测定。
本研究探讨利用陆生伊萨酵母(Issatchenkia terricola)WJL-G4菌株降酸过程对红树莓果汁中活性成分的影响,测定发酵过程中活性成分的变化,采用相关性分析和主成分分析(principal component analysis,PCA)法分析发酵过程与活性成分之间的关系,以期为阐明该降酸菌的发酵特征及其在高酸果汁降酸的应用提供理论支持。
1 材料与方法
1.1 材料与试剂
红树莓:品种为秋福,购于黑龙江省尚志市,速冻处理后运回东北林业大学食品科学与工程实验室冻藏。
降酸酵母菌:由本实验室在红树莓鲜果中筛选分离得到,经菌株形态学观察、生理生化实验和分子生物学鉴定为陆生伊萨酵母,命名为陆生伊萨酵母WJL-G4[10],以下简称为降酸菌。
柠檬酸培养基:(NH4)2SO42 g,KH2PO42.5 g,FeSO4·7H2O 0.1 g,酵母膏0.5 g,柠檬酸20 g,琼脂粉25 g,溶于1 L蒸馏水。
熊果苷、没食子酸、隐绿原酸、对羟基苯甲酸、绿原酸、新绿原酸、咖啡酸、表儿茶素、丁香酸、对香豆酸、树莓酮、芥子酸、金丝桃苷、芦丁、鞣花酸、槲皮素、木犀草素、黄芩素(分析标准品) 上海源叶生物科技有限公司;甲醇(色谱纯) 赛默飞世尔(中国)有限公司;甲酸(色谱纯) 天津市大茂化学试剂厂;常规药品试剂均为国产分析纯。
1.2 仪器与设备
SW-CJ-1FD型单人净化工作台 苏州净化设备有限公司;DH6000A型电热恒温培养箱 天津市泰斯特仪器有限公司;5030-PVL型高压灭菌锅 长春百奥生物仪器有限公司;721N型可见分光光度计 上海精密科学仪器有限公司;1260 Infinity II高效液相色谱(high performance liquid chromatography,HPLC)仪 美国安捷伦科技有限公司。
1.3 方法
1.3.1 红树莓果汁的降酸处理
红树莓冻果自然解冻后,打浆1 min,果胶酶(40 000 U/g)添加量为0.02%(m/m),50 ℃酶解2 h。酶解后90 ℃灭酶5 min,8 层纱布过滤取果汁,置于灭菌锥形瓶中,巴氏杀菌后冷却。
处理组:菌株接种于装有100 mL柠檬酸培养基的250 mL锥形瓶中,28 ℃、120 r/min培养24 h制成种子液,将活菌数为8×107CFU/mL的降酸菌种子液,以接种量4%(V/V)接种于上述红树莓果汁中,果汁装液量为50 mL/250 mL锥形瓶,于28 ℃静置培养8 d。
对照组:以在相同培养条件放置的未接种的红树莓果汁作为对照。
发酵所使用的红树莓果汁总酸质量浓度为25.16 g/L,pH值为3.08。前期实验得出,以8 d为降酸发酵周期,总酸降酸率可达60.41%,pH值可由3.08上升为3.36[10],本实验的处理组和对照组在降酸发酵的第0、1、2、3、4、5、6、7、8天取样,进行测定。
1.3.2 活性成分测定
总酚测定采用Folin-Ciocalteu比色法[11],765 nm波长处吸光度为y,没食子酸质量浓度为x(μg/mL),绘制标准曲线得到:y=0.007 2x+0.033 7,R2=0.993 5;总黄酮测定采用NaNO2-Al(NO3)3-NaOH比色法[12],510 nm波长处吸光度为y,芦丁质量浓度为x(μg/mL),绘制标准曲线得到:y=0.001x+0.071 3,R2=0.996 2;花色苷测定采用pH值示差法[13]。
1.3.3 HPLC分析
色谱柱:Agilent ZORBAX Extend-C18(250 mm×4.6 mm);流动相:A为甲醇,B为0.02%甲酸溶液;梯度洗脱程序:0~5 min,0~10% A,100%~90% B;5~10 min,10%~20% A,90%~80% B;10~20 min,20%~35% A,80%~65% B;20~35 min,35%~40% A,65%~60% B;35~40 min,40%~75% A,60%~25% B;40~45 min,75%~10% A,25%~90% B;流速:0.8 mL/min,进样量:10 μL,柱温:35 ℃,检测波长:280 nm。依次测定标样系列和样品。用标样浓度对峰面积绘制标准曲线,测定样品中的活性成分含量。
标准曲线:分别用甲醇溶解标准品配制成不同质量浓度的标准溶液,经0.22 μm的微孔滤膜过滤后进行HPLC分析,得到峰面积(x)和活性成分质量浓度(y)的回归方程及相关系数。
样品处理:果汁样品4 000 r/min离心15 min,吸取上清液,经0.22 μm滤膜过滤后测定。
1.3.4 分析方法
1.3.4.1 数据统计与分析
实验均进行3 次重复,采用Excel软件对测定数据进行整理统计,计算活性成分的平均值、标准差。采用Origin 8.5软件进行作图。采用SPSS 19.0软件中Duncan法进行多重差异显著性分析[14]。
1.3.4.2 适用性检验
采用SPSS 19.0分析软件中的Pearson分析法对活性成分的含量进行相关系数矩阵的直观检验,根据相关系数矩阵中相关系数反映出的原始变量之间的线性相关程度进行适用性检验[15]。
1.3.4.3 PCA
采用SPSS 19.0分析软件对活性成分的含量进行PCA,得到解释的总方差表,其中包括相关矩阵的特征值、方差贡献率、累计方差贡献率,抽取其中特征值大于1.00的因子作为PC。根据载荷向量、得分等对发酵过程中红树莓果汁活性成分进行分析。PCA载荷向量除以方差的算术平方根得到系数(特征向量),根据系数得到PC的函数表达式[16],计算各PC得分并制图。
2 结果与分析
2.1 降酸菌对红树莓果汁活性成分的影响
发酵所使用的红树莓果汁总酚质量浓度为1.33 mg/mL,总黄酮质量浓度为0.69 mg/mL,花色苷质量浓度为30.22 mg/L。在28 ℃静置发酵8 d,以未接菌的红树莓果汁为对照,测定发酵过程中不同时间所取样品中总酚、总黄酮和花色苷含量。
由图1A可知,处理组和对照组总酚含量在发酵0~2 d显著降低(P<0.05),在第3天时二者相差不大;4~7 d处理组含量略高于对照组。发酵8 d,处理组总酚质量浓度为0.95 mg/mL,对照组为1.04 mg/mL,分别为初始质量浓度的71.87%和78.38%。与对照组对比可知处理组在0~2 d总酚含量显著降低(P<0.05)的原因可能包括菌株发酵和放置环境,菌株生长繁殖代谢产生的酶,会分解多酚等大分子物质[17];赵玉等[18]研究指出多酚在高温、过酸或过碱、光照条件下含量均显著降低,且多酚同样对温度和光照敏感;赵广河等[19]研究表示有些发酵过程会导致丹宁的溶出、酸性环境下多酚分子重排、多酚的自聚合及与其他大分子的互作。
由图1B可知,处理组总黄酮含量先减少后上升,第7天与第0天相比总黄酮含量显著升高(P<0.05),对照组发酵过程没有显著变化(P>0.05)。发酵8 d,处理组总黄酮质量浓度为0.77 mg/mL,对照组为0.67 mg/mL,分别为初始质量浓度的111.32%和97.04%,处理组与对照组相比含量升高。降酸处理后总黄酮含量增加可能是因为酵母菌的代谢活动起到促进作用,酶促反应有利于黄酮的释放[20],也可能是经酵母菌代谢其他物质转化而来。有研究表明,微生物可合成黄酮类物质或者改善合成途径[21]。Cao Hui等[22]指出动物双歧杆菌可以改变绿茶多酚中黄酮类化合物,说明某些微生物生物转化能够产生黄酮类物质。
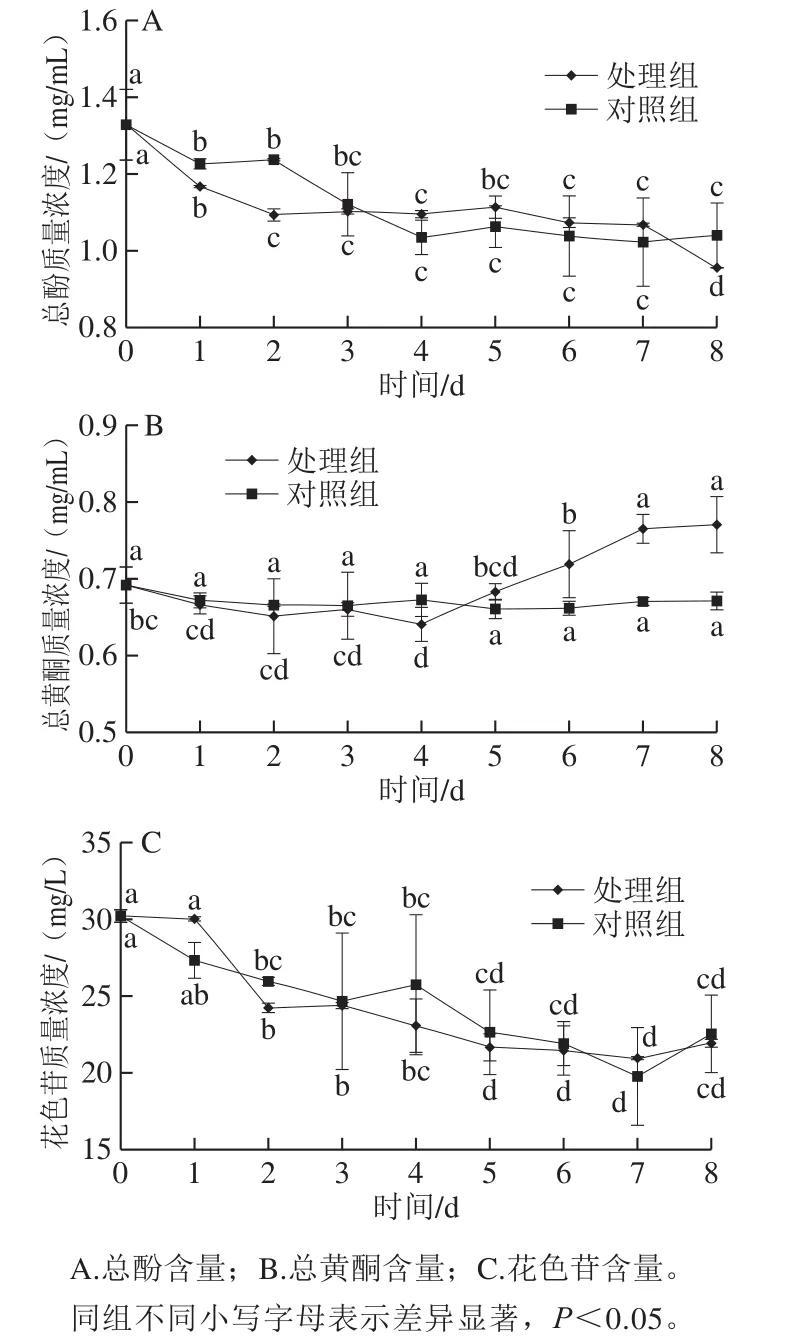
图1 降酸发酵过程中红树莓果汁中活性成分变化Fig.1 Variation of bioactive components in red raspberry juice during fermentation
由图1C可知,处理组和对照组花色苷含量均呈逐渐下降趋势,5 d后含量均无显著变化(P>0.05)。发酵8 d,处理组质量浓度为21.92 mg/L,对照组为22.54 mg/L,分别为初始质量浓度的72.51%和74.59%。处理组与对照组对比可知,含量下降程度相似,因此认为降酸发酵对花色苷影响小,主要是环境因素导致花色苷损失。Turker等[23]研究发现,25 ℃贮藏90 d的胡萝卜中花色苷随着时间的延长,单体花色苷含量和色度降低,花色苷降解后生成聚合物进而导致褐变。本实验降酸发酵温度为28 ℃,此温度下放置可能导致花色苷受温度影响含量降低。
2.2 HPLC分析
标准品和0 d红树莓果汁的HPLC如图2所示。在45 min内,各种活性成分能得到较好分离,从红树莓果汁中共检测出18 种活性成分,通过色谱峰与标准品保留时间的对照,确定图2中的1~18峰分别为熊果苷、没食子酸、隐绿原酸、对羟基苯甲酸、绿原酸、新绿原酸、咖啡酸、表儿茶素、丁香酸、对香豆酸、树莓酮、芥子酸、金丝桃苷、芦丁、鞣花酸、槲皮素、木犀草素和黄芩素。可以分类为10 种酚酸(峰2、3、4、5、6、7、9、10、12、15)[24]、7 种类黄酮(峰1、8、13、14、16、17、18)和芳香类化合物树莓酮(峰11)。王锟等[25]从树莓酒中测出21 种多酚类物质,其中包括芦丁、对羟基苯甲酸、绿原酸、鞣花酸、槲皮素、没食子酸、咖啡酸、对香豆酸和芥子酸。孙侨冶[26]利用超高效液相色谱-串联质谱技术检测从“秋福”红树莓果实中共鉴定出5 种非花色苷酚类物质,分别为咖啡酸、儿茶素、香草酸、鞣花酸和槲皮素。Lugasi等[2]通过反相HPLC对红树莓中黄酮类物质进行定量,检测到鞣花酸和槲皮素,未检测到木犀草素。本研究测定结果基本涵盖了上述种类。
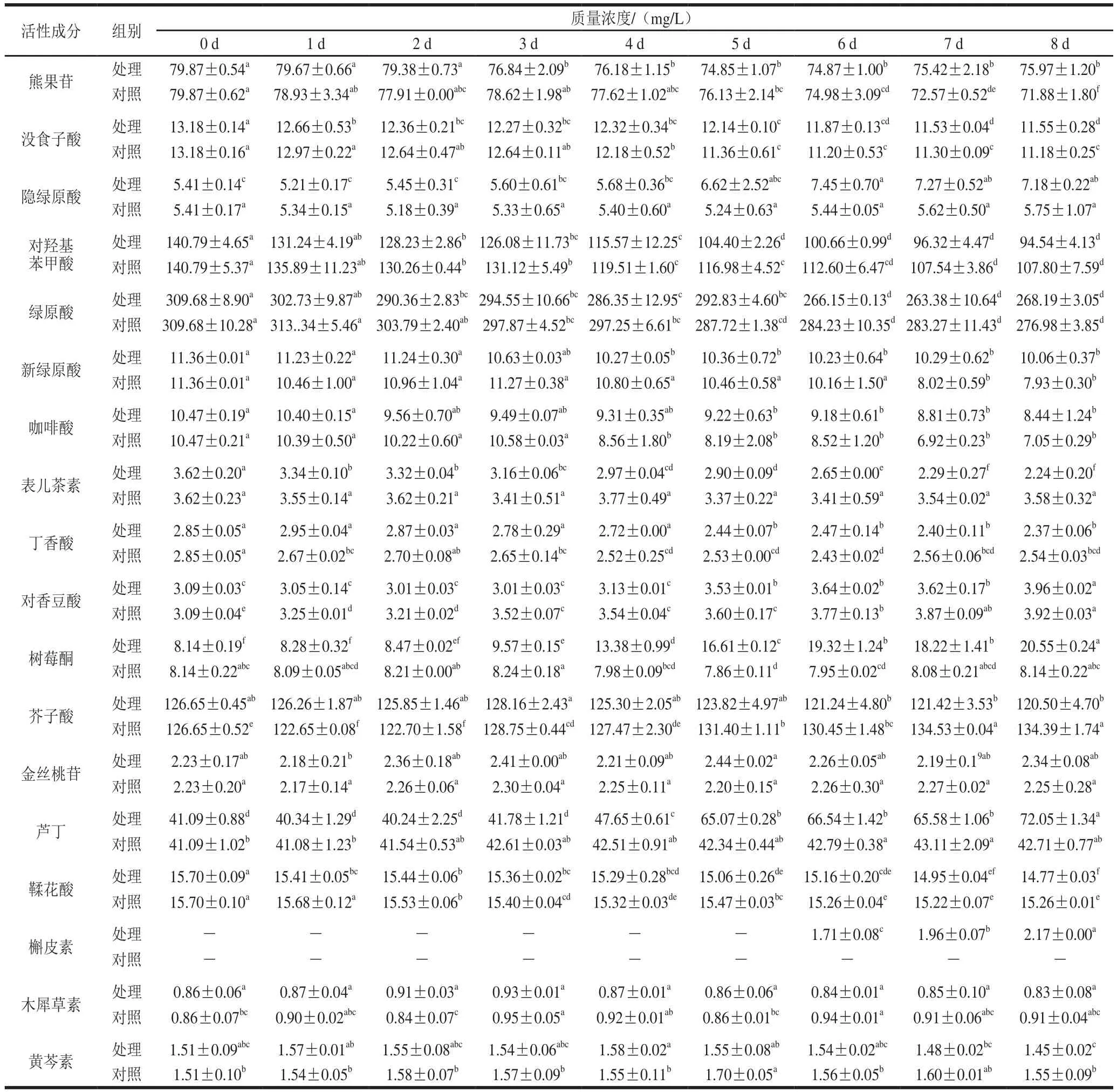
表1 红树莓果汁降酸发酵过程中活性成分的组成和含量Table 1 Contents of bioactive components in red raspberry juice during fermentation
由表1可知,在红树莓果汁降酸发酵过程中,活性成分呈现几种不同的变化趋势,且与总酚和总黄酮含量变化相似。其中熊果苷、没食子酸、对羟基苯甲酸、绿原酸、新绿原酸、咖啡酸、表儿茶素、丁香酸和鞣花酸含量显著降低(P<0.05);隐绿原酸、对香豆酸、树莓酮、芦丁和槲皮素含量显著升高(P<0.05);芥子酸含量先升高后降低;金丝桃苷、木犀草素、黄芩素无显著性变化(P>0.05)。作为对照的果汁在静置过程中,熊果苷、没食子酸、对羟基苯甲酸、绿原酸、新绿原酸、咖啡酸、丁香酸和鞣花酸的含量显著降低(P<0.05);对香豆酸、芦丁和槲皮素含量显著升高(P<0.05);芥子酸含量先降低再升高后稳定,树莓酮含量略微下降后保持在相对稳定水平;隐绿原酸、表儿茶素和金丝桃苷含量变化无显著性(P>0.05);木犀草素和黄芩素含量呈波动变化且无显著性差异(P>0.05),未检出槲皮素。
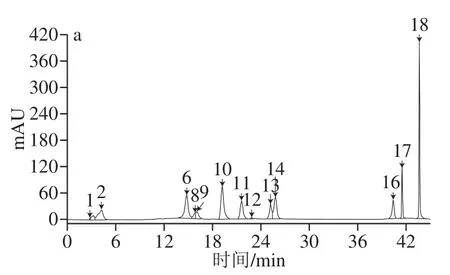
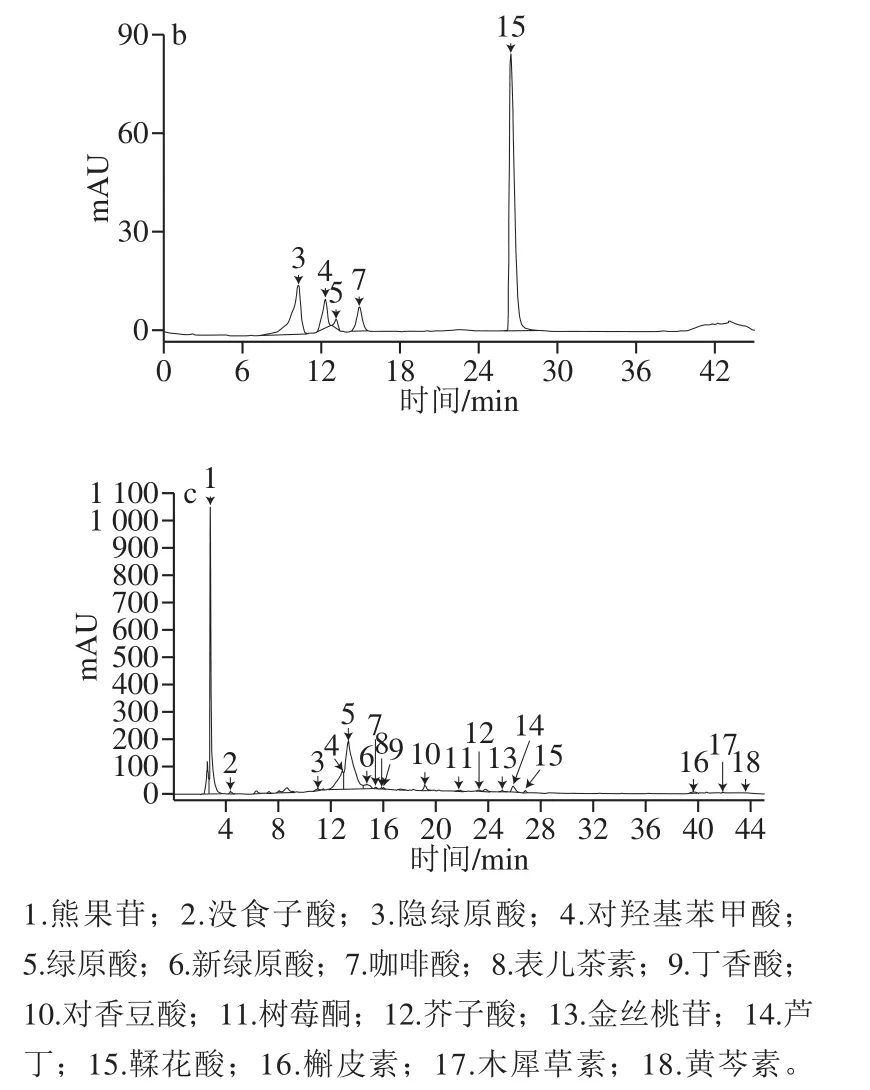
图2 标准品混合液(a、b)和红树莓果汁中活性成分(c)的HPLC图Fig.2 HPLC chromatograms of mixed reference substances (a, b)and bioactive components in red raspberry juice (c)
第8天处理组和对照组中,显著下降(P<0.05)的成分含量保留率分别为:熊果苷为95.12%和90.00%、没食子酸为87.63%和84.83%、对羟基苯甲酸为67.15%和76.57%、绿原酸为86.60%和89.44%、新绿原酸为88.56%和69.81%、咖啡酸为80.61%和67.34%、丁香酸为83.16%和89.12%、鞣花酸为94.08%和97.20%,说明环境因素是导致这些成分下降的主要原因。对羟基苯甲酸、绿原酸、丁香酸和鞣花酸保留率比对照略低,说明这些成分也受到降酸发酵的影响。原因可能是总酸含量的下降会对酚类化合物的稳定性造成影响,导致部分酚类化合物含量降低,其次可能是因酵母生长代谢被消耗或转化为其他化合物。有研究表明,没食子酸和对羟基苯甲酸经过发酵后含量会减少[27];绿原酸是多酚氧化酶在有氧条件下的主要底物,绿原酸的减少可能是由于在多酚氧化酶存在下的酸降解[28];Clark等[29]研究发现白葡萄酒中的黄烷醇型酚类化合物例如表儿茶素会发生氧化反应,随后发生聚合反应;芥子酸是常见的肉桂酸型酚酸[30],羟基肉桂酸易与其他物质形成酯的形式存在[31];鞣花酸常以不同形式存在,如鞣花鞣质、鞣花酸糖苷等,很少是游离鞣花酸[32],有些酵母产生的次级代谢产物与鞣花酸结合产生沉淀[33],导致其含量降低。还有部分成分含量有所提升,芦丁和隐绿原酸含量明显增加;槲皮素含量升高推测是由其他物质如肉桂酸和柚皮苷等经过生化代谢途径转化而来[34],部分芦丁发生降解,槲皮素含量也会增加[35];姜燕等[4]探讨树莓酒在主发酵期间树莓酮含量的变化,采用HPLC测定树莓酮含量有所提高,说明微生物发酵可以提高树莓酮的含量。树莓酮是具有典型树莓风味特征的关键风味成分[36],其含量的提高对果汁整体风味有积极作用。

表2 相关性分析Table 2 Correlation analysis
2.3 降酸发酵中红树莓果汁活性成分的PCA
2.3.1 适用性分析
PCA将原来众多具有一定相关性的指标进行简化,重新组合成一组新的互相无关的综合指标代替原来的指标[37],以解决多重相关性问题的目的。相关性分析能够反映各活性成分间密切程度,活性成分相关系数矩阵直观检验结果如表2所示,除金丝桃苷外,其他酚酸物质、类黄酮物质和树莓酮的含量之间存在普遍显著正相关或负相关关系,多数成分之间的相关系数绝对值大于0.5[15],表明活性成分含量之间有较强相关性,可以通过PCA方法研究红树莓果汁中活性成分与降酸发酵的关系。
2.3.2 PCA
根据表1显示的活性成分质量浓度,用于PCA。由表3可知,提取出的3 个PC的累计方差贡献率为93.098%>80%,即可解释原变量93.098%的信息且基本反映了所有原变量的信息。以这3 个PC作为数据分析的有效成分,生成的PC载荷矩阵,其绝对值越大,对该PC影响越主要[38]。PC1的特征值为13.749,贡献率为76.382%,代表了全部信息的76.382%,主要反映了熊果苷、没食子酸、隐绿原酸、对羟基苯甲酸、绿原酸、新绿原酸、咖啡酸、表儿茶素、丁香酸、对香豆酸、树莓酮、芥子酸、芦丁、鞣花酸、槲皮素的含量,PC1与熊果苷、没食子酸、对羟基苯甲酸、绿原酸、新绿原酸、咖啡酸、表儿茶素、丁香酸、芥子酸和鞣花酸高度正相关,与隐绿原酸、对香豆酸、树莓酮、芦丁和槲皮素高度负相关,对PC1贡献最大的为对羟基苯甲酸和表儿茶素,载荷量分别为0.988和0.980,对PC1贡献最小的是树莓酮,载荷量为-0.973(表4);PC2的特征值为1.715,贡献率为9.528%,主要代表金丝桃苷和木犀草素的含量;PC3特征值为1.294,贡献率为7.188%。
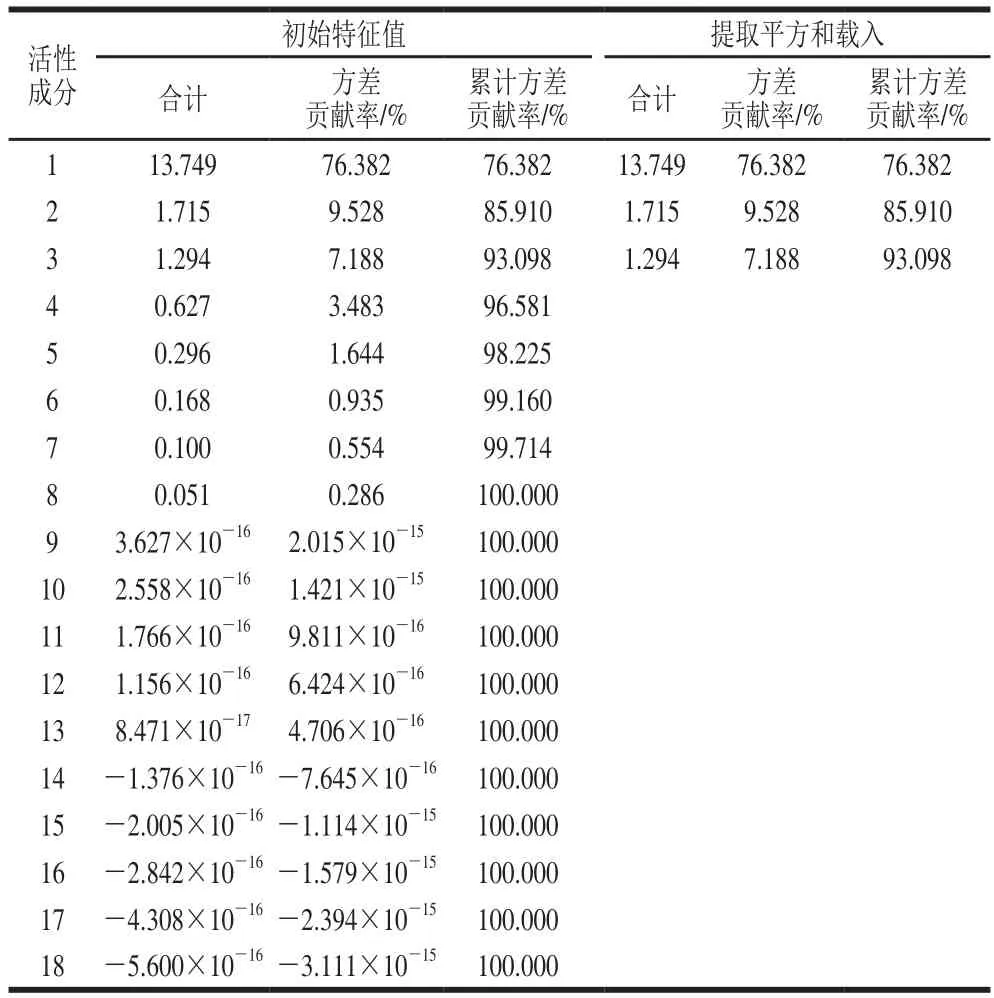
表3 PC特征值及解释的总方差Table 3 Eigenvalues and total variance explained in principal components analysis
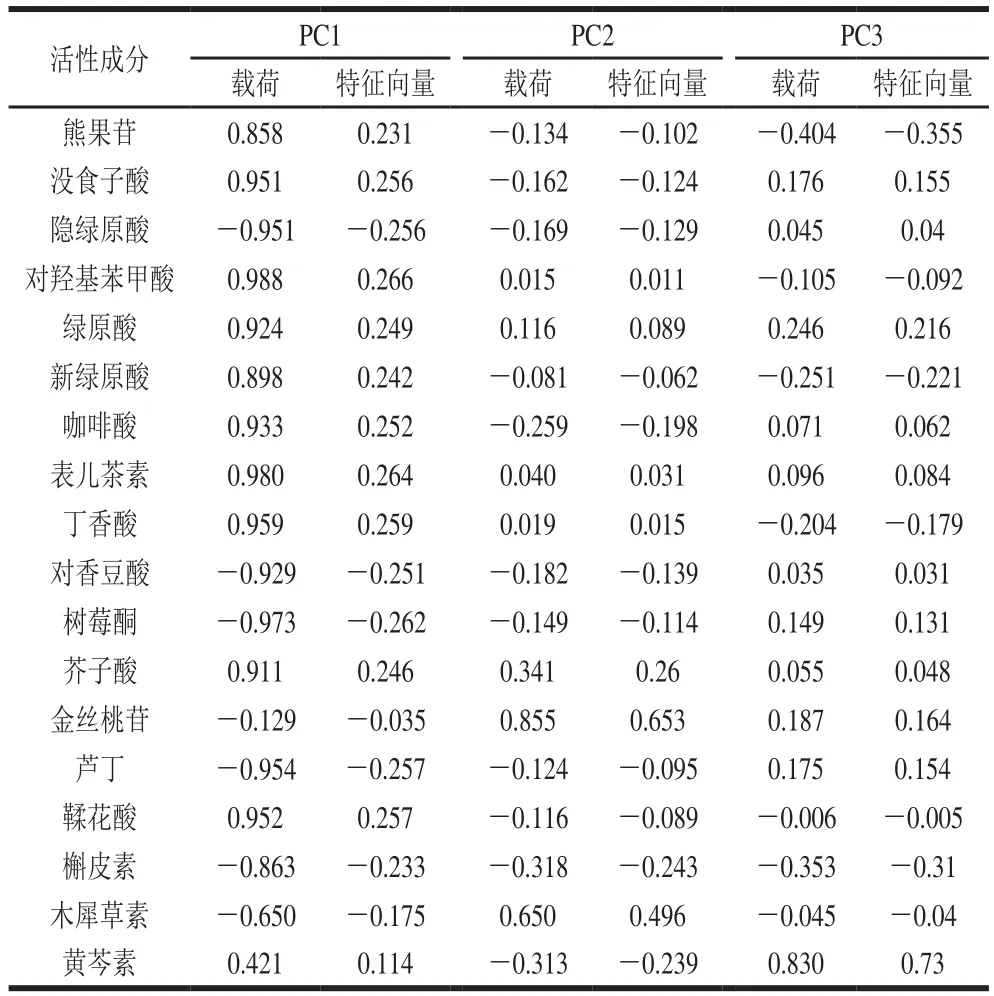
表4 PC载荷矩阵和特征向量Table 4 PC loading matrix with eigenvectors
PC的特征向量如表4所示。可利用F1、F2和F3这3 个新的综合指标替代原来的18 个指标对红树莓果汁中活性成分进行分析。PC1的特征向量分别乘以18 个原始变量标准化之后的变量即为PC1的函数表达式,同理可以得出PC2、PC3的函数表达式,计算整理得到的3 个PC的函数表达式分别如下(其中Z熊果苷~Z黄芩素为标准化变量):

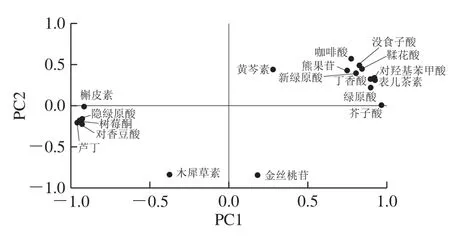
图3 降酸发酵过程中活性成分散点图Fig.3 Scatter plots of principal components 1 versus 2 for bioactive ingredients in red raspberry juice during fermentation
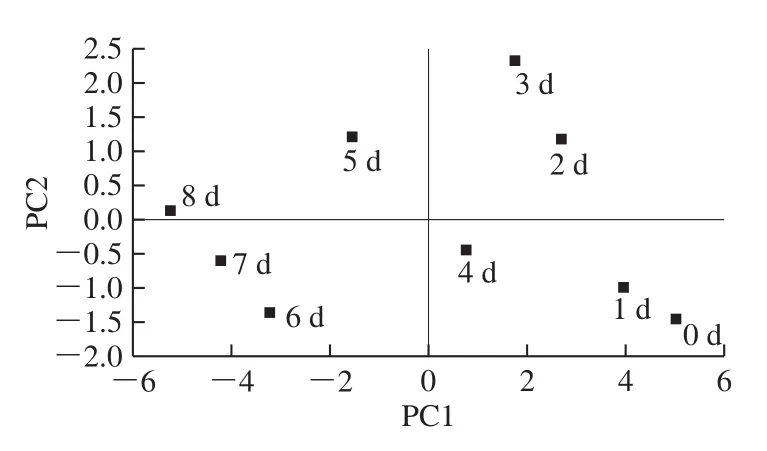
图4 PCA得分图Fig.4 Score plot of principal component analysis
保留前2 个PC简化结果,红树莓果汁在降酸过程中活性成分的PC1和PC2相关散点图和PCA得分图如图3、4所示,其中发酵2 d和3 d的红树莓果汁分布在PC1和PC2的正向区间,熊果苷、没食子酸、对羟基苯甲酸、绿原酸、新绿原酸、咖啡酸、表儿茶素、丁香酸、芥子酸、鞣花酸和黄芩素在PC1和PC2上呈正向分布,即这些活性成分和发酵2 d和3 d的红树莓果汁均与PC1、PC2呈正相关;发酵5 d和8 d的红树莓果汁分布在第2象限,说明其与PC1呈负相关,与PC2呈正相关,隐绿原酸、对香豆酸、树莓酮、芦丁和槲皮素在PC1为负向分布,即于坐标轴原点远端发酵8 d的红树莓果汁中,这些成分较为丰富;发酵6 d和7 d的红树莓果汁和隐绿原酸、对香豆酸、树莓酮、芦丁和槲皮素均分布在PC1和PC2的负向区间,均与PC1、PC2呈负相关,即于坐标轴原点远端发酵7 d的红树莓果汁中,这些成分较为丰富;发酵0、1 d和4 d的红树莓果汁处于第4象限,与PC1呈正相关,与PC2呈负相关,熊果苷、没食子酸、对羟基苯甲酸、绿原酸、新绿原酸、咖啡酸、表儿茶素、丁香酸、芥子酸、鞣花酸和黄芩素在PC1上呈正向分布,即于坐标轴原点远端发酵0 d和1 d的红树莓果汁中,这些成分含量较多,而隐绿原酸、对香豆酸、树莓酮、芦丁和槲皮素含量较低。由于PC1能够代表绝大多数的活性成分的信息,对得分的影响最大,可以选择处于PC1正向区间的发酵时间,即降酸发酵1~4 d,能够保证绝大多数成分的保留。
3 结论与讨论
陆生伊萨酵母WJL-G4在降酸发酵过程中,红树莓果汁总酚和花色苷含量呈现逐渐下降趋势,与对照果汁趋势相似,总黄酮含量明显增加。采用HPLC测定降酸过程和对照的果汁中活性成分,共鉴定出10 种酚酸、7 种类黄酮、1 种芳香类化合物。显著下降(P<0.05)的成分中,熊果苷、没食子酸、新绿原酸和咖啡酸完全受环境因素影响;对羟基苯甲酸、绿原酸、丁香酸和鞣花酸主要受环境因素影响,其次受降酸发酵影响;表儿茶素主要受降酸发酵影响。处理组中,隐绿原酸、对香豆酸、树莓酮、芦丁和槲皮素含量增加;芥子酸含量呈现先升高后降低的趋势;金丝桃苷、木犀草素、黄芩素含量基本保持稳定。黄鹭强[39]将具有降解苹果酸能力的重组酵母菌投放于枇杷原酒进行降酸发酵,24 ℃条件下发酵5 d,降酸量达1.80 g/L,降酸处理后2 种枇杷酒总黄酮质量浓度略微下降,分别由0.87 mg/L下降为0.81 mg/L,0.91 mg/L下降为0.84 mg/L;孙慧烨[40]利用植物乳杆菌降解苹果酒中苹果酸,降酸率达到31.5%,总酚质量浓度由1 217.865 mg/L下降为1 138.090 mg/L,均说明降酸发酵对活性成分略有影响。
对红树莓果汁中18 种活性成分进行PCA,提取的3 个PC反映原变量93.098%的信息,通过PC1和PC2的载荷分布图和得分图得出,随着发酵进行,PC1(76.382%)得分逐渐下降,总体得分也呈逐渐下降趋势,降酸发酵1~4 d分布于PC1的正向区间,得分较高。说明随着菌株发酵时间越长,红树莓果汁活性成分的变化也越大,可以选择在1~4 d范围内结束降酸,保证活性成分含量的较高水平。通过PCA能为降酸发酵前后果汁中活性成分含量变化提供一定参考依据,在后续研究中可以加入感官评价和香气物质等指标更全面地描述降酸发酵对果汁品质的影响,上述问题将在后续研究中继续探讨。
