N末端结构模块缺失对嗜热酸性III型普鲁兰多糖水解酶TK-PUL酶学性质的影响
2021-06-04何础阔郭建军
曾 静,何础阔,郭建军,袁 林,*
(1.江西省科学院微生物研究所,江西 南昌 330096;2.海南大学食品科学与工程学院,海南 海口 570228)
在淀粉酶法制糖工业中,由液化转入糖化时需要降低温度并加酸降低糖浆的pH值。并且糖化过程中使用了多种水解酶,这些因素使得淀粉制糖的生产成本增加,同时降低了生产效率[1-4]。此外,淀粉中α-1,6-糖苷键不仅抵抗α-淀粉酶和β-淀粉酶的水解作用,还阻碍邻近α-1,4-糖苷键的水解,从而导致α-(β)-极限糊精的产生,进而显著降低淀粉糖化的程度和效率[4]。若某种淀粉水解酶在液化条件下可以同时进行糖化,则既可以省去调节pH值的过程以简化工艺、降低成本,又可以有效地防止微生物污染,并且在液化的高温下,还可以获得较高的反应速率。因此,将液化过程和糖化过程合并,以便获得一种在液化条件下具有较强的水解α-1,4-糖苷键和α-1,6-糖苷键能力的淀粉水解酶成为从业者亟待解决的问题。
III型普鲁兰多糖水解酶是一种双功能淀粉水解酶,具有α-淀粉酶和普鲁兰酶的功能,可同时水解α-1,4-糖苷键和α-1,6-糖苷键[5-7]。嗜热酸性III型普鲁兰多糖水解酶能够在高温的液化条件下进行糖化作用,可使淀粉酶法制糖工业的液化过程和糖化过程合二为一,从而大大降低生产成本,提高生产效率[8-9]。嗜热酸性III型普鲁兰多糖水解酶在淀粉酶法制糖流程中具有很大应用优势,因此有关嗜热酸性III型普鲁兰多糖水解酶的研究已成为淀粉水解酶研究中的新热点。
来源于极端嗜热古生菌Thermococcus kodakarensisKOD1的嗜热酸性III型普鲁兰多糖水解酶TK-PUL的酶学性质完全符合淀粉酶法制糖工业的需求,并且已被证实可应用于液化与糖化一步法制备麦芽糖浆[10-14]。因此,TK-PUL在淀粉酶法制糖工业中具有重要的应用价值。此外,TK-PUL以单一活性中心同时水解α-1,4-糖苷键和α-1,6-糖苷键的双功能催化机制研究也具有重要理论研究价值。TK-PUL的氨基酸序列和三级结构显示,TK-PUL属于糖苷水解酶类的第13家族(GH13_20),其由N末端结构模块N1(Ser18~Ile77)、结构模块N2(Glu78~Phe180)、结构模块N(Tyr181~Glu280)和催化结构域GH13_20(Gly281~Gly762)组成[15]。结构模块N与催化结构域GH13_20紧密结合,并且经实验证实结构模块N是TK-PUL发挥催化活性所必需的(缺失结构模块N的突变体没有催化活性,结果未显示)。结构模块N1和结构模块N2与结构模块N和催化结构域GH13_20的结合较为松散,这2 个结构模块甚至不能以晶体形式呈现,在TK-PUL晶体结构中未能显示[15]。TK-PUL中结构模块N1和N2属于未知功能结构域,其对TK-PUL酶学性质的影响有待进行研究。本研究通过对TK-PUL的N末端进行截短突变,并比较TK-PUL与突变体的酶学特性,来确定N末端结构模块N1和N2对TK-PUL酶学性质的影响。
1 材料与方法
1.1 材料与试剂
大肠杆菌Escherichia coliJM109、枯草芽孢杆菌Bacillus subtilisRIK1285、TK-PUL表达载体pBE-S-Atkp均由本实验室保存;KOD-Plus-neo DNA聚合酶日本Toyobo公司;DNA限制性内切酶、T4 DNA连接酶、DNA Marker、蛋白质Marker 美国Fermentase公司;DNA胶回收试剂盒、质粒抽提试剂盒E.Z.N.A.美国Omega Bio-tek公司;Chelating SepharoseTMFast Flow美国GE Healthcare公司;普鲁兰糖、γ-环糊精、可溶性淀粉、玉米淀粉、糖原 美国Sigma公司;Bradford法蛋白浓度测定试剂盒、咪唑 生工生物工程(上海)股份有限公司;实验所用试剂均为国产分析纯。
1.2 仪器与设备
Mastercycler gradient聚合酶链式反应(polymerase chain reaction,PCR)仪 美国Eppendorf公司;TY04S-3C凝胶成像系统 北京君意东方电泳设备有限公司;SP-752PC紫外-可见分光光度计 上海光谱仪器有限公司。
1.3 方法
1.3.1 重组质粒的构建及鉴定
根据TK-PUL的基因编码序列(Gene ID:3235344),设计本研究中构建重组质粒所用引物,如表1所示。以重组质粒pBE-S-Atkp为模板,以P1和P2为引物进行PCR扩增,获得编码突变体M1的基因Atkp-m1。PCR扩增体系为:10×buffer I 5 μL;dNTP 5 μL;MgSO45 μL;引物各2 μL;模板1 μL;KOD-Plusneo DNA聚合酶2 μL;ddH2O 28 μL。PCR扩增条件为:94 ℃预变性5 min;94 ℃变性30 s,55 ℃退火20 s,68 ℃延伸1 min,35 个循环;68 ℃延伸10 min。扩增产物经NdeI和XbaI双酶切,连接至经相同双酶切处理的重组质粒pBE-S-Atkp,构建重组质粒pBE-S-Atkp-m1。以重组质粒pBE-S-Atkp为模板,以P3和P2为引物进行PCR扩增,获得编码突变体M3的基因Atkp-m3。重组质粒pBES-Atkp-m3的构建方法同上。采用NdeI和XbaI双酶切重组质粒,鉴定外源基因的插入情况。
采用大引物全质粒PCR技术[16]构建表达突变体M2的重组质粒pBE-S-Atkp-m2。以重组质粒pBE-S-Atkp为模板,采用突变引物P4和公用引物P5进行大引物的扩增,琼脂糖凝胶电泳检测PCR扩增效果。然后再以重组质粒pBE-S-Atkp为模板,采用上步获得的PCR产物(大引物)进行全质粒扩增。扩增产物经DpnI酶处理后,转化大肠杆菌E. coliJM109感受态细胞,涂布含有100 μg/mL氨苄青霉素的LB平板进行筛选,经测序鉴定是否为突变基因Atkp-m2。
将所得重组质粒均送至生工生物工程(上海)股份有限公司进行DNA测序,并将测序结果与TK-PUL的基因序列进行比对,确证重组质粒中插入基因的序列正确性。
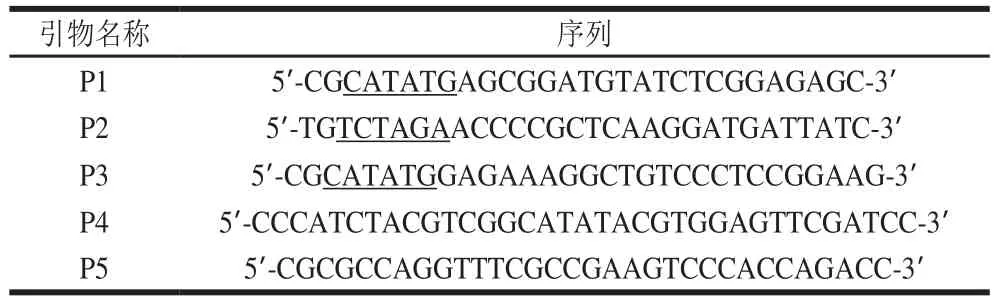
表1 构建重组质粒所用引物Table 1 Primer sequences used for the construction of recombinant plasmids
1.3.2 重组蛋白质的诱导表达和纯化
将重组质粒转入枯草芽孢杆菌B. subtilisRIK1285,获得重组枯草芽孢杆菌。B. subtilisRIK1285感受态细胞的制备和转化采用改进的Spizizen法[17]进行。
接种重组枯草芽孢杆菌单克隆到LB液体培养基中,250 mL三角瓶中培养,装液量20 mL,37 ℃振荡培养过夜。然后转接该培养物于新鲜LB液体培养基中,用250 mL三角瓶进行培养,其中培养基的装液量为25 mL,接种量为3%,培养温度为37 ℃,转速为200 r/min,培养时间为48 h。待培养结束后,将培养物于室温12 000 r/min离心5 min,收集发酵液上清。
采用Ni2+亲和层析柱对发酵上清液中目的蛋白质进行纯化,用200 mmol/L咪唑缓冲液洗脱,即得到纯化后的重组蛋白质。采用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulphate-polyacrylamide gel electrophoresis,SDS-PAGE)检测重组蛋白质的纯度[18],并采用Bradford法[18]测定重组蛋白质的浓度。
1.3.3α-淀粉酶活性测定和普鲁兰酶活性测定
以可溶性淀粉或普鲁兰多糖为底物,分别测定III型普鲁兰多糖水解酶的α-淀粉酶活性和普鲁兰酶活性。将10 μL酶液(10 μg/mL)与490 μL含1 mg/mL可溶性淀粉或普鲁兰多糖的pH 4.5、50 mmol/L 4-吗啡啉-乙烷磺酸(4-morpholineethanesulfonic acid,MES)缓冲液混合,于100 ℃反应30 min后,迅速放入冰水浴中终止反应,然后采用3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)法[19]测定反应体系中还原糖量。酶活力单位(U)定义:在一定反应条件,每分钟催化产生1 μmol还原糖的酶量为一个酶活力单位。
1.3.4 最适反应pH值及pH值稳定性测定
将酶液与不同pH值的底物(10 mg/mL的可溶性淀粉或普鲁兰多糖)混合,于100 ℃反应30 min测定不同pH值下α-淀粉酶活性和普鲁兰酶活性。将所测得的最高酶活力定义为100%,并以相对酶活力对pH值作图,确定其最适反应pH值。采用不同缓冲液配制质量浓度均为10 mg/mL的不同pH值的底物:50 mmol/L MES缓冲液(pH 3.0~7.0)、50 mmol/L 3-吗啡啉-丙磺酸缓冲液(pH 7.0~9.0)。
将酶液用不同pH值(3.0~9.0)缓冲液稀释,将其在不同pH值条件下于37 ℃处理2 h,然后用10 mg/mL的缓冲液稀释,并根据如上反应体系测定样品的比活力。将未处理样品的比活力定义为100%,计算处理后样品的相对酶活力,并以相对酶活力对pH值作图,评价酶的pH值稳定性。
1.3.5 最适反应温度及热稳定性测定
按照1.3.3节中反应体系混合酶液和底物,分别于40~110 ℃反应30 min,测定不同温度下α-淀粉酶活力和普鲁兰酶活力。将所测得的最高酶活力定义为100%,以相对酶活力对温度作图,确定其最适反应温度。
用50 mmol/L MES、pH 4.5缓冲液将样品稀释至适当浓度,将其于100 ℃保温,分时间梯度取出部分样品,根据1.3.3节中反应体系测定α-淀粉酶活性和普鲁兰酶活性。将未处理的酶液的酶活力定义为100%,计算样品的相对酶活力,以相对酶活力对时间作图,评价酶的热稳定性。
1.3.6 动力学常数测定
用50 mmol/L MES缓冲液(pH 4.5)配制不同质量浓度的底物(可溶性淀粉、普鲁兰多糖、γ-环糊精、玉米淀粉或糖原),分别向不同质量浓度底物中加入6 U酶液,按照1.3.3节中反应体系测定酶活力。根据双倒数作图法以底物质量浓度的倒数为横坐标,以比活力的倒数为纵坐标作图,直线的斜率为Km/Vmax,截距为1/Vmax,计算米氏常数Km、最大反应速度Vmax和反应常数kcat。可溶性淀粉质量浓度梯度设定为5.0、10.0、15.0、20.0、30.0、35.0 mg/mL;普鲁兰多糖质量浓度梯度设定为1.6、3.2、6.4、12.8、16.0、20.0 mg/mL;γ-环糊精质量浓度梯度设定为0.5、1.0、2.0、4.0、8.0、10.0 mg/mL;玉米淀粉质量浓度梯度设定为5.0、10.0、15.0、20.0、30.0、35.0 mg/mL;糖原质量浓度梯度设定为5.0、10.0、15.0、20.0、30.0、35.0 mg/mL。
1.3.7 底物特异性测定
用50 mmol/L MES缓冲液(pH 4.5)将样品稀释至适当浓度,分别以1 mg/mL普鲁兰多糖、γ-环糊精、可溶性淀粉、玉米淀粉、糖原为底物,于100 ℃反应30 min后,迅速放入冰水浴中终止反应,然后采用DNS法测定反应体系中还原糖量,计算重组酶作用于不同底物时的比活力。将所测得的最高比活力定义为100%,计算重组酶作用于不同底物时的相对酶活力。
1.4 数据处理
酶学性质研究实验中,每个实验做3 个平行。运用软件SigmaPlot 12.5对实验数据进行统计分析并作图,数据均以表示。
2 结果与分析
2.1 N末端结构模块相关缺失突变体的构建、表达与纯化
TK-PUL的分子结构显示其由结构模块N1-结构模块N2-结构模块N-催化结构域GH13_20顺序连接组成(图1A)[15]。利用NCBI网站的保守结构域数据库[20](conserved domain database,CDD)对TK-PUL中结构模块N1和结构模块N2进行分析,结果显示结构模块N1属于未知功能结构域,结构模块N2属于CBM48家族[21-24]。已有研究表明,糖苷水解酶中的非催化结构域对其底物特异性、底物结合能力、底物降解能力以及结构稳定性等起到重要作用,并对糖苷水解酶的催化特性显示不同程度的影响[25]。本研究为了确定TK-PUL中未知功能结构模块N1和N2对其酶学性质的影响,对TK-PUL的N末端进行截短突变,构建了缺失结构模块N1的突变体M1、缺失结构模块N2的突变体M2以及同时缺失结构模块N1和N2的突变体M3,各突变体的结构模式图如图1A所示。
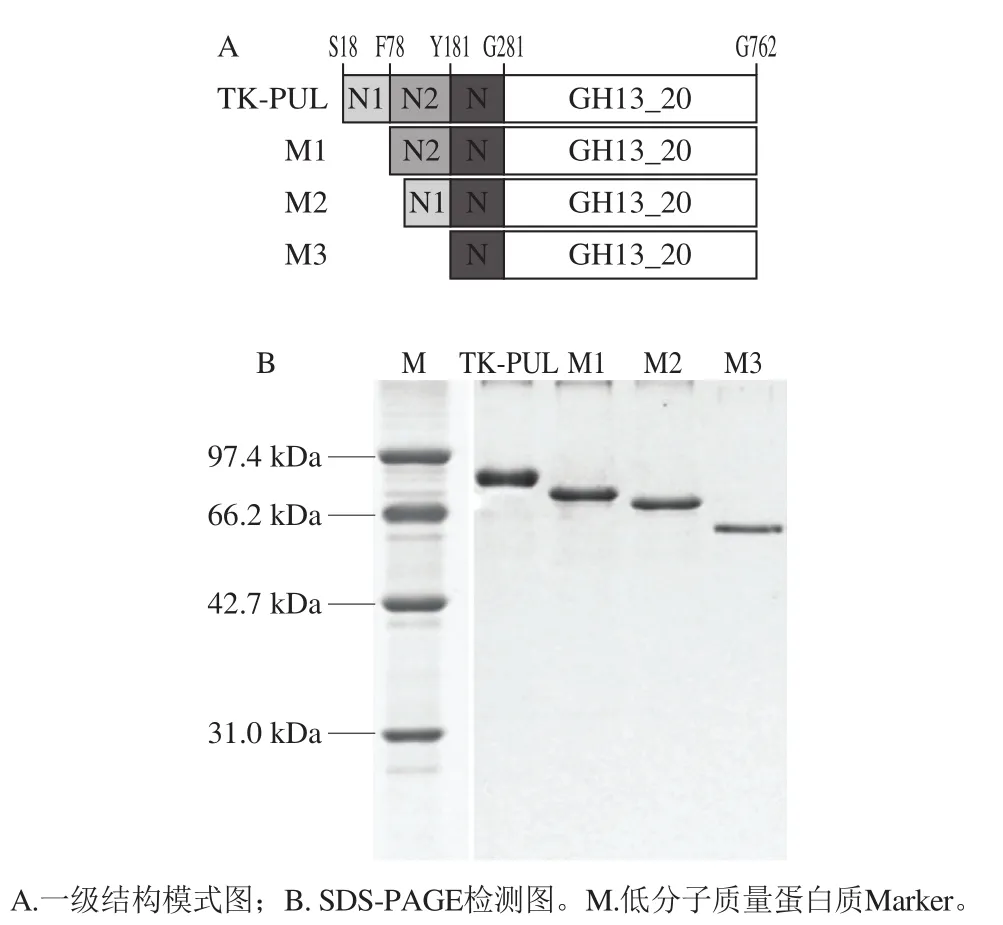
图1 重组蛋白质结构模式图及SDS-PAGE检测图Fig.1 Schematic representation and SDS-PAGE analysis of recombinant proteins
将各突变体于枯草芽孢杆菌表达系统中进行表达,目的蛋白质TK-PUL、M1、M2以及M3均得到成功表达,且主要位于发酵上清液中。采用Ni2+亲和层析法对发酵上清液中的目的蛋白质进行纯化,得到纯化后的重组蛋白质TK-PUL、M1、M2以及M3。如图1B所示,TK-PUL、M1、M2以及M3的表观分子质量分别约为84、78、72、65 kDa,大小均与理论值相符。
2.2 N末端结构模块相关缺失突变体的最适反应pH值及pH值稳定性
为了研究N末端结构模块对TK-PUL最适反应pH值及pH值稳定性的影响,本研究比较了TK-PUL及其N末端结构模块缺失突变体的最适反应pH值及pH值稳定性,结果如图2、3所示。由图2可知,以可溶性淀粉或普鲁兰多糖为底物时,TK-PUL及其N末端结构模块缺失突变体的最适反应pH值均约为4.5,并且各重组酶的最适反应pH值曲线的变化趋势基本相同。这表明N末端结构模块的缺失不影响TK-PUL的最适反应pH值。

图2 重组酶的最适反应pH值Fig.2 Optimal pH of recombinant enzymes
重组酶的pH值稳定性测定结果显示(图3),不同重组酶的pH值稳定性有明显差异。以可溶性淀粉或普鲁兰多糖为底物时,TK-PUL和各突变体均于pH 5.5具有最高的稳定性,TK-PUL和突变体M1具有相近的pH值稳定性,突变体M2和M3具有相近的pH值稳定性。其中,以可溶性淀粉为底物时,在pH 3.0~5.5的范围内,突变体M1的pH值稳定性略低于TK-PUL的pH值稳定性;在pH 5.5~9.0的范围内,两者的pH值稳定性基本一致。以普鲁兰多糖为底物时,在pH 3.0~9.0的范围内,突变体M1的pH值稳定性略低于TK-PUL的pH值稳定性。在pH 3.0~9.0的范围内,突变体M2和M3的pH值稳定性明显低于TK-PUL和突变体M1的pH值稳定性。以上研究结果表明,结构模块N1对TK-PUL的pH值稳定性的影响较小,结构模块N2对TK-PUL维持pH值稳定性非常重要。
综合以上研究结果,TK-PUL中结构模块N1的缺失不影响TK-PUL的最适反应pH值,并且对其pH稳定性的影响较小;结构模块N2的缺失不影响TK-PUL的最适反应pH值,但是导致TK-PUL的pH值稳定性降低,即结构模块N2对于TK-PUL维持pH值稳定性非常重要。据研究报道,来源于普鲁兰芽孢杆菌B. acidopullulyticus的普鲁兰酶BaPul的N末端未知功能结构域X25和结构域CBM41不影响其最适反应pH值,但是结构域X25和结构域CBM41影响BaPul的pH值稳定性[26]。其中结构域X25对其维持pH值稳定性发挥正向促进作用,而结构域CBM41不利于其维持pH值稳定性。这表明,不同糖苷水解酶中类似的结构模块发挥不同作用,对酶学特性产生不同影响。

图3 重组酶的pH值稳定性Fig.3 pH stability of recombinant enzymes
2.3 N末端结构模块相关缺失突变体的最适反应温度及热稳定性
如图4所示,TK-PUL及各突变体具有相同的最适反应温度(100 ℃),但是重组酶具有不同的相对酶活力。在40~110 ℃的范围内,特别是70~110 ℃的范围内,各重组酶从大到小的相对酶活力大小依次排序为:M3、M2、M1、TK-PUL。该结果表明,TK-PUL及各突变体具有相同的最适反应温度,但是N末端结构模块相关缺失突变体的热稳定性明显高于TK-PUL。同时,重组酶的热稳定性测定结果(图5)显示,N末端结构模块相关缺失突变体于100 ℃的半衰期均长于TK-PUL的半衰期。其中,100 ℃各重组酶从大到小的热稳定性大小依次排序为:M3、M2、M1、TK-PUL。TK-PUL、M1、M2、M3于100 ℃的半衰期分别约为2.00、2.30、2.50、2.55 h。与TK-PUL相比,结构模块N1缺失的突变体M1于100 ℃的半衰期延长至TK-PUL的1.15 倍,结构模块N2缺失的突变体M2于100 ℃的半衰期延长至TK-PUL的1.25 倍,结构模块N1和N2均缺失的突变体M3于100 ℃的半衰期延长至TK-PUL的1.27 倍。
已有研究表明,蛋白质分子中柔性结构区域通常与蛋白质的热稳定性呈负相关,柔性结构区域的缺失可能提高蛋白质的热稳定性[27]。TK-PUL的N末端结构模块N1和N2不能在其晶体结构中呈现,结构模块N1和N2属于柔性结构区域[15]。本研究中TK-PUL的结构模块N1和N2与其热稳定性呈负相关,结构模块N1和N2的缺失有利于TKPUL提高热稳定性。类似的现象也见于缺失位于N末端的柔性结构域CBM41的普鲁兰酶BaPul突变体[27]和缺失位于N末端的结构域N1的淀粉普鲁兰酶gt-apu突变体[28]。
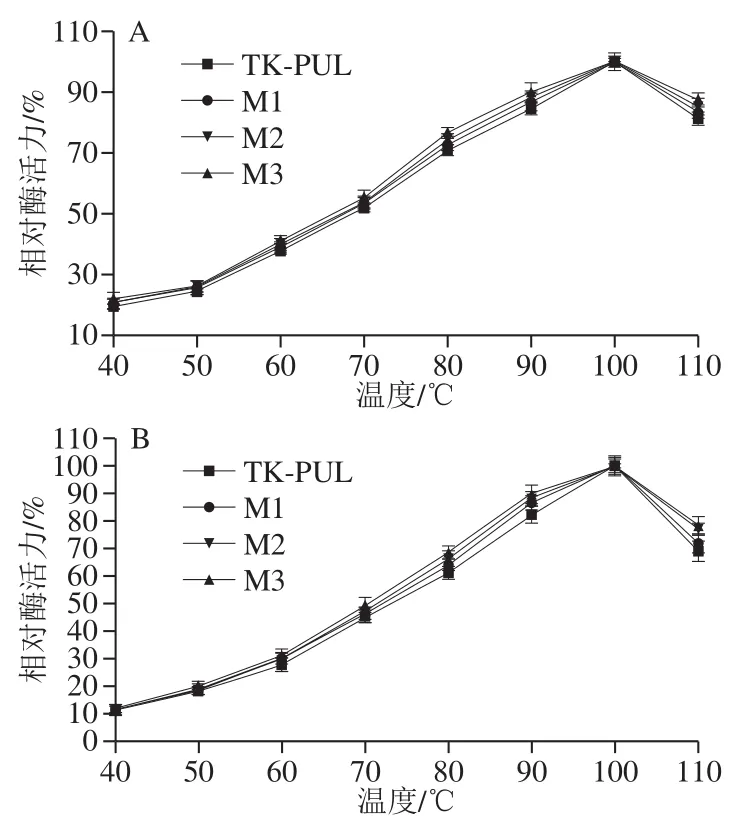
图4 重组酶的最适反应温度Fig.4 Optimal temperature of recombinant enzymes

图5 重组酶于100 ℃的热稳定性Fig.5 Thermal stability of recombinant enzymes at 100 ℃
2.4 N末端结构模块相关缺失突变体的比活力和动力学常数
本研究测定并比较了TK-PUL及其N末端结构模块相关缺失突变体于100 ℃以可溶性淀粉或普鲁兰多糖为底物时的比活力和动力学常数,依此确定N末端结构模块N1和N2对TK-PUL的底物结合能力和底物降解能力的影响。由表2可知,与TK-PUL相比,突变体M1的α-淀粉酶比活力和普鲁兰酶比活力的比值基本不变,但是其α-淀粉酶比活力和普鲁兰酶比活力均得到提高,其中α-淀粉酶比活力提高至TK-PUL的1.11倍,普鲁兰酶比活力提高至TK-PUL的1.12 倍。另外,表3显示,与TK-PUL相比,突变体M1以可溶性淀粉或普鲁兰多糖为底物的Km值基本不变,kcat值明显提高。这些结果表明,结构模块N1的缺失不影响TK-PUL的底物结合能力,并且有利于提高其底物降解能力。
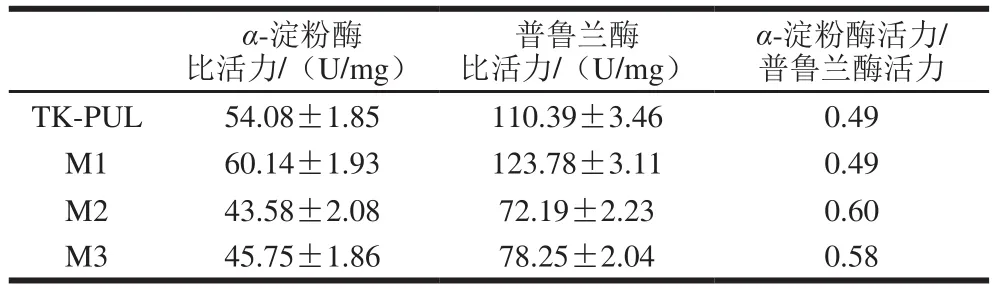
表2 TK-PUL及其突变体于100 ℃的比活力Table 2 Specific activities of TK-PUL and its mutants at 100 ℃
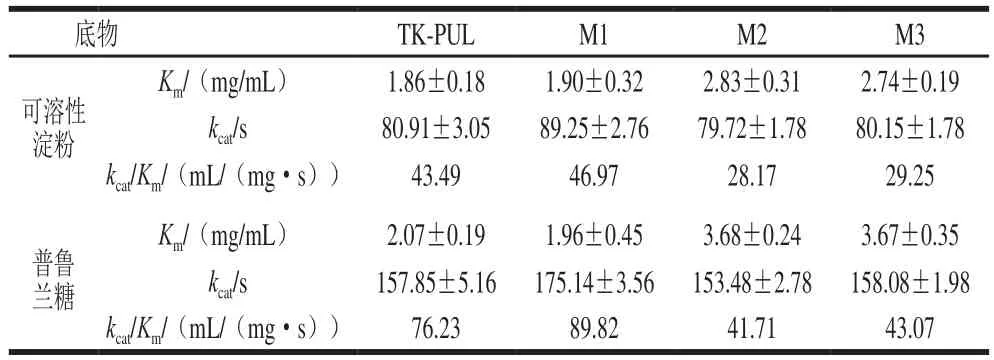
表3 TK-PUL及其突变体的动力学常数(1)Table 3 Kinetic parameters for specific activities of TK-PUL and its mutants (1)
由表2可知,与TK-PUL相比,突变体M2和M3的α-淀粉酶比活力和普鲁兰酶比活力均下降,但是这2 个突变体的α-淀粉酶比活力与普鲁兰酶比活力的比值均有提高。其中突变体M2的α-淀粉酶比活力为TK-PUL的80.58%,普鲁兰酶比活力为TK-PUL的65.40%,α-淀粉酶比活力与普鲁兰酶比活力的比值为TK-PUL的1.22 倍;突变体M3的α-淀粉酶比活力为TK-PUL的84.60%,普鲁兰酶比活力为TK-PUL的70.89%,α-淀粉酶比活力与普鲁兰酶比活力的比值为TK-PUL的1.18 倍。突变体M3的比活力略高于突变体M2的比活力。由表3可知,突变体M2和M3以可溶性淀粉或普鲁兰多糖为底物时的kcat值几乎不变,Km值明显提高。相对于TK-PUL,突变体M2以可溶性淀粉为底物时的Km值提高至TK-PUL的1.52 倍,以普鲁兰多糖为底物时的Km值提高至TK-PUL的1.78 倍;突变体M3以可溶性淀粉为底物时的Km值提高至TK-PUL的1.47 倍,以普鲁兰多糖为底物时的Km值提高至TK-PUL的1.77 倍。即结构模块N2的缺失不影响TK-PUL的底物降解能力,但是导致其底物结合能力下降,进而导致其比活力降低。
结合突变体M2和M3的α-淀粉酶比活力和普鲁兰酶比活力的比值的变化情况(即α-淀粉酶比活力的下降比率低于普鲁兰酶比活力的下降比率),以及突变体对可溶性淀粉和普鲁兰多糖的结合能力的变化情况(即对可溶性淀粉的结合能力的下降比率低于对普鲁兰多糖的结合能力的下降比率),可以得出以下结论:结构模块N2通过影响了TK-PUL对不同底物的亲和力(即TK-PUL的底物选择性),影响其α-淀粉酶活性和普鲁兰酶活性。结构模块N2对TK-PUL底物选择性的影响,类似于来源于Anoxybacillussp. WB42的淀粉普鲁兰酶Pul WB42中N末端结构域N1[29]以及来源于碱湖生菌属Alkalilimnicolasp. NM-DCM-1的淀粉普鲁兰酶PulD7中N末端结构域CBM48[30]对酶底物选择性的影响。缺失结构域N1后,Pul WB42的α-淀粉酶活性与普鲁兰酶活性的比值由83%降至18%[29];缺失结构域CBM48的PulD7只有α-淀粉酶活性而丧失普鲁兰酶活性[30]。
以上研究结果表明,虽然TK-PUL的N末端结构模块N1和N2不是其发挥催化活性所必需的结构模块,但是这2 个结构模块影响其底物降解能力和底物结合能力。缺失结构模块N1的突变体的底物结合能力不变,底物降解能力提高;缺失结构模块N2的突变体的底物降解能力不变,底物结合能力降低。
2.5 N末端结构模块相关缺失突变体的底物特异性
TK-PUL及其N末端结构模块相关缺失突变体的底物特异性测定结果显示(表4),所有重组酶的最适反应底物均是普鲁兰多糖。TK-PUL与突变体M1的底物特异性基本一致,即缺失结构模块N1不影响TK-PUL的底物特异性。与TK-PUL相比,突变体M2和M3对小分子γ-环糊精的相对酶活力略有下降,对可溶性淀粉的相对酶活力略有提高,对其他大分子底物如玉米淀粉和糖原的相对酶活力明显下降。这表明,结构模块N2影响TK-PUL的底物特异性。
为了明确结构模块N2影响TK-PUL底物特异性的分子机制,本研究测定了TK-PUL分别以γ-环糊精、玉米淀粉、糖原为底物时的动力学常数,结果如表5所示。与TK-PUL相比,突变体M2和M3以γ-环糊精为底物时的kcat值几乎不变,Km值略有提高;以玉米淀粉或糖原为底物时的kcat值几乎不变,Km值明显提高。此外,表3显示,与TK-PUL相比,突变体M2和M3以可溶性淀粉或普鲁兰多糖为底物时的kcat值几乎不变,Km值明显提高。其中,突变体M2和M3对可溶性淀粉的Km值的提高倍数小于突变体M2和M3对普鲁兰多糖的Km值的提高倍数,使得突变体M2和M3对可溶性淀粉的相对酶活力略有提高;突变体M2和M3对γ-环糊精、玉米淀粉或糖原的Km值的提高倍数大于突变体M2和M3对普鲁兰多糖的Km值的提高倍数,使得突变体M2和M3对这些底物的相对酶活力降低。以上结果表明,结构模块N2通过影响酶分子对底物的结合能力,改变酶分子的底物特异性。
综上,结构模块N2属于CBM48家族。CBM家族的基本功能是结合底物、促进催化结构域与底物密切接触,从而促进底物水解[23]。例如普鲁兰酶BaPul中N末端结构域CBM41参与酶与底物的结合,影响酶对底物的降解,从而影响其底物特异性[31]。本研究中结构模块N2对TKPUL底物特异性的影响与此类似。

表4 TK-PUL及其突变体的底物特异性Table 4 Substrate specificities of TK-PUL and its mutants
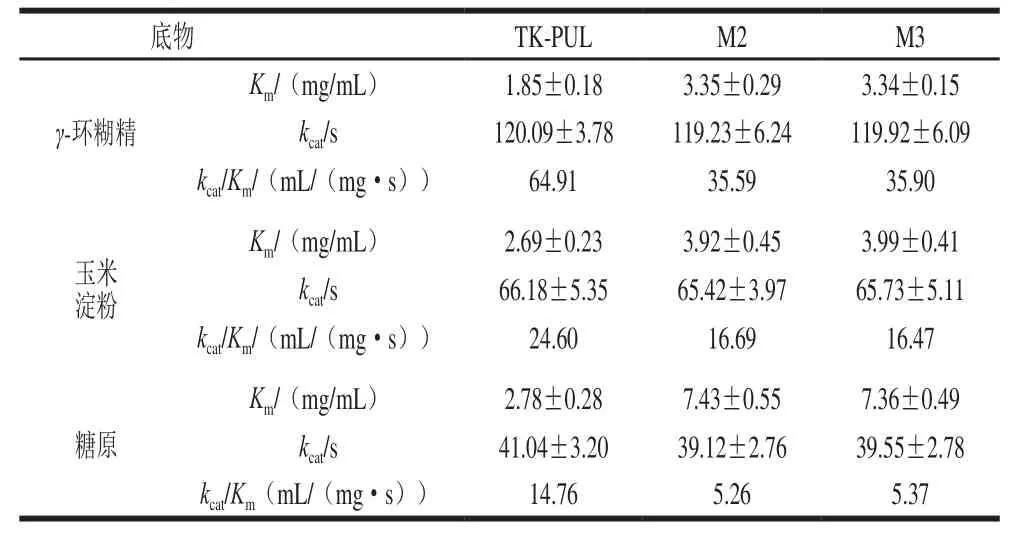
表5 TK-PUL及其突变体的动力学常数(2)Table 5 Kinetic parameters for substrate specificities of TK-PUL and its mutants (2)
3 结 论
本研究对III型普鲁兰多糖水解酶TK-PUL进行N末端截短突变,通过比较TK-PUL与突变体的酶学性质,确定N末端结构模块的功能。未知功能结构模块N1的缺失不影响TK-PUL的最适反应pH值、最适反应温度、酶的底物结合能力以及酶的底物特异性。并且结构模块N1的缺失提高了酶的比活力和热稳定性。结构模块N1的缺失改良了TK-PUL的催化特性,结构模块N1缺失突变体M1更适用于淀粉酶法制糖工业。结构域N2的缺失提高了酶的热稳定性,但是降低了酶的pH值稳定性、酶的底物结合能力以及比活力。并且结构域N2通过影响酶对不同底物的结合能力,影响其底物选择性,导致其α-淀粉酶活性与普鲁兰酶活性的比值发生变化。另外,TK-PUL中结构模块N1和N2均不是其发挥催化活性所必需的结构区域。本研究揭示了TK-PUL的N末端结构模块与其催化特性之间的相关性,拓展了对III型普鲁兰多糖水解酶的构效关系的了解,为其他淀粉水解酶的构效关系和分子改造研究提供了科学依据。
