基于血管内皮功能探讨缺血性脑卒中合并高脂血症对大鼠勃起功能的影响
2021-06-03王继升李海松代恒恒鲍丙豪冯隽龙
王继升,李海松,代恒恒,邓 省,鲍丙豪,冯隽龙,王 彬
(1.北京中医药大学第一临床医学院,北京100029;2.北京中医药大学东直门医院男科,北京100700)
缺血性脑卒中(ischemic stroke,IS)是由于脑的供血动脉狭窄或闭塞、脑供血不足导致的脑组织坏死的总称,传统医学称之为中风[1]。勃起功能障碍(erectile dysfunction,ED)是指男性性欲正常,受到有效刺激,而阴茎不能勃起或硬度不足以插入阴道,或勃起不能持续足够时间,来维持正常性交的病症,且超过3个月[2]。流调发现,在男性IS患者性功能障碍中,约有48%~75%出现ED[3],且卒中后性欲减退的发生率约为17%~42%[4]。有文献报道,勃起功能障碍可以作为脑卒中前期的危险信号[5]。ED作为一种受广泛研究和关注的男科疾病,病因复杂,除了受多种因素影响,还与其他多系统疾病密切关联,如高脂血症(hyperlipoidemia,HLP)等代谢性疾病皆是ED发生的重要风险因素[6,7]。美国一项调查显示高脂血症患者在所有ED患者中的比例约为41.8%,我国调查的比例更高,约为47%[8]。因此,IS合并HLP与ED可能在某些方面存在着一定的关联性。本文通过实验对其关联性进行研究并探讨其相互作用机制。
1 材料与方法
1.1 伦理批准
实验方案经北京中医药大学东直门医院实验动物伦理委员会批准。
1.2 实验动物
7周龄SPF成年雄性SD大鼠30只,体重(200±20)g,购于北京维通利华公司。大鼠在22~24℃恒温条件的清洁环境下饲养。实验前,所有大鼠适应性喂养1周。
1.3 HLP模型建立及分组
将大鼠分成正常组(C组,n=10)和HLP组(n=20)两组。正常组以正常饮食喂养,HLP组以高脂肪饮食喂养(2%胆固醇,12%蛋黄粉,8%猪油,0.5%胆酸钠,77.5%基本饮食)。喂养10周后,从尾静脉采血并测试血脂。将HLP组大鼠随机分为假手术组(S组,n=10)和模型组(M组,n=10)。模型组将HLP组中造模成功的大鼠用手术方式诱导其血栓形成。假手术组10只大鼠在仅仅暴露手术切口处理的情况下进行相同的操作。
1.4 行为学观察
完成脑缺血模型的术后24 h做神经功能评分,每组随机选取6只大鼠以观察大鼠的神经行为学,采用改良后的Bederson评分法[9],总得分最低为0分,表示完全正常,无神经功能缺陷(正常);1分,抬起尾巴时无法伸展对侧前爪(轻微);2分,向健侧转圈(中度);3分,不能向健侧运动(重度);4分,不能自主运动,意识水平低下(极重度)。得分≥1,即具有神经系统缺陷症状。除正常组外,每组均在造模成功后24 h时进行神经损害程度评分,神经功能缺损评分2~3分者入选。
1.5 ELISA检测
每组选取6只大鼠检测血清中cGMP、T、D-D的表达,根据说明,使用ELISA试剂盒,用STATFAX 2100微孔板分光光度计在570 nm处检测吸光度。
1.6 HE染色
从每只大鼠取出阴茎组织,每只选取阴茎部位相同,冷盐水洗涤,并用4%多聚甲醛固定24 h。脱水后,石蜡包埋,4~5μm切片,苏木精和伊红(HE)染色。在显微镜下观察HE染色的载玻片。
1.7 Western blot检测
为检测VEGF蛋白的表达,大鼠取海绵体组织的一部分,在冰冷的组织裂解缓冲液中匀浆。将混合物离心10 min,之后收集上清液。用RIPA调节蛋白质浓度并煮沸5 min。每个样品用10%SDS聚丙烯酰胺凝胶分离,转移到PVDF膜上。以β-actin作为内参蛋白进行免疫印迹,样品在4℃条件下过夜。使用ECL检测系统检测免疫反应信号,并进行读取分析。
1.8 Real-time PCR检测
通过对大鼠阴茎海绵体细胞总RNA的提取,并检测其完整性,随后经分光光度计校验所提取RNA的纯度以用于后续检测。RNA逆转录后以25μL反应体系进行体外PCR扩增,以β-actin为内参照。95℃预变性5 min后进行下列循环:94℃变性1 min;不同温度下退火40 s,72℃延伸1 min,循环30次;最后72℃充分延伸l0 min。反应在荧光定量PCR仪中进行,所有样本均设3个平行孔重复,并记录循环数(Ct值),通过相对定量(RQ)法比较基因的表达差异。
1.9 统计学处理
使用GraphPad Prism 6.0进行统计分析。计量资料以均值±标准差表示,组间数据比较采用单因素方差分析检验(ANOVA)。P<0.05为差异具有统计学意义。
2 结果
2.1 缺血性脑卒中模型检验
M组大鼠在术后24 h后状态较差,四肢蜷缩,摄食量减少、体重有所下降等;同时出现不同程度的右侧前肢屈曲,甚至出现原地转圈现象,而C组和S组表现正常,说明脑缺血模型造模成功。
2.2 血清T、D-D水平
通过ELISA方法检测大鼠血清T、D-D表达,结果显示:与C组比较,S组血清T和D-D的表达无差异(P>0.05),M组血清T的表达下调(P<0.05)、D-D表达上调(P<0.01),见表1。
表1 各组血清T、D-D的表达(n=6,±s)Tab 1 ELISA method to detect the expression of T and D-D in serum(n=6,±s)

表1 各组血清T、D-D的表达(n=6,±s)Tab 1 ELISA method to detect the expression of T and D-D in serum(n=6,±s)
注:与C组比较,*P<0.05,**P<0.01。
D-D(μg/L)55.70±9.72 62.70±13.88 84.39±16.46**7.217 0.006组别C组S组M组FP T(ng/m L)0.76±0.37 0.62±0.39 0.25±0.04*4.162 0.036
2.3 阴茎组织中的cGMP水平
通过ELISA方法检测阴茎海绵体组织中cGMP表达含量,结果显示:与C组比较,S组大鼠的阴茎组织中cGMP的表达未见统计学差异(P>0.05)。M组大鼠阴茎组织中的cGMP含量的表达明显下调,差异具有统计学意义(P<0.05),见表2。
2.4 阴茎海绵体组织HE染色
HE染色结果显示,C组与S组大鼠海绵状小梁分布均匀,血窦丰富,间质组织未见增生。与正常组比较,M组大鼠的海绵状小梁排列顺序杂乱无章,血窦明含量显少于正常组大鼠。此外,模型组大鼠阴茎海绵体内皮细胞和平滑肌细胞密度呈现明显降低趋势,见图1。
表2 各组阴茎组织中c GMP的表达(n=6,±s)Tab 2 ELISA method to detect the expression of c GMP in penile tissue(n=6,±s)

表2 各组阴茎组织中c GMP的表达(n=6,±s)Tab 2 ELISA method to detect the expression of c GMP in penile tissue(n=6,±s)
注:与C组比较,*P<0.05。
cGMP(ng/gL)0.92±0.2 0.76±0.17 0.56±0.25*4.317 0.033组别C组S组M组FP
2.5 Western blot结果
Western blot检测结果显示:与C组比较,S组中VEGF蛋白表达具有显著差异,其表达水平明显升高(P<0.05)。与S组比较,M组VEGF蛋白表达水平明显升高,差异具有统计学意义(P<0.01)。见表3和图2。
表3 各组阴茎海绵体中VEGF蛋白的表达(n=6,±s)Tab 3 Expression of VEGF protein in the corpus cavernosum of the penis(n=6,±s)

表3 各组阴茎海绵体中VEGF蛋白的表达(n=6,±s)Tab 3 Expression of VEGF protein in the corpus cavernosum of the penis(n=6,±s)
注:与C组比较,*P<0.05;与S组比较,##P<0.01。
VEGF 0.98±0.17 1.24±0.21*1.67±0.15##22.021<0.001组别C组S组M组F P
2.6 Real-time PCR结果
Real-time PCR检测结果显示:与C组比较,S组中VEGF mRNA表达升高(P<0.05)。与S组比较,M组中VEGF mRNA表达升高(P<0.01),见表4。
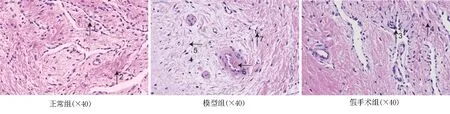
图1 HE染色结果Fig 1 HE staining results

图2 WB检测VEGF蛋白的表达Fig 2 WB detects the expression of VEGF protein
表4 各组阴茎海绵体中VEGF m RNA的表达(n=6,±s)Tab 4 Expression of VEGF m RNA in the cavernous body of the penis(n=6,±s)

表4 各组阴茎海绵体中VEGF m RNA的表达(n=6,±s)Tab 4 Expression of VEGF m RNA in the cavernous body of the penis(n=6,±s)
注:与正常组比较,*P<0.05;与假手术组比较,##P<0.01。
VEGF 1 1.62±0.17*3.43±0.63##67.022<0.001组别C组S组M组F P
3 讨论
本研究表明,HLP可致使阴茎海绵体组织结构改变,即平滑肌细胞成分减少,胶原增加和细胞器损伤等,这些变化可能是引起ED的重要原因之一[10,11]。HLP可以导致ED,其机制可能与VEGF、硫化氢合酶的活性的显著降低有关[12]。高脂血症可引起脂肪堆积,使T转化成E2的关键酶P450表达明显增强;高E2负反馈抑制HPT轴功能,T分泌降低,这又促进脂肪 生 成 增 多[13,14]。
IS合并HLP可以共同诱导勃起功能下降。本研究发现这种联合作用是通过抑制VEGF、cGMP和T等表达,以及增强了D-D的表达,从而造成勃起功能下降。VEGF可通过促进细胞表达进而改善内皮功能、增加平滑肌的数量从而改善ED大鼠的勃起功能[15],VEGF又可通过促使脑微血管内皮细胞中的细胞增殖和血管新生从而改善脑卒中相关并发症[16]。环磷酸鸟苷的作用机制目前较明确,环磷酸鸟苷为细胞内第二信使分子,是勃起功能产生的重要物质之一,其作用机制为直接作用于阴茎海绵体靶点,通过调节钙离子内外浓度,调控钙离子内流外流平衡机制,从而起到调节阴茎勃起的机制[17]。同时cGMP参与中枢神经生理效应产生过程,可抑制血小板聚集,避免血栓形成[18],这种协同作用导致ED的发生。
D二聚体作为临床常用指标,代谢机制为血浆纤维蛋白原交联后经纤溶酶水解产生的特异性降解产物。在临床中D二聚体常作为凝血和纤溶系统的异常的指标之一,具有特异性。研究表明若其水平持续升高,则相对体现血栓危险性增加。此外,D二聚体作为特异性分子标志物,其表达异常会增加ED和IS的发病风险[19]。
动脉斑块形成后,往往最先阻碍较细的动脉血流,当海绵体动脉发生粥样硬化阻碍血液灌注造成ED时,由于脑动脉相比阴茎海绵体动脉较大,很可能处在代偿期。即使脑动脉尚未出现相应的临床症状及表现,但仍有一定潜在风险,即临床中常见的心脑血管疾病的隐匿期[20,21]。临床发现,以ED为主诉的中老年患者往往同时存在诱发脑血管疾病的高危因素,如三高、吸烟、低通气睡眠呼吸暂停综合征等。在追溯许多脑血管疾病患者的既往病史时发现,许多患者在这类疾病发生前的一段时间内已经出现了ED表现;并在疾病发生后伴有ED加重的趋势[22]。许多伴有ED的脑卒中患者,在相关专科进行一段时间的治疗后,勃起功能会随之改善。本研究为初步探索两者之间相关性,研究尚未深入,后续研究将深入探索这种相关性背后的具体机制,从而拓展勃起功能障碍的诊疗的思路。
本研究仍存在诸多局限性,在今后的研究中,可以扩大样本量进一步验证缺血性脑卒中合并高脂血症与勃起功能之间的关系,分析IS合并HLP与ED之间的相关通路联系,并结合通路抑制剂和激活剂等进行验证。
