抑制miR-155的表达对COPD患者气道平滑肌细胞增殖和迁移的影响
2021-06-03赵四林范伏元金朝晖肖雪飞张慧卿
王 伟,赵四林,范伏元,金朝晖,李 妲,符 艳,孙 爽,肖雪飞,张慧卿,胡 立
(1.湖南中医药大学第一附属医院呼吸内科,2.湖南省人民医院呼吸内科,湖南 长沙410007)
慢性阻塞性肺病(chronic obstructive pulmonary disease,COPD),简称慢阻肺,属于气道慢性炎症性疾病,近年来,其发病率不断增加,严重危害人类身体健康[1,2]。COPD发病机制尚未完全明确,但研究表明COPD与炎症细胞浸润、气道平滑肌增生肥厚有关[3,4]。气道平滑肌细胞(airway smooth muscle cells,ASMCs)的增生肥大会 影 响COPD[5,6]。因 此 抑 制ASMCs增 殖 和 迁移是阻滞COPD进展的重要机制之一。研究表明miRNA与呼吸系统疾病的发生、发展相关,miRNA通过各种机制在COPD的发生发展中发挥着重要作用,可作为其诊断、治疗、预后等生物标记物[7-9]。研究报道miR-155在COPD患者外周血中表达水平升高,miR-155可能参与了COPD的发病过程,是导致肺损伤的重要物质[10]。哮喘气道平滑肌细胞中miR-155表达升高[11]。但miR-155对COPD患者气道平滑肌细胞增殖和迁移的影响尚未清楚。本实验旨在研究miR-155对COPD患者气道平滑肌细胞增殖和迁移的影响。
1 材料与方法
1.1 一般资料
选取2017年5月~2019年5月于本院进行肺部手术的8例COPD患者为观察组,选择3例无COPD病史的肺部良性肿瘤患者的正常肺组织作为对照组。所有患者知情并同意。
1.2 主要试剂
胎牛血清、DMEM培养基(美国Gibco);胰蛋 白 酶(美 国Sigma);Trizol、反 转 录 试 剂 盒、SYBR Premix ExTaqTM试剂盒(日本TaKaRa);细胞周期检测试剂盒(美国Sciencell);RIPA裂解液(北京百奥莱博科技有限公司);Ki67、E-cadherin、N-cadherin抗体(北京博奥森生物技术有限公司);GAPDH抗体及山羊抗兔IgG-HRP(北京索莱宝公司);Transwell小室、Matrigel胶(美国Bio-Rad公司);TNF-α、IL-6酶联免疫吸附试剂盒(上海恒斐生物科技有限公司)。
1.3 气道平滑肌细胞(ASMCs)分离培养
参考文献[4],取两组患者的肺叶和支气管平滑肌,纵向剖开气管,去除气管的内膜和外膜,然后将平滑肌剪成1 mm3的小组织块,将其置于培养瓶中,加入含血清的DMEM培养基,培养4~5 d后可见从组织块边缘爬出少量细胞,随后开始贴壁生长,待细胞长满瓶底80%左右时,倒置显微镜下观察细胞,细胞呈长梭形,成峰谷生长状。用0.25%的胰蛋白酶消化传代,取稳定传代4~6代的细胞用于实验。
1.4 细胞转染与分组
取COPD患者ASMCs,将miR-155抑制表达质粒anti-miR-155-A、anti-miR-155-B和阴性对照质粒anti-miR-NC分别转染至ASMCs中,记为anti-miR-155-A组、anti-miR-155-B组、anti-miR-NC组;正常培养的ASMCs作为空白组(blank control)。
1.5 实时荧光定量PCR(RT-qPCR)检测miR-155表达水平
收集两组ASMCs,提取总RNA后反转录成cDNA,而后进行PCR扩增,miR-155以U 6为内参,相 对 表 达 量 采 用2-△△Ct法 计 算;具 体 参 考文献[4]。
转染后的各组细胞采用上述方法检测转染效率。
1.6 流式细胞仪检测细胞周期
各组细胞培养48 h后收集细胞,并制备单细胞悬液,加入3 mL预冷的70%乙醇固定,用缓冲液洗涤后加入核糖核酸酶A(RNase A)于37℃水浴30 min,加入碘化啶(PI),4℃避光30 min,上机检测,重复3次。用流式细胞仪和DNA细胞周期分析软件对细胞周期进行检测分析。
1.7 克隆形成实验检测细胞克隆形成数
将适量细胞接种于6孔板中,培养2周后用PBS清洗,经过甲醇固定和吉姆萨染色,最后用低倍光学显微镜下计数>50个细胞的集落。
1.8 Western blot实验
提取细胞总蛋白后进行定量。然后经电泳,转膜,封闭后分别加入一抗和二抗进行孵育,再曝光显影,定影,测定蛋白条带灰度值,以GAPDH为内参计算蛋白表达水平;具体步骤参考文献[4]。
1.9 Transwell实验
细胞消化重悬后,接种于Transwell小室上层,培养24 h,经固定、染色后进行计数。细胞侵袭实验在Transwell小室上层加入基质胶Matrigel,之后同细胞迁移操作;具体步骤参考文献[4]。
1.10 酶联免疫吸附(ELISA)实验
各组细胞培养48 h后取上清,具体步骤严格按照试剂盒说明进行操作,检测TNF-α、IL-6的水平。
1.11 统计学处理
采用SPSS 20.0软件进行统计学分析,计量资料用均数±标准差(±s)表示,两组比较行t检验,多组间比较采用单因素方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 miR-155在COPD患者气道平滑肌细胞中的表达
对照组及COPD组气道平滑肌细胞中miR-155表达水平分别为0.97±0.05、3.26±0.15,COPD组较对照组明显升高,差异具有统计学意义(P<0.05)。
2.2 抑制miR-155的效果检测
空白组、anti-miR-NC组、anti-miR-155-A组及anti-miR-155-B组miR-155表达水平分别为0.94±0.08、0.95±0.09、0.32±0.03、0.20±0.02,anti-miR-155-A组和anti-miR-155-B组较空白组和anti-miR-NC组明显降低,差异具有统计学意义(P<0.05)。取变化较为明显的anti-miR-155-B组用于后续实验,后续实验中均用anti-miR-155表示。
2.3 抑制miR-155对COPD患者气道平滑肌细胞增殖的影响
与空白组和anti-miR-NC组相比,anti-miR-155组G0-G1期细胞所占比例升高,S期细胞比例而降低,细胞克隆数降低,Ki67蛋白表达水平降低,差异具有统计学意义(P<0.05)。见图1及表1。
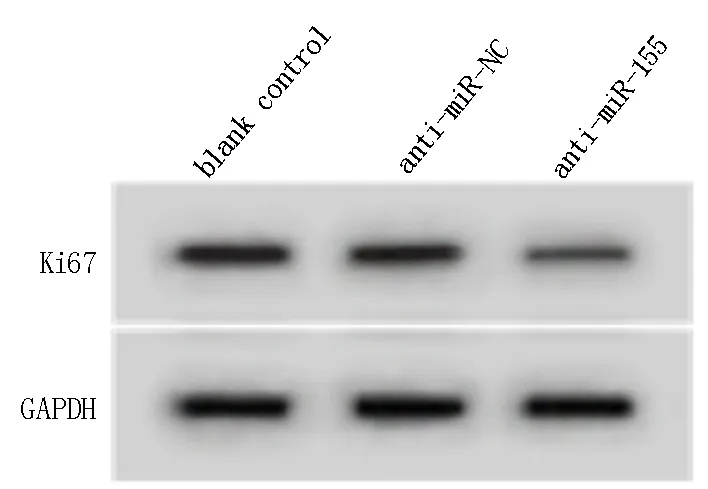
图1 抑制miR-155对COPD患者气道平滑肌细胞中Ki67蛋白表达的影响Fig 1 The effect of miR-155 inhibition on Ki67 protein expression in air way smooth muscle cells of COPD patients
2.4 抑制miR-155对COPD患者气道平滑肌细胞迁移、侵袭的影响
与空白组和anti-miR-NC组相比,anti-miR-155组迁移、侵袭气道平滑肌细胞数降低,气道平滑肌细胞中E-cadherin蛋白表达水平升高,N-cadherin蛋白表达水平降低,差异具有统计学意义(P<0.05)。见图2及表2。
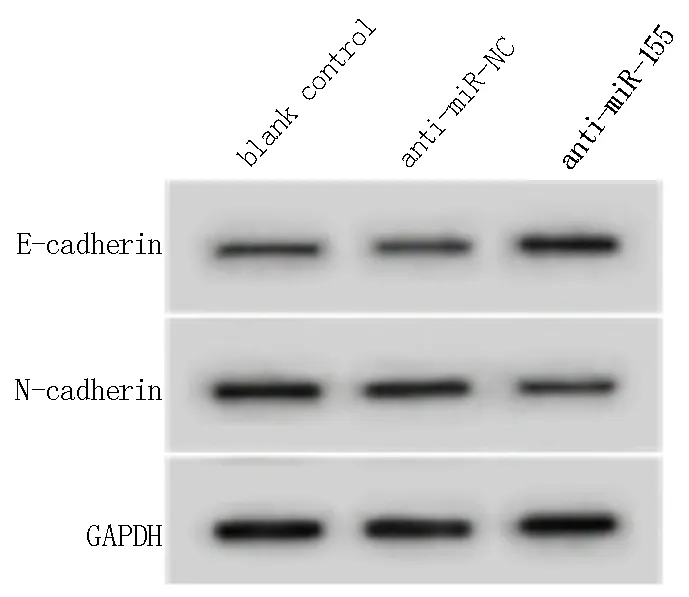
图2 抑制miR-155对COPD患者气道平滑肌细胞中E-cadherin、N-cadherin蛋白表达的影响Fig 2 The effect of miR-155 inhibition on the expression of E-cadherin and N-cadherin protein in airway smooth muscle cells of COPD patients
2.5 抑制miR-155对COPD患者气道平滑肌细胞中炎症因子的影响
与空白组和anti-miR-NC组相比,anti-miR-155组COPD患者气道平滑肌细胞中TNF-α和IL-6水平升高,差异具有统计学意义(P<0.05)。见表3。
表1 抑制miR-155对COPD患者气道平滑肌细胞增殖的影响(n=9,±s)Tab 1 The effect of miR-155 inhibition on airway smooth muscle cell proliferation in COPD patients(n=9,±s)

表1 抑制miR-155对COPD患者气道平滑肌细胞增殖的影响(n=9,±s)Tab 1 The effect of miR-155 inhibition on airway smooth muscle cell proliferation in COPD patients(n=9,±s)
注:与空白组比较,*P<0.05;与anti-miR-NC组比较,#P<0.05。
Ki67 0.64±0.06 0.62±0.05 0.26±0.02*#189.969 0.000组别空白组anti-miR-NC组anti-miR-155组S FP G0-G1 34.72±3.49 34.64±3.54 45.01±3.53*#25.837 0.000 34.64±3.80 34.74±3.00 24.43±2.74*#30.615 0.000 G2-M 30.64±3.29 30.62±3.35 30.56±2.99 0.002 0.998克隆数98.25±6.45 98.22±6.61 44.42±3.39*#269.298 0.000
表2 抑制miR-155对COPD患者气道平滑肌细胞迁移、侵袭的影响(n=9,±s)Tab 2 The effect of miR-155 inhibition on airway smooth muscle cell migration and invasion in COPD patients(n=9,±s)

表2 抑制miR-155对COPD患者气道平滑肌细胞迁移、侵袭的影响(n=9,±s)Tab 2 The effect of miR-155 inhibition on airway smooth muscle cell migration and invasion in COPD patients(n=9,±s)
注:与空白组比较,*P<0.05;与anti-miR-NC组比较,#P<0.05。
N-cadherin 0.77±0.04 0.75±0.03 0.36±0.02*#497.483 0.000组别空白组anti-miR-NC组anti-miR-155组FP迁移细胞数137.28±9.15 135.12±9.36 61.64±5.63*#246.587 0.000侵袭细胞数90.67±9.00 90.29±9.72 41.19±4.20*#113.229 0.000 E-cadherin 0.24±0.02 0.23±0.02 0.65±0.30*#37.547 0.000
表3 抑制miR-155对COPD患者气道平滑肌细胞中炎症因子的影响(ng/L,n=9,±s)Tab 3 The effect of miR-155 inhibition on inflammatory factors in airway smooth muscle cells of COPD patients(ng/L,n=9,±s)

表3 抑制miR-155对COPD患者气道平滑肌细胞中炎症因子的影响(ng/L,n=9,±s)Tab 3 The effect of miR-155 inhibition on inflammatory factors in airway smooth muscle cells of COPD patients(ng/L,n=9,±s)
注:与空白组比较,*P<0.05;与anti-miR-NC组比较,#P<0.05。
组别空白组anti-miR-NC组anti-miR-155组IL-6 53.36±4.92 54.01±4.56 106.47±8.17*#224.424 0.000 FP TNF-α 89.43±5.12 89.22±5.59 240.25±14.35*#778.349 0.000
3 讨论
COPD气道平滑肌与气道重塑及炎症反应有关,平滑肌细胞可能通过表达细胞因子、基质金属蛋白酶类、生长因子等引起小气道细胞外基质增加,最终导致气道重塑;因此调控气道平滑肌细胞增殖对控制炎症反应和延缓气道重塑具有重要意义[12,13]。研究表明miRNA与COPD发病及炎症反应相关,miRNA在COPD具有潜在的临床治疗应用前景,可作为COPD的生物学标志物[14,15]。已有研究表明miR-155可能参与了COPD的发病过程[10]。因此,本实验研究了COPD患者ASMCs中miR-155的表达水平,结果显示COPD患者ASMCs中miR-155表达水平明显高于对照组;说明miR-155的确可能与COPD有关。有研究报道miR-155可将细胞周期阻滞在G0/G1期,抑制血管紧张素Ⅱ(angiotensinⅡ,AngⅡ)诱导小鼠主动脉血管平滑肌细胞周期转换[16]。研究报道抑制miR-155促进外膜平滑肌祖细胞的定向迁移可加剧移植性动脉硬化[17]。本实验进一步通过转染miR-155的抑制表达质粒研究miR-155对COPD患者ASMCs增殖和迁移的影响。结果显示,G0-G1期细胞所占比例升高,S期细胞比例而降低,细胞克隆数降低,Ki67蛋白表达水平降低。说明抑制miR-155可阻滞COPD患者ASMCs周期转换,抑制细胞克隆的形成;且迁移、侵袭细胞数降低,N-cadherin蛋白表达水平降低,E-cadherin蛋白表达水平升高。说明抑制miR-155表达可抑制ASMCs迁移和侵袭。
COPD与气道慢性炎症反应相关,而气道平滑肌细胞可影响炎性因子的释放从而调控气道炎症反应[18]。有研究报道在过敏性气道炎症的实验模型中,miR-155是2型先天淋巴样细胞和IL-33信号传导的关键调节剂[19]。miR-155参与调控吸入性肺损伤引起的炎症反应[20]。表明miR-155可参与调节炎性反应。本实验结果显示,抑制miR-155表达后,COPD患者ASMCs中TNF-α和IL-6水平升高。表明抑制miR-155表达可抑制COPD患者ASMCs释放炎性因子,抑制炎症反应。
综上所述,抑制miR-155的表达可抑制COPD患者气道平滑肌细胞增殖、迁移,抑制促炎因子的释放。将可为COPD的治疗提供新理论依据和参考。
