电针对IBS-C模型大鼠血清及结肠中CGRP和5-HT表达的影响
2021-06-03武小利吴生兵陈幸生
武小利,高 纺,吴生兵,陈幸生
(1.安徽中医药大学研究生院,安徽 合肥230038;2.安徽中医药大学中医学院,安徽 合肥230012;3.安徽中医药大学科研中心,安徽 合肥230012;4.安徽中医药大学第二附属医院脑病四科,安徽 合肥230061)
肠易激综合征(irritable bowel syndrome,IBS)是一种慢性胃肠功能性疾病,患者人数占胃肠病患者的30%~50%,其主要表现为腹部胀痛、排便异常。我国人群总患病率达6.5%[1],全球近1/5人群有IBS的临床症状,IBS严重影响着人群健康[2]。便秘型肠易激综合征(irritable bowel syndrome with constipation,IBS-C)是其亚型之一,其病因、发病机制复杂,各种原因引起的肠道敏感性和肠道动力异常均能导致发病。西医依靠药物治疗IBS-C,但存在不良反应大、且易复发的缺点。相比而言,中医传统疗法有伤害性小、疗效稳定的特点,优势明显;其中,电针可通过调节机体气血、阴阳和脏腑起到治疗肠易激综合征的目的[3]。前期研究结果发现穴位间具有协同作用且针刺四单穴组方对改善IBS-C模型便秘症状的效果最佳[4]。研究表明CGRP和5-HT参与了中枢与胃肠互相作用过程[5]。CGRP在胃肠道广泛分布,能调节胃肠分泌及运动[6]。5-HT是与肠道动力和敏感性密切相关的递质,与多种胃肠道疾病有关[7,8]。因此,本研究通过建立IBS-C大鼠模型,探讨电针对IBS-C模型大鼠血清和结肠中降钙素基因相关肽(calcitonin gene related peptide,CGRP)和五羟色胺(5-hydroxytryptamine,5-HT)表达的影响。
1 材料与方法
1.1 动物及分组
选取3个月龄SD大鼠50只,重量220~280 g,由安徽中医药大学实验动物中心提供,许可证号:SCXK(皖)2017-001。大鼠放置在独立送风隔离笼具中饲养,室内温度(22±1)℃,相对湿度(55±5)%,自然光照,自取食水。适应性饲养1周后,按照随机数字表法,选取10只作为正常对照组,其余40只进行IBS-C模型的复制,模型复制过程中死亡10只,将模型复制成功的大鼠随机分组,分别为电针四单穴组、模型组、非经非穴组,每组10只。模型复制不成功的大鼠未列入实验分析对象。
1.2 仪器
超纯水机(美国密理博Milli-Q Reference);程序控制电针治疗仪(PCE-A型);包埋机(湖北泰微TB-718E);超薄切片机(德国徕卡EMUC7);显微镜(日本OLYMPUS);显微图像分析(江苏捷达)。
1.3 模型制备与评定
参照改良寒冷-束缚-饥饱失常综合法复制IBS-C模型[9],使大鼠处于长期应激状态。(1)束缚敷冰法:将冰棒束于大鼠腹部,融化后及时更换,持续1 h,期间密切观察大鼠状态。(2)冰水灌胃法:取冰水混合物,按10 mL/kg的剂量灌胃。(3)冰水游泳法:把大鼠置于0℃冰水中游泳,并进行实时动态观察,以防大鼠疲倦淹死。(4)饥饱失常法:每逢单日对大鼠进行饥饿处理,正常饮水。以上4种方法,饥饱失常法每天使用,其他3种方法每天使用两种,如此交替循环。持续18 d,若见大鼠粪便变干、变硬、变小,情绪易激惹,毛发凌乱失去光泽,则说明造模成功[10]。
1.4 治疗方法
在前期研究基础上,选取四单穴:“曲池”、“天枢”、“大肠俞”和“上巨虚”。取穴标准参照常用实验动物针灸穴位[11]。“天枢”:脐中两侧旁开约5 mm处;“大肠俞”:第4腰椎下两侧旁开7 mm处;“上巨虚”:小腿背外侧上2/5折点处;“曲池”:肘关节外侧前部凹陷中。针刺方法:双侧穴位左右交替针刺。针刺时大鼠头尾及四肢使固定,选用1寸毫针,直刺5 mm,并连至PCE-A型程控电针治疗仪。电针参数:电流(IP-P)为1.5 mA,频率为2 Hz,连续电针20 min,1日1次。造模成功后连续3 d电针。
1.5 观察指标及检测方法
1.5.1 内脏敏感性 内脏感觉状态可以用腹部回缩反射(abdominal withdrawal reflex,AWR)的压力阈值反映。采用无伤害性结直肠球囊扩张实验测定引起大鼠AWR的最小容量阈值。在测试开始前12 h,实验大鼠禁食不禁水,先用少量异氟烷在密闭玻璃罐中轻度麻醉大鼠,然后润滑8F导尿管,将导管经肛门将插入直肠,球囊末端距肛门约为1 cm,将导管绑在鼠尾根部,固定在合适位置,防其脱出。之后将大鼠置于透明固定器内,使其在固定器内只能进行小范围前后活动,大鼠清醒后在笼内适应20 min,然后用注射器将26~28℃生理盐水缓慢注入球囊内,球囊扩张肠道,诱导结肠收缩膨胀。当观察到腹壁收缩反射时,记下注射的生理盐水量,即为该鼠AWR最小容量阈值。间隔15 min重复操作3次得出平均值。若模型组大鼠AWR最小容量阈值与正常对照组相比明显降低,说明造模成功。
1.5.2 各组大鼠血清中5-HT、CGRP含量测定 电针干预后,用10%水合氯醛麻醉大鼠,打开大鼠腹腔,从腹主动脉取血,离心后取上清液,分装后-80℃保存[12]。所取血清应用酶联免疫吸附实验法检测血清中5-HT、CGRP水平。
1.5.3 各组大鼠结肠中5-HT、CGRP含量测定 经电针干预后,打开大鼠腹腔,在游离远端结肠组织取样品1 cm,置于甲醛中保存。用免疫组化检测,记录吸光度值并进行图像分析。
1.6 统计学处理 采用SPSS 21.0软件进行统计学分析。用均数±标准差(xˉ±s)描述连续型变量。进行正态性检验及方差齐性检验,组间比较符合正态性采用方差分析;方差齐时用LSD检验,方差不齐时Dunnett′T 3检验。P<0.05表示差异有统计学意义。
2 结果
2.1 一般状况
正常组大鼠状态良好。模型组大鼠情绪易激惹,毛发发黄且凌乱,食量减少,粪便数量减少,质地变硬,颜色灰白。电针组大鼠粪便质地、性状明显改善,数量增多,毛发变软,情绪稳定。非经非穴组电针后无明显变化。
2.2 AWR最小容量阈值
与正常对照组比较,模型组AWR最小容量阈值降低(P<0.05)。与模型组比较,电针四单穴组AWR最小容量阈值升高(P<0.05),非经非穴组AWR最小容量阈值无明显变化(P>0.05)。见表1。
2.3 电针对各组大鼠血清5-HT及CGRP的影响
与正常对照组比较,模型组大鼠血清5-HT及CGRP水平升高(P<0.05)。与模型组比较,电针四单穴组大鼠血清5-HT及CGRP水平均降低(P<0.05),非经非穴组血清中5-HT及CGRP水平无明显差异(P>0.05)。见表2。
2.4 电针对各组大鼠结肠5-HT及CGRP的影响
与正常对照组比较,模型组大鼠结肠5-HT及CGRP水平均升高(P<0.05)。与模型组比较,电针四单穴组大鼠结肠5-HT及CGRP水平明显降低(P<0.05),非经非穴组结肠5-HT及CGRP水平无明显变化(P>0.05)。见表3。

表1 各组大鼠AWR最小容量阈值(xˉ±s)Tab 1 Minimum AWR volume threshold of rats in each group(xˉ±s)

表2 各组大鼠血清5-HT及CGRP水平比较(n=10,xˉ±s)Tab 2 Serum 5-HT and CGRP concentrations in rats of each group(n=10,xˉ±s)
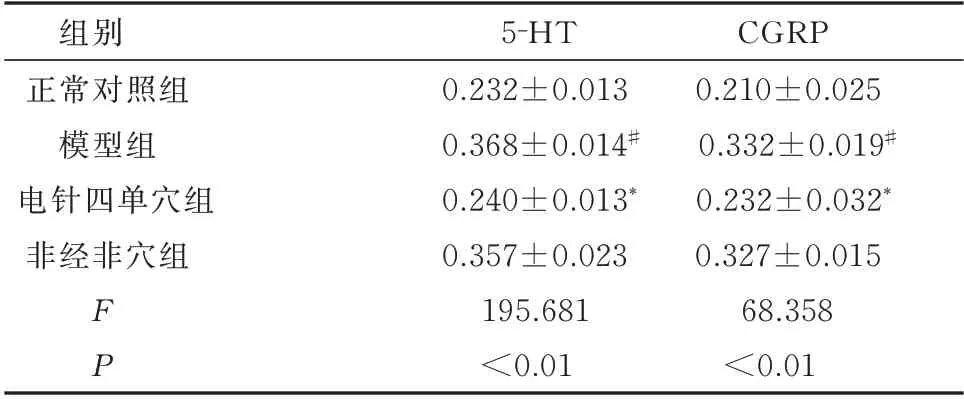
表3 各组大鼠结肠中5-HT及CGRP水平比较(n=10,xˉ±s)Tab 3 Comparison of expression level of 5-HT and CGRP in the colon of rats in each group(n=10,xˉ±s)
2.5 免疫组化结果分析
大鼠结肠内5-HT、CGRP主要表达于黏膜层及黏膜下层,着色细胞呈棕黄色,胞核无色染。与正常组比较,模型组结肠5-HT、CGRP阳性表达率明显增加,差异有统计学意义。电针四单穴组结肠中5-HT、CGRP阳性率表达均降低,与模型组比较差异有统计学意义。非经非穴组结肠中5-HT、CGRP阳性表达率与模型组比较差异没有统计学意义。结果见图1。
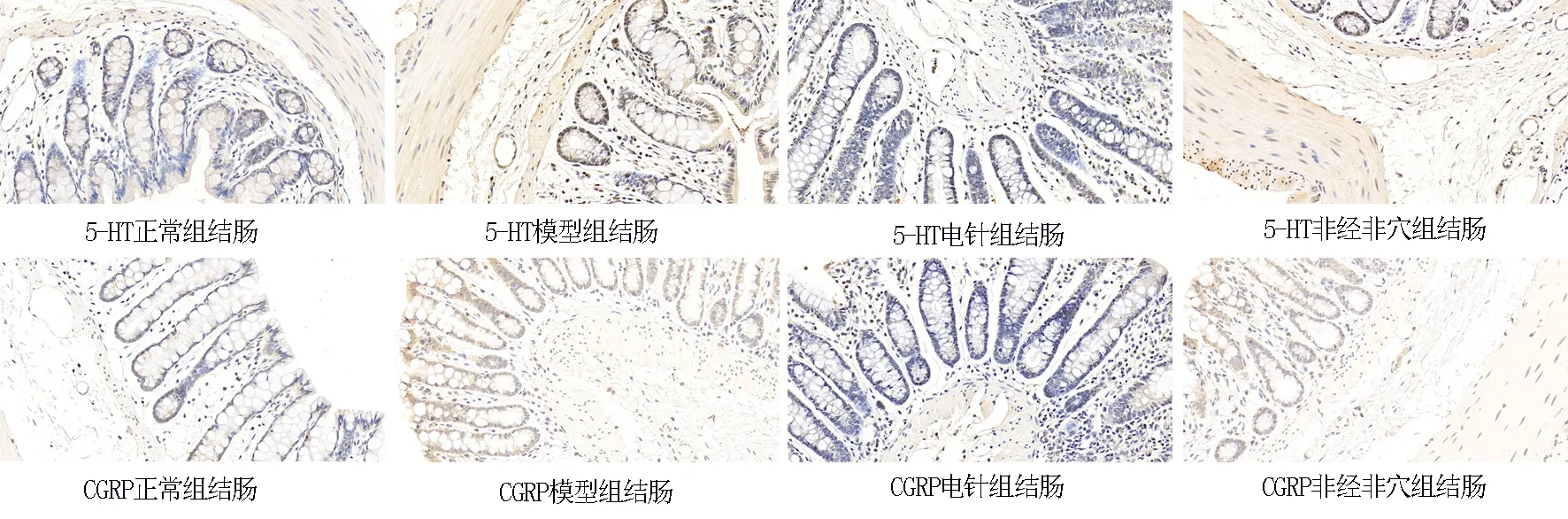
图1各组大鼠结肠5-HT、CGRP阳性细胞的表达(×400)Fig 1 Expression of 5-HT and CGRP positive cells in the colon of rats in each group(×400)
3 讨论
根据便秘型肠易激综合征临床表现,可将其归属于中医“便秘”、“腹痛”的范畴,与饮食不节、外邪侵袭、情志内伤等关系密切,病位在肠,与肝、脾、胃、肾等脏腑相关。因其发病机制不明确,现代医学治疗只能缓解症状。作为中医传统特色疗法之一,针刺治疗IBS效果显著。本研究采取天枢、曲池、上巨虚、大肠俞为治疗穴位,并加以电针刺激进行观察。
《针灸甲乙经》曰,“…大肠胀者,天枢主之…”。天枢与大肠俞分别为大肠经的募穴、背俞穴,为大肠经气输注及脏腑经气汇聚之处,因此二穴均可调节胃肠功能。《灵枢·卫气》曰“……气在胸者,止之膺与背俞。气在腹者,止之背俞……”,俞募配穴亦可发挥协同作用。《针灸甲乙经》记载“…大肠又热,肠鸣腹满,侠脐痛,食不化,……巨虚上廉主之……”。上巨虚是大肠之下合穴,发于足阳明脉气,可通调肠腑、理气和胃。曲池为大肠经之合穴,“合”者汇合,该处气血充盛,且“经脉所过,主治所及”,故曲池可以治疗大肠疾病。以上诸穴合用,效果更佳。
5-HT是一种重要的调节消化道功能的神经递质,与肠道内的受体结合后会刺激胃肠蠕动,引发肠道分泌、运动等,并与内脏的高敏感性联系紧密[13]。CGRP是具有神经递质等多重功能的神经肽,可对胃肠道黏膜的分泌以及运动等功能进行有效调节[14]。据研究,CGRP通过作用于肠段肌肉以及刺激相关神经元释放抑制型递质从而对胃肠道运动起抑制作用[15-17]。生理状态下,5-HT、CGRP合理地参与胃肠功能,使胃肠代谢处于稳定的状态。而水平异常升高的5-HT和CGRP,不仅会使胃肠功能的调控能力受损,还会造成了内脏高度敏感[18]。内脏高敏感性被认为是IBS标志性特点,在炎症、应激等持续状态下,胃肠相关神经末梢被过度刺激,功能也持续敏感,5-HT、CGRP都参与了这个高敏化进程。
本研究结果显示,模型组大鼠AWR最小容量阈值明显低于正常组,说明IBS-C模型复制成功,而与模型组相比,电针四单穴组AWR最小容量阈值显著升高。酶联免疫吸附实验结果显示模型组血清5-HT、CGRP水平与正常组相比明显增高,电针四单穴组与模型组相比血清5-HT、CGRP水平显著下降。免疫组化结果显示,与模型组相比,电针四单穴组结肠5-HT、CGRP阳性细胞表达显著降低。说明电针四单穴能够显著降低IBS-C模型结肠和血清中5-HT、CGRP的水平,增强相应受体及重吸收转运体表达,调节胃肠运动,改善内脏敏感状态[19]。
本研究关于电针作用机制探讨还不够深入,因此,针刺干预便秘型肠易激综合征大鼠胃肠运动作用机制研究将成为今后研究的重点内容。
