多拉菌素的复合诱变及发酵条件优化
2021-06-03张会萍
张会萍,张 萍,牛 春
(宁夏泰瑞制药股份有限公司, 银川 750100)
多拉菌素(Doramectin)20世纪 90年代由美国辉瑞公司研制开发的新一代大环内酯类抗寄生虫药,化学名称为 25-环己烷基-5-O-去甲基-25-去(1-甲基丙酸)阿维菌素B1,分子式为 C50H74O14,分子量为 899.11,易溶于有机溶剂,如甲醇、乙醇、丙酮、二甲基亚砜、乙酸乙脂、乙酸异丙酯和己烷等有机溶剂[1-2]。多拉菌素是阿维链霉菌突变株在发酵过程中添加环己烷羧酸得到的产物[3],抗寄生虫的范围更广,效果更明显,预防寄生虫再感染的时间更长,多拉菌素对畜禽的毒性较小,安全性更好,对环境友好[4],是阿维菌素类抗生素中最据开发潜力的抗寄生虫兽用药[5]。
对多拉菌素出发菌进行常温室压等离子(ARTP)诱变、紫外(UV)诱变和ARTP+UV复合诱变,筛选出一株高效价的多拉菌素突变株,又对该突变株进行发酵培养条件优化,包括培养温度,发酵装量,种龄,培养时间等进行优化,菌株的生产能力和遗传稳定性都有很大的提升,为以后工业化生产提供可靠的工艺参数。
1 材料与方法
1.1 材料
1.1.1 菌种 出发菌株RDL19-1(效价为270 μg/mL),由宁夏泰瑞制药股份有限公司菌种保藏室保藏。
1.1.2 主要试剂和仪器 主要试剂:多拉菌素标准品(纯度≥99%),环己烷甲酸(分析纯,≥99%),蔗糖(分析纯),硫酸镁(分析纯),磷酸二氢钾(分析纯)
主要仪器:ARTP诱变系统ARTP-2-026,北京思清源科技有限公司;PHS-3C酸度计,上海精密科学仪器有限公司;紫外诱变箱和78-1型磁力搅拌器,江苏省金坛市荣华仪器制造有限公司;LC-20AT型高效液相色谱仪,日本岛津公司;BSA3202S-CW型电子天平,赛多利斯科学仪器有限公司;超净工作台,无锡市荣丰净化空调设备厂;XG1-Y型普通卧式压力蒸汽灭菌器,山东新华医疗器械股份有限公司;DHZ-2001B恒温恒湿培养箱,上海博讯实业有限公司医疗设备厂;AS3120A型超声波清洗机。
1.1.3 培养基和培养条件
1.1.3.1 培养基 斜面及分离培养基:蔗糖、可溶性淀粉、琼脂粉,pH7.0。
种子培养基:玉米淀粉、黄豆饼粉、棉籽饼粉,pH7.1-7.3。
发酵培养基:玉米淀粉、黄豆饼粉、棉籽饼粉、硫酸镁、磷酸氢二钾、碳酸钙、微量元素,pH7.1-7.3。培养基灭菌条件均为121 ℃,30 min。
1.1.3.2 培养条件 斜面培养:培养温度28±1 ℃,培养时间8 d。
种子培养:取长势良好的斜面,做成单孢子悬液,接入种子培养基中,种瓶装量为30 ml(300 ml三角瓶),培养温度28±1 ℃,摇床转速240 rpm/min,培养时间20~36 h。
发酵培养:将培养好的种子液在无菌条件下转入发酵瓶中,摇瓶装量为30 mL(300 mL三角瓶),接种量为10%,培养温度28±1 ℃,摇床转速240 rpm/min,培养时间12-15 d。
1.2 实验方法
1.2.1 菌悬液的制备 吸取10 mL无菌生理盐水到培养好的新鲜斜面中,用无菌的铲子刮洗斜面孢子,将洗脱液移入无菌的装有玻璃珠的三角瓶中,震荡5 min打散,用塞有二层擦镜纸的无菌漏斗过滤菌悬液到EP管中,得到单孢子悬液待用。
1.2.2 常压室温等离子(ARTP)诱变处理[6]将无菌铁片装在无菌培养皿中,在超净工作台中吸取20 μL菌悬液滴在无菌铁片上,用无菌镊子夹取铁片放入ARTP诱变系统的载物台上,诱变参数为:电源功率100 W,氦气流量10 L/min,照射距离2 mm。分别照射10、20、30、40、50和60 s,照射结束后将铁片夹入装有5 mL无菌生理盐水的EP管中避光存放,洗脱菌体,吸取1 mL洗脱液用无菌生理盐水按10-1、10-2、10-3、10-4、10-5、10-6梯度稀释,取0.1 mL稀释液涂布双碟,28±1 ℃避光培养,稀释未诱变的菌悬液涂布双碟作为对照组,单菌落计数,计算ARTP不同照射时间的致死率和正突变率(菌株效价对照菌株20%即为正突变),挑取单菌落斜面进行摇瓶初筛,选育高产菌株。
1.2.3 紫外(UV)诱变处理[7]在装有磁力搅拌转子的无菌培养皿中加入5 mL菌悬液,黑暗处15 W紫外灯下,距离30 cm处分别照射30、60、90、120、150和180 s,吸取1 mL照射后的孢子悬液用无菌生理盐水按10-1、10-2、10-3、10-4、10-5、10-6梯度稀释,取0.1 mL涂布平板,28±1 ℃避光培养,稀释未诱变的菌悬液涂布双碟作为对照组,计算紫外照射不同时间的致死率和正突变率(菌株效价对照菌株20%即为正突变),挑取单菌落斜面进行摇瓶初筛,选育高产菌株。
1.2.4 ARTP-UV 复合诱变处理[8]吸取20 μL菌悬液到无菌铁片上,ARTP-W100照射30 s,诱变后将铁片放入装有5 mL无菌生理盐水的EP管中避光存放,洗脱菌体后,吸取5 mL菌悬液到装有磁力搅拌转子的无菌培养皿中,在15 W紫外灯距离30 cm处搅拌照射120 s,稀释菌悬液涂布平板,在28±1 ℃避光培养,计算致死率和正突变率(菌株效价对照菌株20%即为正突变),未诱变的菌悬液涂布双碟作为对照组,挑取单菌落斜面进行摇瓶初筛,筛选高产菌株。
1.2.5 复筛 根据初筛结果选取效价高的斜面进行复筛,种子液以10%的接种量转入发酵瓶,在温度28±1 ℃,转速240 rpm/min条件下摇瓶培养12 d,培养结束后用高效液相色谱法测定多拉菌素效价。
1.2.6 遗传稳定性 复筛选出的高产菌株进行连续5代的传代培养,发酵摇瓶检测效价,验证高产菌株的遗传稳定性。
1.2.7 甘油管保藏法 用20%的甘油与孢子悬液1∶1混合制备甘油管,冷冻于-20 ℃冰箱保存。
1.2.8 HPLC测定
1.2.8.1 样品处理方法 吸取1 mL发酵液,加入4 mL甲醇,超声10 min,静置过夜,3000 r离心,吸取上清液进行 HPLC检测。
1.2.8.2 高效液相色谱条件 LC-20AT型高效液相色谱仪;C18色谱柱(4.6 mm×250 mm,5 μm);检测波长245 nm;流动相为甲醇∶乙腈∶水(体积比)810∶10∶120;进样20 μL;流速1 mL/min;根据积分面积,对照多拉菌素标准品曲线计算多拉菌素产量。
2 多拉菌素高产菌发酵条件优化
2.1 发酵温度试验 分别在25 ℃、28 ℃、30 ℃对多拉菌素进行发酵摇瓶,其他条件不变,培养结束后测定多拉菌素的产量,确定最佳发酵温度。
2.2 发酵摇瓶装量试验 300 mL摇瓶分别装量25、30、35、40、50 mL发酵培养基,其他条件不变,培养结束后测定多拉菌素的产量,判断发酵摇瓶装量对多拉菌素的产量的影响,确定最佳发酵摇瓶装量。
2.3 种龄实验 将培养16、24、32、40、48 h的种子液以10%的接种量转入发酵摇瓶中,进行发酵培养,其他条件不变,培养结束后测定多拉菌素的产量,确定种子培养的最佳时间。
2.4 发酵培养时间对多拉菌素产量的影响 种子液转入发酵瓶后,发酵瓶分别培养12、13、14、15 d放瓶检测多拉菌素的效价,确定最佳放瓶周期。
3 结果与分析
3.1 菌种诱变结果
3.1.1 ARTP诱变的作用结果 原始菌株经ARTP诱变处理后,共挑得单菌落200个,不同ARTP诱变时间的致死率和正突变率如表1所示,随着诱变时间延长,菌株的致死率明显增加,正突变率先随着致死率的增加而增加,诱变40 s后致死率增加正突变率减少,选择ARTP最佳诱变时间为30 s,此时致死率为70.3%,正突变率最高31.7%,有利于筛选高产菌株。

表1 不同ARTP诱变时间菌种的致死率与正突变率Tab 1 Fatality rate and positive mutation rate of different ARTP mutagenesis time strains
3.1.2 UV诱变的作用结果 原始菌株经UV诱变处理后,共挑得单菌落200个,如表2所示菌株孢子的致死率随着UV诱变的时间增加而增加,紫外诱变150 s时,致死率为90.6%,正突变率最高为33.5%。由于致死率过高,还要进行复合诱变,所以确定UV最佳诱变时间为120 s,致死率为75.9%,正突变率为29.3%。
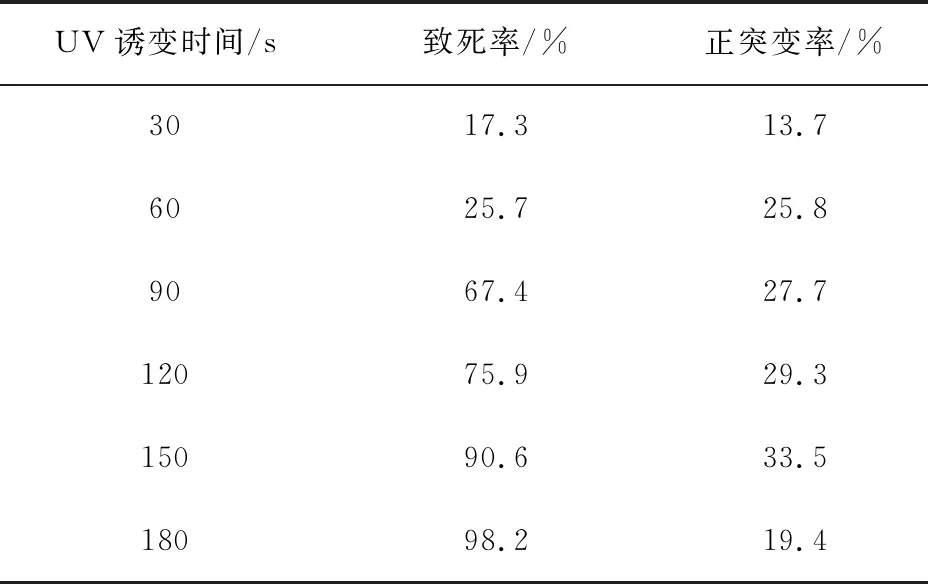
表2 不同UV诱变时间菌种的致死率与正突变率Tab 2 Fatality rate and positive mutation rate of different UV mutagenesis time strains
3.1.3 ARTP+UV复合诱变的作用结果 原始菌株经复合诱变处理后,共挑得单菌落200个,如表3所示孢子悬液经ARTP30 s+UV60 s诱变后,菌株致死率为97.4%,正突变率为52.8%。筛选出一株高产菌株,摇瓶效价在1085 μg/mL,比出发菌株提高了4倍,其含量测定的液相色谱图见图1~图3。
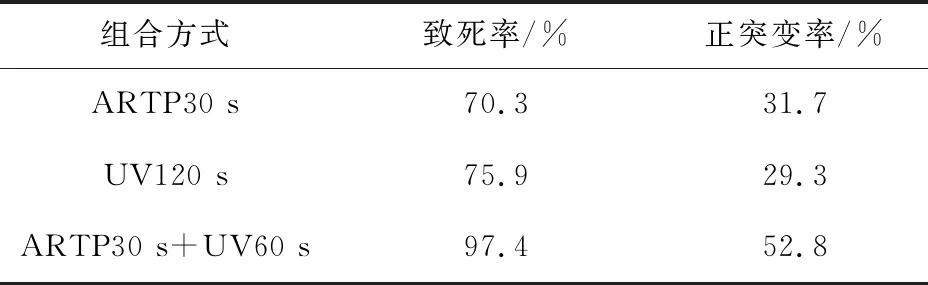
表3 ARTP和UV复合诱变的致死率和正突变率Tab 3 Mortality and positive mutation rate of ARTP and UV combined mutagenesis
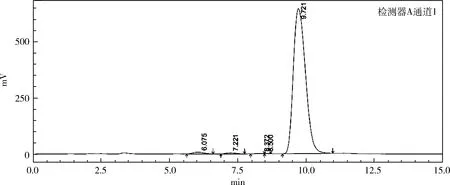
图1 多拉菌素标准品液相色谱图Fig 1 Liquid chromatogram of doramectin standard
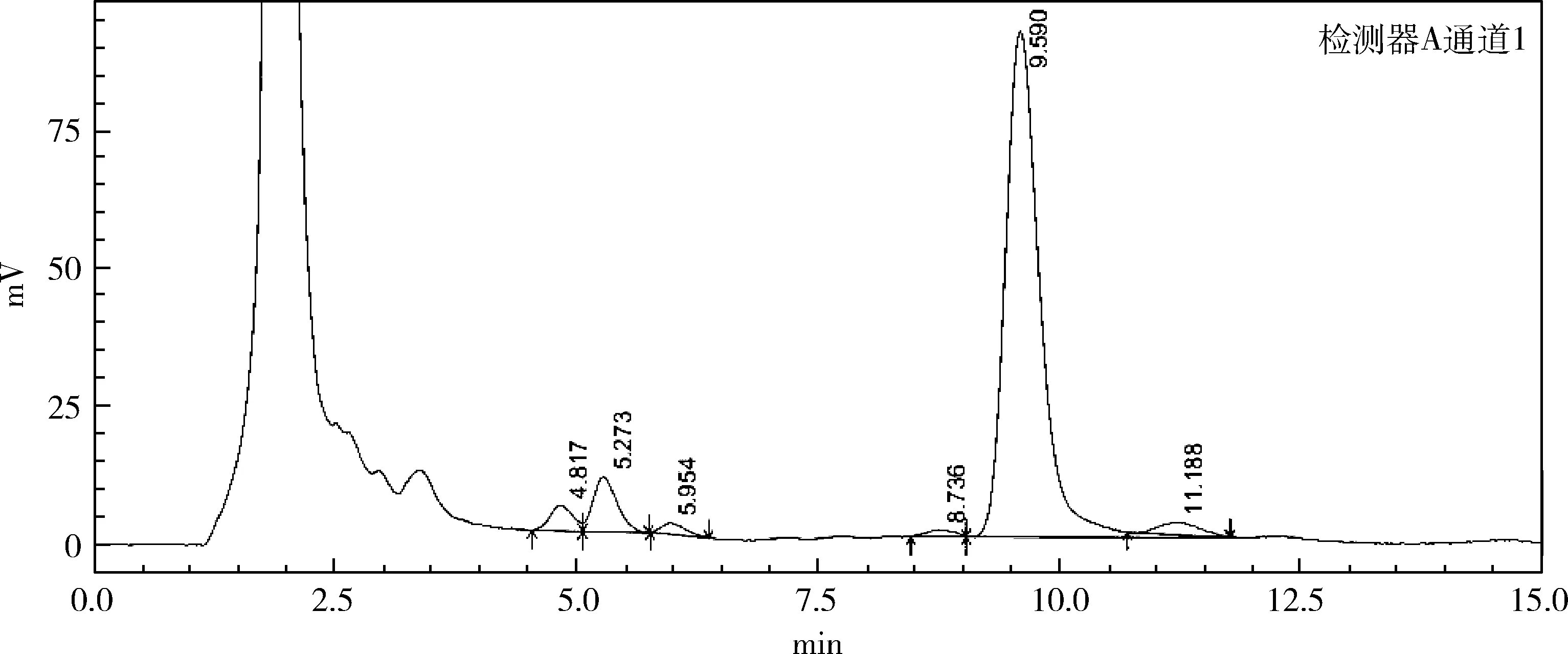
图2 原始菌株液相色谱图Figure 2 Liquid chromatogram of original strain

图3 高效价菌株液相色谱图Fig 3 Liquid chromatogram of high titer strain
3.2菌种稳定性结果 对效价为1085 μg/mL的高产菌株连续进行5次传代,验证菌种传代稳定性,结果如表4所示,传到四代斜面时,效价有小幅下降,五代斜面有明显的降低,说明筛选的多拉菌素高产菌株的遗传稳定性高。

表4 高产菌株的稳定性验证Tab 4 Stability verification of high-yielding strains
3.3 发酵条件优化结果
3.3.1 发酵温度的确定 在25 ℃、28 ℃、30 ℃培养温度下分别培养种瓶发酵瓶,检测结果如表5,不同温度下多拉菌素的产量变化较大,种瓶与发酵瓶的最适培养温度均为28 ℃。
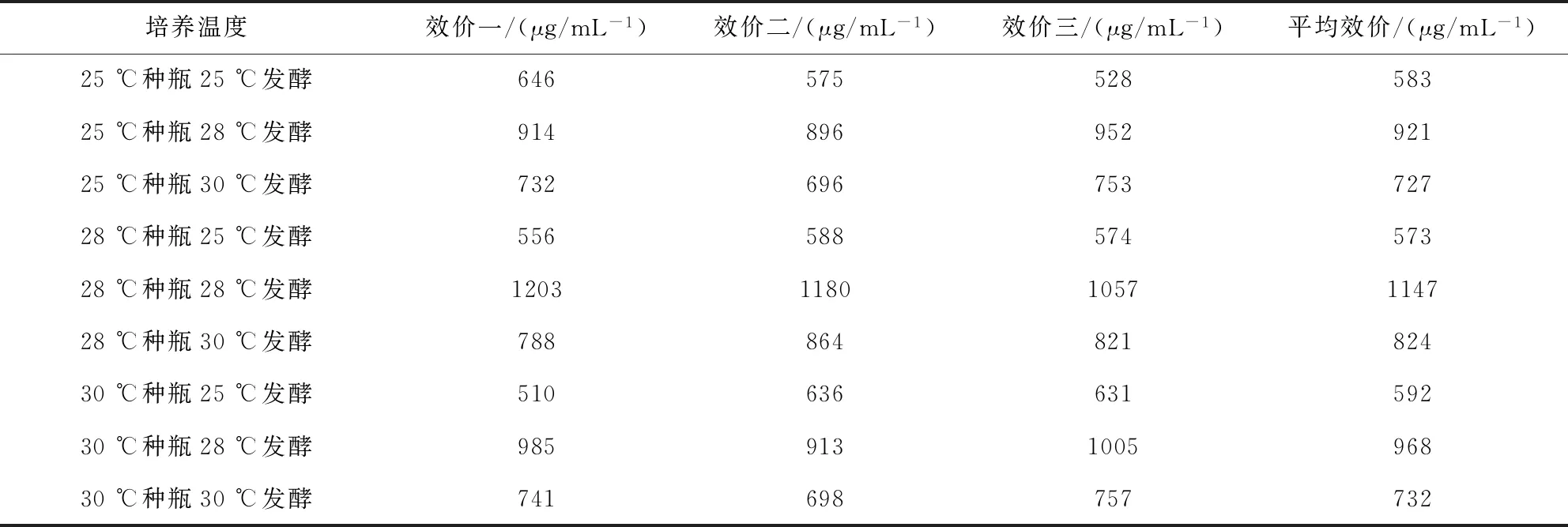
表5 不同发酵温度对多拉菌素发酵产量的影响Tab 5 Effect of different fermentation temperature on fermentation yield of doramectin
3.3.2 发酵摇瓶装量的影响 由表6所示,发酵装量为35 mL时,摇瓶效价最高,装量40 mL以上时效价明显降低,所以确定最佳发酵装量为35 mL/300 mL。

表6 摇瓶装量对多拉菌素发酵产量的影响Tab 6 Influence of shake bottle volume on fermentation yield of doramectin
3.3.3 种龄结果
分别将培养了16、24、32、40、48 h的种子液按10%的接种量转到发酵瓶中,28 ℃培养12 d,检测多拉菌素效价。由下表可知,种瓶培养32 h时检测效价最高。

表7 种龄对多拉菌素发酵产量的影响Tab 7 Effect of seed age on fermentation yield of doramectin
3.3.4 发酵培养时间对多拉菌素产量的影响 种子液接入发酵瓶后,发酵瓶分别培养12、13、14、15 d放瓶检测多拉菌素的效价,如表8所示,发酵摇瓶14 d时效价最高,确定发酵时间为14 d。

表8 发酵培养时间对多拉菌素产量的影响Tab 8 The influence of fermentation time on the production of doramectin
4 讨论与结论
实验室保藏的菌株由于生产能力低,不具备工业化生产的条件[9],诱变技术可以实现短时间内筛选出高产菌株,目前生产所用菌种多为诱变菌种,为企业节约了成本和时间。其中复合诱变技术的利用,可以获取较多的突变菌株。朱晥宜[10]等UV、SP 等的复合诱变,有效地改变菌种对诱变剂的敏感度,获得的高产突变株其生产能力比出发株提高了127%。吴婕[11]对孢子悬液进行紫外诱变、DES诱变和紫外-DES复合诱变、NTG诱变均表现出较好效果。本实验以RDL19-1为出发菌株,通过ARTP-UV复合诱变,获得一株高产菌,摇瓶效价可达1085 μg/mL,比出发菌株提高了4倍,连续传代5次遗传性状稳定。同时对获得的多拉菌素高产菌株发酵进行条件优化,考察了发酵温度、摇瓶装量、种龄、发酵培养时间等方面的影响,结果表明:种瓶在28 ℃培养32 h,以10%的接种量转入装量为35 mL/300 mL 发酵瓶中,在28 ℃条件下发酵培养14 d,多拉菌素发酵产量最高,平均最高效价可达1390 μg/mL。
多拉菌素是阿维链霉菌突变株在发酵过程中添加环己烷羧酸得到的产物,在发酵过程中前体物质含量过多过少都会影响代谢活动,造成多拉菌素发酵产量低,适量的前体物质可以提高菌种代谢活动,缩短合成周期,提高发酵产量。杨世红[3]等考察了不同前体对多拉菌素生物合成的作用,以及有效前体的最佳添加浓度和添加时间,丙酸钠是多拉菌素合成的最佳前体,在发酵96 h时添加0.1%的丙酸纳,多拉菌素产量达139.89 μg/mL,比对照组提高了38.2%,前体物质对多拉菌素的生物合成影响显著。刁金娜[1]通过对前体添加时间和浓度的研究,在发酵第一天和第六天分别添加0.1%和0.06%前体环己烷甲酸钠能促进多拉菌素产素。在接下来的研究中,通过对前体物质添加浓度和添加时间的控制,以期提高多拉菌素的发酵产量。
