牛羊奶中环丙氨嗪残留的液相色谱-三重四极杆/线性离子阱复合质谱检测技术研究
2021-06-03王亦琳王鹤佳
王亦琳,尹 晖,叶 妮,李 丹,孙 雷,王鹤佳
(中国兽医药品监察所,北京 100081)
环丙氨嗪(cyromazine, 化学式C6H10N6)又称灭蝇胺,是一种高效的三嗪类昆虫生长抑制剂类杀虫剂[1],化学结构式见图1。该药物能有效控制动物畜禽舍以及周围环境中的有害昆虫,并促进动物生产性能,因此,该药在畜牧业上得到广泛应用。临床上环丙氨嗪主要作为预混剂拌入全价饲料中,通过饲喂方式进入动物体内,大部分以原形及其代谢产物三聚氰胺(melamine)的形式随粪便排出体外,并沉积在粪便中以杀灭粪便中的蝇蛆[2]。其作用原理为通过诱使蝇蛆在形态上发生畸变,使成虫羽化不全或受到抑制,从而达到控制蝇蛆过量繁殖的目的。由于在畜牧生产中滥用环丙氨嗪,造成动物性食品中环丙胺嗪的残留,可能通过食物链使得消费者的身体健康受到损害[3-4]。美国国家环保局(EPA)在1993年将环丙氨嗪列为具有潜在致癌性的化合物[5],美国和我国都对环丙氨嗪在动物性食品中的限量做了严格规定。我国农业农村部2019年发布的《食品安全国家标准 食品中兽药最大残留限量》(GB31650-2019)[6]中,规定了该药物在羊的泌乳期禁用,但并未规定牛奶中环丙氨嗪的最大残留限量,参照羊泌乳期禁用情况,一起进行牛羊奶中环丙氨嗪的残留检测技术研究。目前国内外已经报道的动物性食品中环丙氨嗪的残留检测分析方法主要有液相色谱法[7-8]、液相色谱-串联质谱法[9-11]和气相色谱-串联质谱法[12-13]等。其中液相色谱-串联质谱法因为分离能力强,选择性好,可以实现复杂样品基质中痕量成分的分析,并且样品前处理相对简单,应用最为广泛。本文拟建立一种液相色谱-三重四极杆/线性离子阱复合质谱检测方法。

图1 环丙氨嗪化学结构式Fig 1 Chemical structure of cyromazine
1 材料与方法
1.1 仪器 日本岛津公司Shimadzu 30A液相色谱仪-美国AB SCIEX公司QTrap 6500质谱仪(配电喷雾离子源); AE260电子天平,Mettler Toledo公司; Biofuge Strators高速冷冻离心机,贺利氏公司; SIR4涡旋混合器,IKA公司;固相萃取装置,Waters公司;Organomation Associates氮吹仪,Jnc公司。
1.2 药品和试剂 环丙氨嗪对照品(C6H10N6,CAS:66215-27-8),购自德国Dr.Ehrenstorfer公司,含量≥98.0%;环丙氨嗪同位素对照品(C313C3H10N6,CAS:1808990-94-4),含量≥99.4%。甲酸(色谱纯)、甲醇(色谱纯)、乙腈(色谱纯)、乙酸铵(色谱纯),美国Fisher公司;三氯乙酸(分析纯)、氨水(分析纯),国药集团化学试剂有限公司;Oasis MCX固相萃取柱:60 mg/3 mL,美国Waters公司;所用水为超纯水。
1.3 样品来源 从北京市超市采购了几种不同品牌的牛羊奶样品,选择无环丙氨嗪药物残留,且基质背景较为干净的样品作为空白样品。
1.4 标准溶液配制 精密称取环丙氨嗪对照品约10 mg,置于10 mL棕色量瓶中,用甲醇溶解并稀释成浓度为1 mg/mL的环丙氨嗪标准储备液;精密称取环丙氨嗪-13C标准品约10 mg,置于10 mL棕色量瓶中,用甲醇溶解并稀释成浓度为1 mg/mL的环丙氨嗪-13C内标储备液。精密量取1 mg/mL的环丙氨嗪标准储备液100 μL于100 mL量瓶中,用95%乙腈水溶液溶解并稀释成浓度为1 μg/mL的环丙氨嗪标准工作液;精密量取1 mg/mL的环丙氨嗪-13C内标储备液100 μL于100 mL量瓶中,用95%乙腈水溶液溶解并稀释成浓度为1 μg/mL的环丙氨嗪-13C内标工作液。
1.5 样品前处理
1.5.1 样品的提取 称取牛奶或羊奶各(2±0.02)g于50 mL离心管内,加入适量环丙氨嗪-13C内标工作液,加入3%三氯乙酸水溶液8 mL,涡旋混合30 s, 超声提取10 min,静置10 min,10000 r/min离心10 min,上清液备用。
1.5.2 样品的净化与浓缩 MCX固相萃取柱依次用甲醇、2%甲酸水溶液各3 mL活化;取备用液全部过柱,用2%甲酸水溶液、甲醇各3 mL淋洗,真空抽干;用5%氨化甲醇溶液3 mL洗脱,收集洗脱液,于50 ℃水浴氮气吹干,残余物用95%乙腈水溶液1.0 mL充分溶解,取适量体积过微孔滤膜后供液相色谱-串联质谱仪测定。
1.6 仪器条件
1.6.1 色谱条件 色谱柱为BEH HILIC色谱柱(50 mm×2.1 mm,粒径1.7 μm),流动相A相为20 mM乙酸铵水溶液;B相为乙腈,梯度洗脱:0~1 min保持95% B;1~3 min,95% B线性变化到60% B;3~3.1 min 60% B线性变化到95% B;3.1~4.5 min保持95% B;流速:0.4 mL/min;柱温:35 ℃;进样量:5 μL。
1.6.2 质谱条件 电喷雾离子源(ESI+);电喷雾电压为5500 V;离子源温度为550 ℃;辅助气1为55 psi;辅助气2为55 psi;气帘气为30 psi;碰撞气为High;检测方式为多反应监测联合信息依赖性采集与增强子离子扫描模式(MRM-IDA-EPI)。环丙氨嗪定性、定量离子对及对应的去簇电压、碰撞能量见表1。IDA参数:①使用动态背景扣除功能;②从不排除之前的目标离子;③触发阈值:100 cps。EPI参数:①扫描范围:m/z70~180;②扫描速度:10000 Da/s;③CE:25 ev;CES:10 ev。
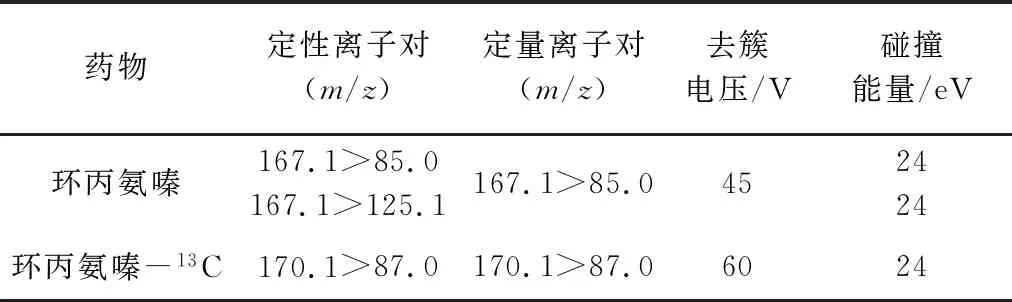
表1 环丙氨嗪及同位素内标MRM参数Tab 1 Mass parameters of cyromazine and its isotopic internal standard
1.7 标准曲线的制备 精密量取环丙氨嗪标准工作液和环丙氨嗪-13C内标工作液适量,用95%乙腈水溶液稀释成含环丙氨嗪浓度分别为0.5、1、2、5、10和20 ng/mL(含环丙氨嗪-13C均为2 ng/mL)的系列标准工作液,由低浓度到高浓度依次上机测定。以环丙氨嗪和环丙氨嗪-13C内标的特征离子质量色谱峰面积之比为纵坐标,环丙氨嗪标准溶液浓度为横坐标,绘制标准曲线,并计算回归方程及相关系数。
1.8 方法准确度及精密度的测定 采用标准添加法,在空白牛奶和羊奶中添加定量限、中、高三个浓度的环丙氨嗪标准工作液和环丙氨嗪-13C内标工作液。每种浓度5个样品平行试验,重复3次,按照1.4项样品前处理方法处理之后上机测定,同位素内标法定量,计算回收率、批内、批间变异系数。
1.9 方法灵敏度确定 添加适量浓度的环丙氨嗪标准工作液于2 g空白牛奶和羊奶中,经前处理后测定,观察药物特征离子质量色谱峰信噪比(S/N) 和对应药物浓度,以S/N>3(按PtP算)作为方法的检测限,以S/N>10作为方法的定量限。
2 结果与分析
2.1 定性分析 在通常的MRM检测模式中,通常选择一个母离子和两个响应较强的子离子进行定性分析。但在动物源食品的残留检测实际工作中,由于待测样品的基质含有蛋白质、脂肪以及内源性组分等多种干扰物质,检测中经常会出现基质干扰峰,影响定性和定量的准确性。本研究采用MRM-IDA-EPI检测模式,可以在利用MRM精确定量的同时,得到目标子离子的二级全扫描质谱图(EPI图),通过与对照溶液的EPI图进行对比,可以更加准确地做出定性判断,排除假阳性。图2是环丙氨嗪阳性添加样品和对照溶液的EPI图,可以发现两者的特征子离子匹配度很高。按照一个母离子1个识别点(IP)点,一个子离子1.5个IP点计算,图2中主要有5个特征子离子,共8.5个IP点,超出了欧盟2002/657/EC[14]规定的禁用兽药,确证检测至少有4个IP点的要求,进一步提高了动物源食品复杂基质中定性的准确性。
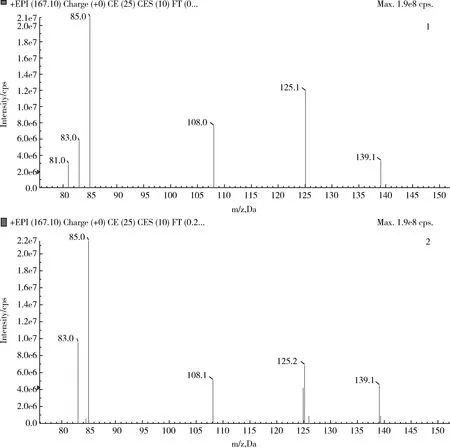
1—环丙氨嗪空白牛奶添加样品;2—环丙氨嗪对照溶液1—blank milk sample added with cyromazine;2—standard solution of cyromazine图2 环丙氨嗪的EPI图Fig 2 EPI chromatogram of cyromazine
2.2 标准曲线 以环丙氨嗪和环丙氨嗪-13C内标的特征离子质量色谱峰面积之比为纵坐标,环丙氨嗪标准溶液浓度为横坐标作图,得到相应的标准曲线,线性回归方程及相关系数(R2)见表2。环丙氨嗪在0.5~20 ng/mL的浓度范围内,峰面积之比与浓度呈良好的线性关系,R2>0.990。

表2 环丙氨嗪标准曲线的回归方程和相关系数Tab 2 Regression equations and correlation coefficients of cyromazine
2.3 方法灵敏度 按1.9项中所述方法进行处理,依据环丙氨嗪特征离子质量色谱峰信噪比S/N>3和S/N>10分别为方法的检测限和定量限,得出在空白牛奶和羊奶中,环丙氨嗪的检测限均为0.2 μg/kg,定量限均为0.5 μg/kg,特征离子质量色谱图见图3。
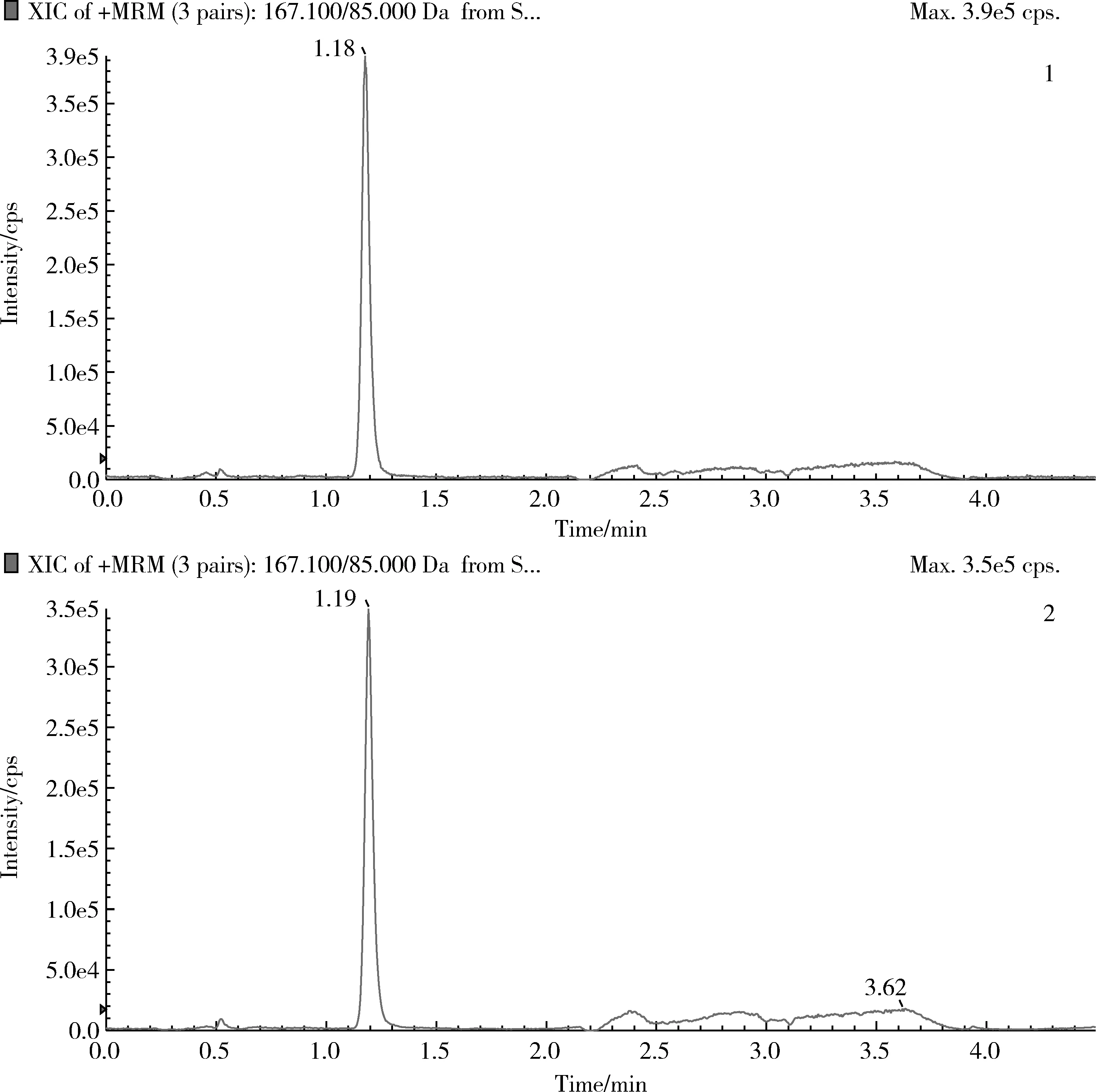
1—牛奶;2—羊奶1—milk;2—goat milk图3 0.5 μg/kg空白牛奶和羊奶添加样品中环丙氨嗪药物特征离子质量色谱图Fig 3 Characteristic ion mass chromatogram of cyromazine 0.5 μg/kg added in blank milk and goat milk
2.4 方法准确度及精密度 在空白牛奶和羊奶中各添加3个不同浓度的环丙氨嗪标准工作液和环丙氨嗪-13C内标工作液进行回收率试验,结果汇总见表3。试验结果表明,环丙氨嗪在牛奶和羊奶0.5~5 μg/kg添加浓度水平上的回收率在98.4%~106%范围内;批内RSD在0.795%~2.45%之间,批间RSD在4.86%~5.68%之间。结果表明本方法定量准确,重复性好。
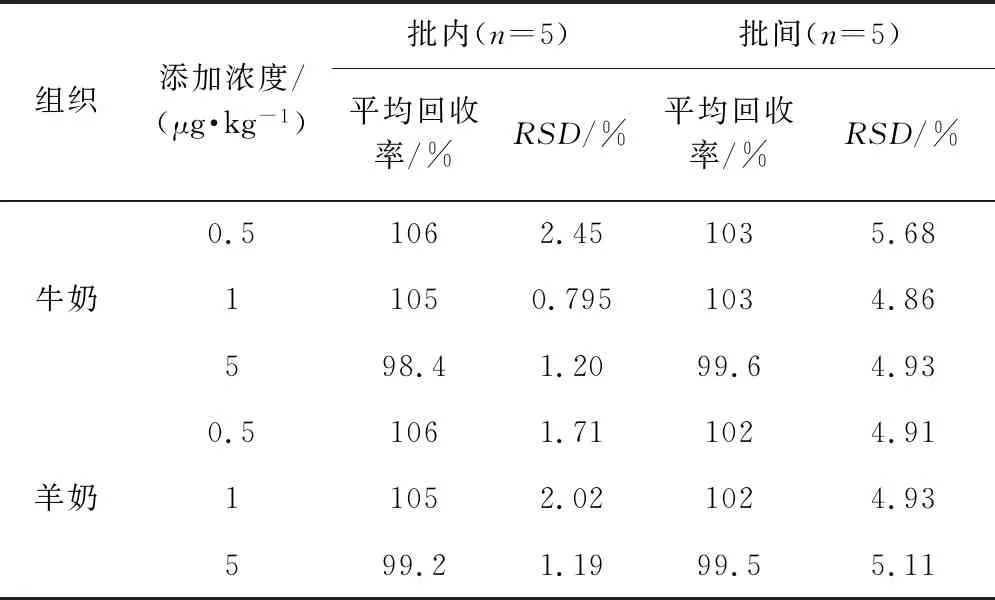
表3 空白牛奶和羊奶中环丙氨嗪添加的回收率(n=5)Tab 3 Recoveries of cyromazine in blank milk and goat milk
3 讨论与结论
目前国内外关于牛羊奶中环丙氨嗪残留检测的报道较少[8,10-11]。与现有国内外文献相比, 本研究主要的优点是较大幅度地提高了方法定性的准确性。由于牛奶和羊奶属于动物性样品,基质比较复杂,在使用通常的MRM方法检测时,尤其是禁用药物在定量限浓度附近,杂质容易干扰目标峰。样品中离子对丰度比与对照溶液相比,容许偏差易超出欧盟2002/657/EC[14]中的规定,对目标物的确证带来一定的困难。本研究使用的三重四极杆/线性离子阱质谱仪(Qtrap)是以传统的三重四极杆离子路径为基础,第三个四极杆(Q3)既可以用作三重四极杆,也可以用作线性离子阱,使得仪器同时具有三重四极杆的准确定量功能和线性离子阱的高灵敏度定性功能[15-16]。利用该特点,建立了MRM-IDA-EPI的质谱分析方法,可以在MRM定量的同时,获得高灵敏度的增强子离子扫描的质谱图。在样品分析时,仪器首先进行探测扫描,采集化合物的MRM离子对信息。然后系统自动判断,当采集到的MRM信号强度超过设定的阈值时(本研究中设为100 cps),系统就会自动切换为线性离子阱模式,进行增强子离子扫描(EPI),获得相应母离子的高质量的二级质谱全扫描图。在实际样品检测时,可将样品与对照品或者实验室已经建立好的EPI谱库中的二级子离子图进行对比,比较两者的特征离子的分布及强度,进而做出更为准确地判断。该方法丰富了样品定性所需要的质谱数据,提高了低浓度水平下目标化合物判定的准确性[17]。
同时,本文的样品前处理过程比较简单。利用3%三氯乙酸水溶液一步提取待测组分并沉淀蛋白。针对环丙氨嗪为碱性化合物,本研究选用了对碱性化合物保留较好的MCX固相萃取柱进行样品净化,获得了满意的净化效果。本文在定量方法选择时采用了同位素内标法进行定量。同位素内标和分析物的结构相似,和分析物在样品基质中的表现一致,可以有效消除牛羊奶基质效应的影响,提高方法定量的准确性。下一步,本实验室会进一步研究环丙氨嗪及类似物在更多动物组织中的残留检测方法,扩大方法的适用范围,以便更好的满足实际工作的需求。
本文采用液相色谱-三重四极杆/线性离子阱复合质谱技术建立了一种可检测牛奶和羊奶中环丙氨嗪残留的分析方法。该方法在进行MRM采集的同时,采用IDA-EPI模式又可以获得目标分析物子离子的完整二级质谱信息,同时实现了定性和定量,可以有效防止假阳性的产生。同时该方法具有良好的可操作性和重现性,方法灵敏度,准确度和精密度均能满足兽药残留分析方面的要求。
