S-腺苷甲硫氨酸合成酶参与肺炎支原体生物被膜形成
2021-06-03李婷婷陈春艳丁伟艳李水红朱翠明
李婷婷,陈春艳,2,余 斓,3,丁伟艳,丁 楠,李水红,朱翠明
社区获得性肺炎(CAP)是一种常见的呼吸系统感染性疾病。5岁以下儿童死因中,约16%由CAP所致[1]。肺炎支原体(Mycoplasmapneumoniae,Mp)是社区获得性肺炎最主要的病原体之一,在儿童和青少年中,10%~30%的CAP是由Mp感染所致,流行期间可达30%~50%[2-3]。除CAP外,Mp感染还与支气管哮喘的发病密切相关,并可引起脑膜脑炎、心肌炎、动脉粥样硬化等肺外感染和并发症[4-5]。
生物被膜(Biofilm,BF)是细菌在生长过程中为适应环境而形成的一种生存状态。BF的形成增强了细菌的黏附活性,阻挡了抗生素、抗体、补体等对细菌的杀伤。此外,BF内的细菌较浮游细菌彼此之间更易进行信号传递、毒力基因及耐药基因的捕获和转移[6]。包括Mp在内的很多支原体在生长过程中可形成BF[7-9]。但目前关于MpBF的研究很少,除Kornspan JD等确定主要黏附蛋白P1是MpBF的组分之一[9];Simmons WL的研究显示过氧化氢酶可促进MpBF的生长和产生[10],此外,目前尚无其他MpBF组成和调节机制的研究。
S-腺苷甲硫氨酸(S adenosyl methionine, SAM)合成酶是SAM在生物体内合成的关键限速酶,广泛存在动物、植物和微生物体内。SAM 合成酶催化 ATP 和 L-甲硫氨酸反应生成SAM,后者作为甲基供体参与多种重要反应。在甲基循环中,SAM提供甲基,使得甲基循环中生成自诱导物-2(Autoinducer-2,AI-2)[11],AI-2是群体感应(quorum sensing, QS)系统的主要信号分子,可促进BF的形成。已有研究发现,鸡毒支原体的SAM合成酶可参与BF的形成[12]。本文初步研究Mp SAM合成酶在BF形成中的作用,为了解MpBF的形成及寻找抗MpBF的制剂提供理论依据。
1 材料与方法
1.1材料 支原体液体培养基CM403和固体培养基CM401购自Oxoid公司。西奈芬净(sc-203263)为Santa Cruz Biotechnology产品;迷迭香酸为Sigma公司产品;UNIQ-10柱式Trizol总RNA抽提试剂盒(SK1321)购自上海生物工程公司;SuperReal 彩色荧光定量预混试剂和细菌全基因组DNA提取试剂盒为Tiangen产品;结晶紫购自湘中地质实验研究所。
1.2菌株来源和分离及鉴 Mp M129菌株(ATCC 29342)为南华大学病原生物学研究所保存。22株Mp 临床菌株由课题组在2016年1月至2018年12月从南华大学附属第一医院儿科呼吸道感染患儿咽拭子标本中分离培养鉴定[13]。
1.3MpBF观察 参照参考文献[7-9]对M129及22株Mp临床菌株进行BF培养,具体如下:24孔板中置入无菌圆玻片,每孔加入1 mL 含1×105颜色变化单位(CCU)的Mp,设置只加培养基孔为对照。37 ℃ 静置培养5~7 d,取出圆玻片,用PBS轻轻冲洗3次,置于培养皿中,加100 μL 10 g/L的结晶紫溶液染色15 min,吸去染色液,无菌水清洗3次,在光学显微镜下观察MpBF 形成情况。
1.4BF半定量分析 96孔细胞培养板中每孔中加入200 μL 1×105CCU/mL Mp菌液,滴加灭菌液体石蜡后于37 ℃培养5~7 d至Mp生长。轻轻移去上清液,用PBS清洗3次,甲醇固定30 min后晾干,用100 μL 0.5%的结晶紫溶液染色30 min,无菌水洗涤3次后自然晾干,每孔加入200 μL 无水乙醇脱色10 min,酶标仪测定570 nm波长处吸光值。实验单个样本均设置3个平行复孔。
1.5实时荧光定量逆转录PCR 采用UNIQ-10柱式Trizol总RNA抽提试剂盒,按说明提取Mp 总 RNA。取 200 ng RNA 用于实时荧光定量逆转录 PCR(quantitative Real-time RT-PCR, qRT-PCR)。metX基因引物为: 5′-GTTTGGGTTGAGCGGAAGA-3′和 5′-CCAAAGTGACCGTAAACAGCA-3′。用Mpmpn665基因作为内参,其引物为:5′-TCCCTACCAGAAAACACCGA-3′和5′-CACGG-ATGGAGAACTTACTACCT-3′。在ABI Stepone plus型荧光定量PCR仪 进行如下反应:95 ℃ 3 min 后,进入 95 ℃ 3 s,60 ℃ 30 s,循环45次。以所得的数据与内参之比作为相对值。
1.6西奈芬净和迷迭香酸对MpBF形成的影响 将1×105CCU/mL浮游状态的M129株分别接种于含10~50 μg/mL西奈芬净和0.5~10 μmol/L的CM403液体培养基,培养5 d后结晶紫染色半定量测定BF形成量,qRT-PCR检测metX的mRNA。

2 结 果
2.1结晶紫染色观察MpBF M129菌株分别进行振动和静置培养5 d,结晶紫染色后光学显微镜观察,静置培养的M129株可见淡紫色网络样团块膜状物,而振动培养仅见散在分布的较小膜状物(图1)。

图1 结晶紫染色观察M129株振动和静置培养5 d后的BF的形成
2.2MpBF形成呈时间依赖性 分别静置和振动培养M129菌株,半定量实验结果表明M129菌株在静置培养第5 d时BF的形成量相对最高。振动培养无明显BF形成(图2)。

①:P<0.05;②:P<0.01
2.3Mp临床株BF半定量分析 对23株Mp菌株进行BF半定量分析,结果显示,与振动培养组比较,13株Mp(56.5%,13/23)的BF形成量显著增高(tM129标准株=28.91,tM119=17.46,tM99=27.05,tM28=7.49,tM134=17.46,tM17=13.78,tM15=12.90,tM42=13.87,tM82=29.42,tM21=14.99,tM71=14.15,tM118=13.73,tM34=8.80,P<0.05);10株(43.5%,10/23)Mp的BF形成量与振动培养组差异无统计学意义(tM120=3.03,tM122=1.54,tM10=3.59,tM101=3.35,tM126=3.40,tM4=3.35,tM9=3.40,tM49=3.86,tM100=4.61,tM132=1.49,P>0.05)(图3)。

①: 与振动培养比较,P<0.05
2.4metXmRNA在BF形成能力不同的Mp菌株的相对转录水平 分别挑选3株不能形成BF的Mp株(M120、M122、M132)和3株形成BF能力强的Mp株(M129、M82、M99),qRT-PCR检测其静置培养5 d后SAM合成酶基因(metX)的mRNA相对表达水平。结果表明3株形成BF能力强的Mp株metX基因的转录水平显著高于不能形成BF的菌株(P<0.05)(图4)。

①:与不能形成BF的菌株比较,P<0.05
2.5西奈芬净和迷迭香酸对MpBF的作用呈浓度依赖性 将Mp分别接种于含不同浓度西奈芬净或迷迭香酸的CM403培养基,5 d后结晶紫染色半定量分析结果显示,与对照未处理组比较,10~50 μg/mL的西奈芬净均能显著减少MpBF的形成。0.5~5.0 μmol/L的迷迭香酸均可促进MpBF的产生,以2.0 μmol/L 迷迭香酸刺激产生的MpBF最多。10.0 μmol/L可显著减少MpBF的形成,因为高浓度的迷迭香酸有抗菌作用,可抑制Mp的生长繁殖(图5)。

A:西奈芬净处理;①:10~50μg/mL西奈芬净处理vs未处理,P<0.05;B:迷迭香酸处理;②:0.5~5.0μmol/L迷迭香酸处理vs未处理,P<0.05
2.6西奈芬净和迷迭香酸对MpBF形成的作用 30 μg/mL西奈芬净处理3株BF形成能力强的菌株(M129、M99、M82),5 d后结晶紫染色半定量检测BF形成,发现3株Mp的BF形成量均较未处理组显著减少(tM129=13.80,P<0.01;tM82=5.261,P<0.05;tM99=12.35,P<0.01)。将3株不能或形成BF能力弱的Mp株(M120、M122、M132)在含2.0 μmol/L的迷迭香酸中培养5 d后,半定量检测结果显示,此3株Mp形成的BF量均较对照未处理组显著增加(tM120=6.279,P<0.05;tM122=81.86,P<0.01;tM132=5.063,P<0.05)(图6)。
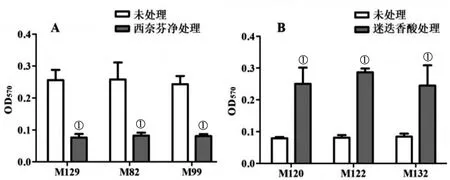
A:西奈芬净处理;B:迷迭香酸处理;①:处理组vs未处理,P<0.05
2.7西奈芬净和迷迭香酸处理后metX转录水平改变 30 μg/mL西奈芬净作用于3株BF形成能力强的Mp菌株后,qRT-PCR检测未处理菌株和西奈芬净处理菌株metXmRNA相对表达水平,结果显示3株西奈芬净处理菌株metXmRNA相对表达水平均较未处理组显著减少(tM129=12.05,P<0.01;tM82=11.88,P<0.01;tM99=8.682,P<0.05)。2.0 μmol/L的迷迭香酸刺激3株BF形成能力弱(或不能形成BF)的Mp菌株后,其metXmRNA的转录水平均较对照未处理组显著增加(tM120=4.953,P<0.05;tM122=5.939,P<0.05;tM132=9.156,P<0.05)(图7)。
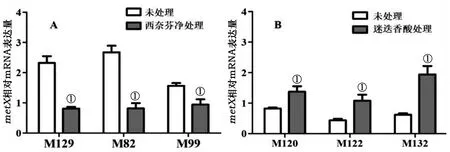
A:西奈芬净处理;B:迷迭香酸处理;①:处理组vs未处理,P<0.05
3 讨 论
细菌黏附在有生命或无生命材料表面后,细菌及其分泌的胞外多糖、DNA和蛋白质等一起形成BF。BF是细菌普遍的生存状态,超过80%的人类细菌感染是由BF引起的[14]。我们检测了23株Mp体外形成BF的能力,结果显示在细胞培养板上静置培养5 d后Mp形成的BF最多。23株Mp中有13株(56.5%)可在96孔培养板中形成较强的BF,10株Mp(43.5%)不能形成BF或形成BF的能力弱。
BF形成过程中,大约50%的蛋白发生改变,BF菌中多种黏附蛋白、糖蛋白、应激蛋白和纤维蛋白等的表达较浮游菌显著上调。我们的实验发现,MpBF形成能力强的菌株中SAM合成酶基因(metX)的表达水平显著高于BF形成能力弱的菌株,表明SAM合成酶可能参与MpBF的形成。SAM合成酶可能是通过催化生成QS系统的前体物质SAM,促进AI-2的分泌,增强群体感应而促进MpBF形成。
西奈芬净是一种腺苷衍生物,其结构与SAM类似但无甲基转移酶的活性,可抑制DNA、RNA、蛋白和其他分子的转甲基化反应[15],减少AI-2的合成,进而减少群体感应而抑制BF形成。Yadav MK发现西奈芬净可抑制肺炎链球菌BF的形成[16]。我们用西奈芬净处理Mp后发现BF 的形成减少,且metXmRNA的相对转录水平亦显著降低。迷迭香酸是革兰氏阴性菌的QS信号分子,功能类似于高丝氨酸内酯,能促进QS系统相关基因表达和BF的形成[17]。我们用迷迭香酸刺激Mp后,发现其BF形成量增加,且metXmRNA的相对表达量亦显著增加。这些结果进一步表明SAM合成酶参与MpBF的形成。SAM合成酶有望成为研发MpBF抑制剂的靶点。
目前儿科治疗Mp感染首选大环内酯类抗生素,但近年来,我国80%以上的Mp分离株对大环内酯类抗生素耐药[18-19]。BF的形成是导致Mp对抗生素形成高度耐药和多重耐药的重要原因之一,研发有效的抗MpBF的药物有重要意义。西奈芬净是从灰质链霉菌中分离出来的药物,有抗真菌和抗恶性疟原虫、利什曼原虫等寄生虫的作用[15,20],最近发现其对寨卡病毒和SARS-Cov-2也有明显的抑制作用[21-22]。但在进行西奈芬净抗寄生虫实验时, 发现其对犬和山羊具有毒性, 故未在临床上推广应用[23]。本研究发现西奈芬净可显著抑制MpBF的形成,因此,若以西奈芬净为基础,研发出新的、无明显毒副作用的抗MpBF制剂可为Mp感染的治疗提供有效药物。
利益冲突:无
