辅酶Q10经蛋白激酶A/胞浆型磷脂酶A2信号通路抑制血小板血栓素A2的生成
2021-06-03牙甫礼张春梅陈彬林谷仕艳贾小娥
牙甫礼,张春梅,陈彬林,谷仕艳,贾小娥
(1.大理大学公共卫生学院,预防医学研究所,云南 大理 671000;2.河口海关,云南 河口 661300;3.广西壮族自治区妇幼保健院营养科,广西 南宁 530000)
心血管疾病的发病率和死亡率逐年上升,已经成为威胁我国人民健康的主要问题和突出的公共卫生问题,动脉粥样硬化和血栓形成是心血管疾病共同的病理变化[1]。诱发动脉粥样硬化性心血管疾病(atherosclerotic cardiovascular disease,ASCVD)的危险因素很多,主要包括年龄、血脂紊乱、肥胖、糖尿病等。近年来大量报道证明血小板在ASCVD病程中具有重要作用[2-3]。
血小板是成熟巨核细胞上脱落下来的细胞质碎片,是循环血液中的一种有形细胞,其主要生理功能是参与止血和凝血[4]。然而,当血小板受到病理性刺激时,尤其在心血管疾病中,血小板可发生激活、聚集以及释放炎症因子等参与动脉粥样硬化和血栓的发生和发展过程,进而在ASCVD病程中发挥重要作用[5-6]。在血小板发生活化的过程中,其生成的血栓素A2(thromboxane A2,TxA2)被认为是促进动脉粥样硬化和血栓形成的重要物质,抑制血小板TxA2生成对于防治心血管疾病中血栓的形成至关重要[7-8]。在冠心病、糖尿病和高脂血症等疾病中,血小板受到血液中可溶性激动剂如凝血酶和二磷酸腺苷(adenosine diphosphate,ADP)等刺激时,胞内众多复杂的信号通路被激活,最终可促进TxA2生成[7]。TxA2半衰期很短(约30 s)且极不稳定,其生成后在半衰期内可通过自分泌和旁分泌的方式作用于邻近血小板、白细胞和内皮细胞等细胞表面的凝血恶烷前列腺素类(thromboxane prostanoid,TP)受体,进而介导一系列炎症反应,如激活血小板、对血小板聚集和炎症因子的释放发挥放大效应,进而参与心血管疾病的发生发展过程[8-9]。随后,TxA2立即被代谢生成稳定形式的血栓素B2(thromboxane B2,TxB2),TxB2从血小板释放出后可进一步作用于其邻近的细胞,参与动脉粥样硬化和血栓形成[7]。由于TxB2较为稳定,血小板释放的TxB2水平常可用来反映胞内TxA2生成情况[10-11]。血小板中TxA2生成受多种信号蛋白分子的调控,血小板激动剂如凝血酶、ADP和胶原等通过激活血小板表面相应的受体,进而激活胞内一系列的信号通路,导致胞浆型磷脂酶A2(cytosolic phospholipase A2,cPLA2)发生磷酸化,使得花生四烯酸从细胞膜磷脂释放出,最终在环氧合酶(cyclooxygenase,COX)和过氧化酶作用下生成TxA2;因此,cPLA2的活化在调控TxA2生成的过程中起关键作用[7]。
cPLA2的活化受多种信号通路的调控,其中蛋白激酶A(protein kinase A,PKA)和丝裂原活化蛋白激酶(mitogen activated protein kinases,MAPKs)介导的信号通路在其中发挥重要的调控作用[12-13]。研究表明,PKA信号通路对于负性调控血小板功能发挥着重要作用,激活该信号通路可使血小板血管扩张刺激磷蛋白酶发生磷酸化,进而抑制cPLA2磷酸化、血小板TxA2生成和颗粒物的释放等,从而抑制血小板聚集、活化和血栓形成[14]。 另外,PKA也可通过抑制钙离子动员和MAPKs信号通路(包括细胞外调节蛋白激酶(extracellular regulated protein kinases,ERK)1/2、c-Jun氮端激酶(c-Jun N-terminal kinase,JNK)1/2和p38 MAPK)发挥抑制cPLA2磷酸化和TxA2生成的作用[7,13]。
营养膳食干预在心血管疾病,尤其是动脉粥样硬化和血栓性疾病的早期防治中起着重要的作用[15]。辅酶Q10(coenzyme Q10,CoQ10)是一种类似于维生素的脂溶性苯醌,在动物脏器(心脏、肝脏、肾脏)、牛肉、豆油、花生等食物中含量相对较高[16]。大量的流行病学、临床实验、动物实验和体外细胞实验表明,CoQ10具有抑制心血管疾病、糖尿病、神经退行性疾病、线粒体疾病等的作用,其机制主要包括抗炎、抗氧化、调节糖脂代谢紊乱和改善内皮细胞等[17]。关于CoQ10对血小板功能调控作用的研究较少,仅有部分研究发现静脉注射外源性CoQ10能显著降低小肠缺血性再灌注动物模型的血小板活化与聚集[18];健康成人每天服用100 mg CoQ10可以显著减小外周血中血小板体积,并能显著降低血小板整合素αVβ3受体的表达[19]。本课题组前期进行的体外实验、动物实验与人群干预研究结果表明,CoQ10可抑制激动剂诱导的人和小鼠血小板聚集和活化以及血栓形成,其中的机制可能是CoQ10抑制血小板整合素αIIbβ3介导的信号通路和上调cAMP/PKA信号通路[20-22]。但目前CoQ10是否影响血小板TxA2的生成尚鲜见报道,因此本研究通过体外实验探讨CoQ10对血小板TxA2生成的影响及其调控机制,为CoQ10防治心血管疾病提供新的理论依据。
1 材料与方法
1.1 材料与试剂
CoQ10粉末(纯度≥98%)、凝血酶(活 力≥2000 NIH units/mg)、PKA特异性抑制剂H89 美国 Sigma-Aldrich公司;胶原 美国Chrono-log公司;Convulxin、苯乙酮 德国Cayman Chemical公司;一抗phospho-cPLA2(Ser505)、β-actin以及二抗羊抗兔 美国Cell Signaling Technology公司;TxB2检测试剂盒 美国Enzo Life Sciences公司;双辛丁酸(bicinchonic acid,BCA)蛋白浓度测定试剂盒 中国Beyotime 公司。其他试剂均为色谱级(纯度≥95%),实验用水均为超纯水。
1.2 仪器与设备
21号一次性采血针、真空负压采血管和一次性注射器 湖南浏阳市医用仪器厂;低温高速离心机 德国Eppendorf公司;小型高速离心机 美国Grant-Bio公司;多功能酶标仪 德国BMG LabTech公司;低温冰箱 青岛 海尔有限公司;万分之一分析天平 瑞士Swiss公司。
1.3 方法
1.3.1 研究对象的筛选
从大理大学校内招募15 名健康成年志愿者(年龄25~40 岁),志愿者要求在至少2 周内未服用任何抗血小板的药物(包括临床上常用于治疗血栓性疾病的药物,如阿司匹林、P2Y12受体拮抗剂、αIIbβ3受体抑制剂和磷酸二酯酶抑制剂等),至少近4 周内无每天饮用茶、咖啡和红酒,且近半年内未补充CoQ10、维生素等膳食营养补充产品;无吸烟(指每天吸卷烟≥1 支,且持续或累计6 个月)、酗酒(指成年男性每日饮酒量超过25 g,女性超过15 g)等不良生活习惯。志愿者出现以下至少1 种情况将予以排除,包括现在或既往患有冠心病、中风、糖尿病、高血压、高血脂、免疫缺陷病、恶性肿瘤、血小板功能障碍等血液系统疾病等病史;或者滥用药物、酗酒、吸烟半年以上;或现正服用或半年内服用任何影响血小板功能的药物等。该研究实施前,每个志愿者均已签署知情同意书,且该研究已通过大理大学伦理委员会批准,并完全按照赫尔辛基宣言和体制准则进行。
1.3.2 健康人血样及纯化血小板的制备
健康志愿者在清晨空腹状态下,采用21号一次性采血针,抽取肘静脉血15 mL,注入含枸橼酸钠的真空抗凝管中(V(血样)∶V(抗凝剂)=9∶1),轻轻混匀,室温下静置15 min后离心(300×g、7 min、22 ℃),为避免吸到白细胞层和红细胞层,小心吸取上层3/4体积的上清液即可得到富血小板血浆(platelet rich plasma,PRP),剩余血样离心(10000×g、15 min、22 ℃),小心吸取上清液得到贫血小板血浆(platelet poor plasma,PPP),PRP和PPP放入37 ℃恒温孵育箱中备用。纯化血小板的制备过程采用本实验室成熟的纯化血小板分离方法[21-23],通过Sepharose CL-2B凝胶系统纯化PRP进行纯化血小板的制备。
1.3.3 实验分组
本研究涉及的实验组别有:静息组:既不经激动剂(如凝血酶、胶原和Convulxin)激活,也不经二甲基亚砜 (dimethyl sulfoxide,DMSO)处理;DMSO组:即溶剂对照组,在血小板悬液中加入体积分数0.05%的DMSO;CoQ10组:分别经1、10 μmol/L和100 μmol/L CoQ10处理;苯乙酮组:血小板经1 μmol/L的苯乙酮处理;CoQ10+苯乙酮组:血小板经100 μmol/L CoQ10和1 μmol/L的苯乙酮联合处理;H89组:血小板经10 μmol/L的H89处理;CoQ10+H89组:血小板经100 μmol/L CoQ10和10 μmol/L的H89联合处理。除了静息组外,其他各组血小板均经激动剂诱导激活。
1.3.4 血小板TxB2释放水平的检测
血小板TxB2释放水平的检测采用酶联免疫吸附法进行检测。用不同浓度(1、10、100 μmol/L)的CoQ10或溶剂对照与健康成人纯化血小板(1×108个/mL)在体外共同孵育50 min,然后加入1 mmol/L的CaCl2溶液,用0.5 U/mL 的凝血酶或2 μg/mL的胶原或50 ng/mL的Convulxin激活血小板5 min后,放于冰上终止反应,然后离心(10000×g、15 min、4 ℃),收集上清液,-80 ℃保存备用,用于检测血小板释放TxB2水平。
进一步在cPLA2特异性抑制剂苯乙酮或者PKA特异性抑制剂H89存在的条件下,考察CoQ10对TxA2生成水平的调控作用。1 μmol/L苯乙酮或10 μmol/L H89提前与血小板共同孵育30 min,然后用100 μmol/L CoQ10或溶剂对照与血小板共同孵育50 min,并加入1 mmol/L CaCl2溶液,用0.5 U/mL凝血酶或者2 μg/mL胶原激活血小板5 min后,放于冰上终止反应,然后离心(10000×g、15 min、4 ℃),收集上清液,检测血小板释放的TxB2水平。
1.3.5 蛋白免疫印迹法检测蛋白表达水平
用不同浓度(1、10、100 μmol/L)的CoQ10或者溶剂对照与健康成人纯化血小板(2.5×108个/mL)在体外共同孵育50 min,然后加入1 mmol/L CaCl2溶液,用0.5 U/mL的凝血酶或2 μg/mL的胶原激活血小板5 min后,放于冰上终止反应,然后离心(10000×g、15 min、4 ℃),弃上清液。向血小板沉淀中加入细胞裂解液和蛋白酶抑制剂,然后置于冰上裂解30 min,离心(12000×g、15 min、4 ℃),收集上清液得到血小板蛋白,采用BCA蛋白浓度测定试剂盒测定蛋白质量浓度后进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,转膜后分别加入一抗(phospho-cPLA2、β-actin)和二抗,然后用自动化学发光图像分析系统对条带曝光,并用Quantity One软件分析条带灰度,计算蛋白表达相对表达量[21-23]。
1.4 数据处理与分析
实验结果用平均值±标准差表示,用SPSS 20.0统计软件采用单因素方差分析进行多组间比较,采用Bonferroni Post-hoc Analysis法进行组间两两比较,双侧P<0.05表示差异具有统计学意义;同时采用GraphPad Prism 5.0软件作图。
2 结果与分析
2.1 CoQ10对激动剂诱导的血小板TxA2生成的影响

图 1 CoQ10对激动剂诱导的血小板TxA2生成的影响Fig. 1 Effect of CoQ10 on agonist-induced platelet TxA2 generation
由于激动剂激活血小板生成的TxA2不稳定,极易被代谢生成稳定的代谢物TxB2,因此通常检测TxB2的水平,用TxB2质量浓度反映血小板TxA2的生成情况[10-11]。如图1A~C所示,通过酶联免疫吸附测定法检测发现,与静息组相比,DMSO组TxB2质量浓度高度显著升高(P<0.001), 表明血小板激动剂凝血酶、胶原和糖蛋白VI激动剂Convulxin激活后血小板TxA2生成水平显著提高。经不同浓度CoQ10预处理后,与DMSO组相比,虽然1 μmol/L CoQ10对凝血酶和胶原诱导的血小板TxA2生成水平没有显著影响(P>0.05),但是10 μmol/L和100 μmol/L的CoQ10可显著降低血小板TxA2生成水平(P<0.05、P<0.01)。 在Convulxin刺激下,仅100 μmol/L的CoQ10可极显著抑制血小板TxA2生成水平(P<0.01)。以上结果表明,CoQ10可显著抑制激动剂诱导的血小板TxA2生成。
2.2 CoQ10对激动剂诱导的血小板cPLA2活化的影响
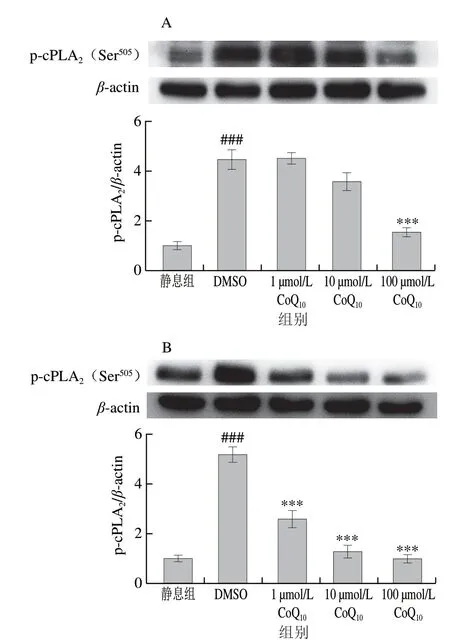
图 2 CoQ10对激动剂诱导的血小板cPLA2磷酸化的影响Fig. 2 Effect of CoQ10 on agonist-induced platelet cPLA2 phosphorylation
大量研究表明,cPLA2蛋白酶活化对于调控血小板TxA2的生成起关键作用,当cPLA2活化时,表现为其Ser505位点发生磷酸化[7]。如图2A、B所示,与静息组相比,当血小板与DMSO共同孵育后,受到激动剂凝血酶和胶原的刺激时cPLA2(Ser505)磷酸化水平高度显著升高(P<0.001)。当CoQ10与血小板共同孵育后,100 μmol/L的CoQ10可显著下调凝血酶诱导的血小板cPLA2(Ser505)磷酸化水平,与DMSO组相比差异高度显著(P<0.001);然而较低浓度(1 μmol/L和10 μmol/L)的CoQ10则不能抑制凝血酶诱导的血小板cPLA2(Ser505)发生磷酸化(P>0.05)。与DMSO组相比,1、10 μmol/L和100 μmol/L的CoQ10均可高度显著降低胶原诱导的血小板cPLA2(Ser505)磷酸化水平 (P<0.001)。以上结果表明,CoQ10可显著抑制激动剂诱导的血小板cPLA2活化。
2.3 cPLA2活化在CoQ10抑制激动剂诱导的血小板TxA2生成中的作用
前期研究已发现,CoQ10可显著抑制激动剂诱导的血小板TxA2生成以及cPLA2活化,但是CoQ10抑制TxA2生成是否通过其下调cPLA2磷酸化水平尚不清楚。由 图3A、B可知,与DMSO组相比,cPLA2的特异性抑制剂苯乙酮可极显著抑制凝血酶和胶原诱导的血小板TxA2生成(P<0.01);此外,1 μmol/L苯乙酮和100 μmol/L CoQ10联合处理组与单独的1 μmol/L苯乙酮处理、100 μmol/L CoQ10处理组相比,对TxA2生成的影响无显著差异 (P>0.05),表明1 μmol/L苯乙酮和100 μmol/L CoQ10联合使用时对TxA2生成的抑制作用无相加或协同作用。以上结果说明,CoQ10抑制激动剂诱导的血小板TxA2生成主要通过抑制cPLA2活化来实现。

图 3 cPLA2活化在CoQ10抑制激动剂诱导的血小板TxA2生成中的作用Fig. 3 Roles of cPLA2 activation in CoQ10-inhibited platelet TxA2 generation induced by agonists
2.4 PKA介导的信号通路在CoQ10调控激动剂诱导的 血小板cPLA2活化和TxA2生成中的作用
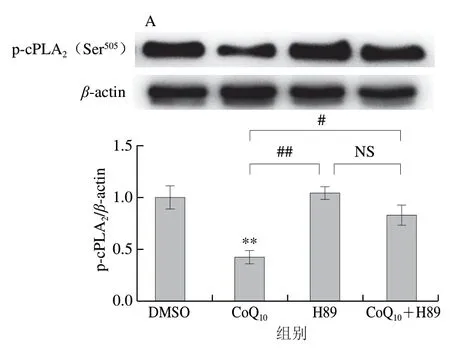
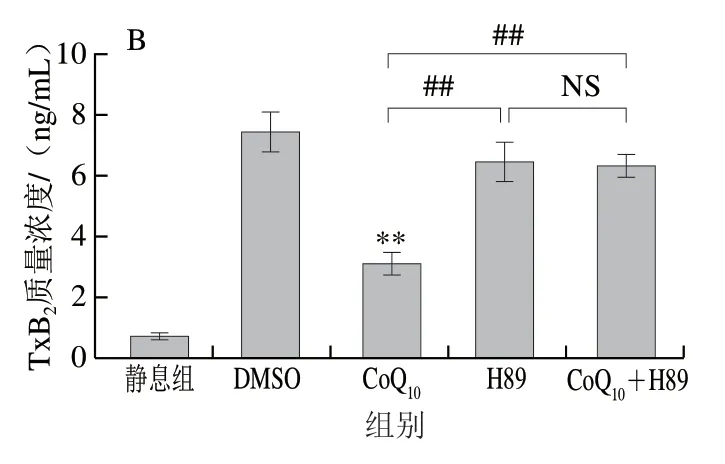
图 4 PKA信号通路在CoQ10抑制凝血酶诱导的血小板cPLA2活化(A)和TxA2生成(B)中的作用Fig. 4 Roles of PKA signaling pathway in the inhibitory effect of CoQ10 to platelet cPLA2 activation (A) and TxA2 generation (B) induced by thrombin
CoQ10通过激活环磷酸腺苷(cyclic adenosine monophosphate,cAMP)/PKA介导的信号通路,进而发挥抑制血小板激活、聚集和血栓形成的作用[21]。因此,进一步探讨CoQ10抑制血小板cPLA2活化和TxA2生成是否受其激活cAMP/PKA信号通路所调控。由图4A可知,PKA特异性抑制剂H89对凝血酶诱导的血小板cPLA2磷酸化的影响与DMSO组相比无显著差异(P>0.05),表明凝血酶诱导的cPLA2磷酸化水平可能已达到最大值;10 μmol/L H89与100 μmol/L CoQ10联合处理组与DMSO组相比无显著差异(P>0.05),表明10 μmol/L H89几乎可完全逆转100 μmol/L CoQ10对凝血酶诱导cPLA2磷酸化的抑制作用。H89对凝血酶诱导的血小板TxA2生成的影响与cPLA2磷酸化类似(图4B)。以上结果表明,CoQ10抑制凝血酶诱导的血小板cPLA2活化和TxA2生成主要通过激活PKA介导的信号通路来实现。总之,本研究结果表明,CoQ10抑制激动剂诱导的血小板TxA2生成的主要机制是调控PKA/cPLA2介导的信号通路。
3 讨 论
动脉粥样硬化性和血栓性心血管疾病,如中风、冠心病等,已经成为全球范围内的重要疾病,血小板TxA2的异常生成和分泌在心血管疾病发生和发展过程中发挥重要作用[9-10]。抑制血小板TxA2的生成及其介导的信号通路已经成为防治动脉粥样硬化和血栓性心血管疾病的重要靶标之一。开发研究抑制调控TxA2合成通路中的关键酶(包括COX和cPLA2等)以及抑制TxA2受体(如TP受体)对于抑制TxA2介导的血栓形成至关重要[7]。目前,市面上已出现的一些抗血小板药物可通过抑制TxA2信号通路发挥有效抑制血栓形成的作用,其中最重要的是阿司匹林,其作用机制主要是抑制COX[24]。此外,奥扎格雷可抑制血栓素合成酶的活性,利多格雷可作为TP受体的拮抗剂[7]。但是这些药物发挥抗血栓形成作用的过程中往往伴有严重的副反应,其中最严重的是易导致出血以及药物性抵抗等,因此在心血管疾病尤其是血栓性疾病的早期治疗中受到很大的限制[25]。临床干预研究证实,CoQ10是一种较为安全的膳食补充剂,可长期使用以防治心血管疾病,而且鲜有出血副反应的报道[26]。本研究通过使用体外实验的方法阐明CoQ10可显著抑制激动剂诱导的血小板TxA2生成,这为膳食补充CoQ10防治血栓性疾病提供新的理论依据。
调控血小板TxA2生成的机制复杂,cPLA2的活化在其中起关键作用[7]。当血小板受到血液中可溶性激动剂如凝血酶、ADP等或者损伤血管内皮暴露的胶原蛋白刺激时,可促发胞内一系列信号传导事件,如激活糖蛋白VI信号通路、G蛋白偶联受体和钙离子动员等,最终导致血小板cPLA2磷酸化,进而促进TxA2的生成[9]。CoQ10抑制凝血酶和胶原诱导血小板TxA2生成的主要机制是抑制cPLA2活化,因为cPLA2的特异性抑制剂苯乙酮与CoQ10联合使用时,对TxA2生成的抑制作用无相加或协同作用。其他信号通路也可能在CoQ10调控血小板TxA2生成的过程中起调控作用,这需要在后续研究中进一步探讨。此外,前期研究结果表明cAMP/PKA信号通路在CoQ10抑制血小板活化、聚集和血栓形成中具有重要作用[14], 本研究发现CoQ10抑制cPLA2活化和TxA2生成受其激活PKA信号通路的调控作用,因为PKA抑制剂H89可完全逆转CoQ10的作用。因此可以推断,CoQ10可能通过激活cAMP/PKA信号通路抑制cPLA2活化和TxA2生成,进而抑制血小板整合素αIIbβ3活化,从而发挥抑制血小板化、聚集和血栓形成的作用。
前期的人群干预研究结果表明,膳食补充CoQ10显著抑制血脂紊乱人群血小板聚集和颗粒物的释放,但是值得注意的是,经过24 周的CoQ10(120 mg/d)干预后,检测发现患者血浆CoQ10浓度约为2 μmol/L[21]。而本研究的体外实验中所用CoQ10剂量为1、10 μmol/L和 100 μmol/L,与其他体外实验研究所用的剂量一致[27-28],并且发现对血小板功能具有显著抑制作用的剂量主要为10 μmol/L和100 μmol/L,这远高于人群干预研究中能抑制血小板功能的血浆CoQ10浓度(约2 μmol/L),原因可能是在体外实验中短时间(50 min)作用于血小板需要更高的剂量才能有效地抑制血小板功能,而在人群干预研究中通过24 周的长期膳食干预,血液中即使较低浓度的CoQ10也可以显著抑制血小板聚集和活化等。研究发现膳食补充CoQ10具有较高的安全性,健康人摄入CoQ10剂量高达2400 mg/d时未见显著的毒副作用[26]。在其他临床干预研究中,如对高脂血症、糖尿病、心力衰竭和帕金森疾病等患者使用剂量不等(50~1500 mg/d)的CoQ10进行干预,发现患者对该剂量范围的CoQ10耐受性良好,血液中CoQ10浓度可高达10.2 μmol/L[26]。因此, 在本研究的体外实验中CoQ10产生效应的浓度在人群血液中是可以达到的。
综上,CoQ10具有显著抑制激动剂诱导的血小板TxA2生成的作用,其机制主要是调控PKA/cPLA2介导的信号通路。本研究从营养膳食或从功能食品途径为CoQ10防治血栓性心血管疾病提供了一定的理论依据。
