慢病毒载体冻干制剂的制备与稳定性研究
2021-06-03沈鸿伟李明昊邵佳琪
沈鸿伟, 李明昊, 徐 南, 邵佳琪, 王 镜, 俞 磊
(华东师范大学 化学与分子工程学院,上海 200062)
0 引 言
慢病毒载体(Lentiviral Vector, LV)是以人类免疫缺陷型病毒(HIV)为基础发展起来的基因治疗载体, 对分裂细胞和非分裂细胞均具有感染能力, 并可以在体内长期稳定地表达[1]. 目前肿瘤免疫治疗两大主流的过继性细胞疗法包括T细胞受体(T Cell Receptor, TCR)−T 细胞和嵌合抗原受体(Chimeric Antigen Receptor, CAR)−T细胞疗法, 其中LV已被广泛应用[2−3]. CAR−T细胞生产环节中包括以携带目的基因的慢病毒载体感染T细胞, 其中慢病毒的滴度对感染是否成功非常关键. 由于慢病毒载体实质是由蛋白质和核酸组成, 这就导致了其储存条件的局限性[4]. 通常, 慢病毒载体无法在常温及4 ℃冷藏的条件下长时间保存, 其热稳定性较差, 同时反复冻融会降低其滴度, 甚至形成不同程度的降解物. 目前并没有理想的慢病毒载体冻存保护液, 这就导致常规的–80 ℃条件冷冻保存或者加入甘油保护剂也不能有效防止慢病毒载体在储存过程中滴度的降低[5−6]. 此外, 慢病毒载体在远距离运输时, 需要采取冷链运输的方式, 增加了运输成本; 即便使用较大量的干冰保护, 也有可能由于温度变化导致活性降低, 无法规避运输过程中带来的风险.
冷冻干燥(Freeze−drying或Lyophilization), 全称真空冷冻干燥, 简称冻干, 是在低温减压的条件下利用水的升华性能, 使药物低温脱水而达到干燥目的的一种技术[7]. 由于真空冷冻干燥技术在低温、低氧环境下进行, 大多数生物反应停滞, 且处理过程无液态水存在, 水分以固体状态直接升华, 使物料原有结构和形状得到最大程度的保护, 最终获得外观和内在品质兼备的优质干燥制品[8]. 通过真空冷冻干燥方法制备得到的粉体硬团聚少、粒径小且均匀, 已经发展成为制备生物制品(尤其是蛋白多肽类)粉针剂的一种重要方法[9−11].
目前国内外的专家学者对于慢病毒载体保存方法的研究少之又少. 有些学者对于慢病毒载体保存方法的研究主要为冻存保护液的处方优化, 欲通过添加适当的保护剂或者改变缓冲体系增强其冻存稳定性的效果[12−14]. 对于慢病毒载体冻干制剂鲜有研究, 且未取得良好的效果[15]. 针对这一研究现状,本文以解决慢病毒载体储存及运输稳定性的问题为目的, 提出以下研究思路.
本文旨在利用真空冷冻干燥的方法, 结合生物制品的保存技术, 选取慢病毒载体来探索出适合病毒类载体储存的新剂型, 同时制备得到新型的慢病毒载体冻干制剂, 通过筛选慢病毒载体冻干保护剂处方, 并以正交实验设计(DOE)的方法进行处方优化, 制备得到外观良好、生物滴度高的慢病毒载体冻干制剂, 使得该制剂在常温下具有较长的保质期, 并且能够在高温高湿的条件下依然保持较高的生物活性.
1 实验部分
1.1 仪器与试剂
75 cm2细胞培养瓶, 24孔细胞培养皿(Corning公司); Labconco Freezone®真空冷冻干燥机(美国Labconco公司); HR40−IIA2型生物安全柜(海尔公司), CCL−170B−8型二氧化碳恒温培养箱(ESCO公司),蠕动泵(Thermo公司); AX224ZH/E型电子天平(奥豪斯公司); S470−K型pH计(梅特勒−托利多国际贸易有限公司); Attune NXT型流式细胞仪(Life Technologies公司); 100 kd超滤管, 0.22 µm滤膜(Millipore公司).
海藻糖(分析纯, Pfanstiehl公司); DMEM细胞培养基、胎牛血清FBS购自美国Gibco公司; 氢氧化钠、蔗糖购自Sigma公司; PBS购自Corning公司; 二水氯化钙、无水硫酸镁、精氨酸、甘油、甘露醇、明胶、PEG6000购自生工生物工程(上海)股份有限公司; 人血白蛋白; 右旋糖酐葡萄糖注射液;L−组氨酸、L−丙氨酸、甘氨酸购自国药集团; 细菌内毒素检查用水购自厦门鲎试剂生物科技股份有限公司; QPCR基因组DNA提取试剂盒购自天根生化科技(北京)有限公司.
1.2 实验方法
1.2.1 ssCART−19质粒的构建与抽提
对本实验所用的目的质粒ssCART−19进行构建及抽提. 目的质粒构建主要为将目的基因与工具载体进行重组、转化挑取多个单克隆, 摇菌并小抽进行酶切鉴定, 选择一个酶切鉴定正确的单克隆进行抽提, 得到含有anti−CD19基因的目的质粒. 质粒抽提主要使用中抽试剂盒, 通过对大肠杆菌的培养得到带有目的基因的质粒的菌液, 通过收集菌液、裂解中和、分离醇沉得到目的质粒.
1.2.2 LV1819慢病毒载体的包装与浓缩液制备
本实验中采用磷酸钙−DNA共沉淀法制备LV1819慢病毒载体[14], 具体制备过程如下.
使用75 cm2细胞培养瓶进行293T细胞贴壁培养, 待细胞状态良好、细胞密度为70%~80%时采用四质粒系统进行293 T细胞转染. 转染后6 h进行换液, 24 h后进行补液, 48 h后收集病毒上清, 然后进行澄清过滤, 过滤后使用小膜包进行浓缩, 浓缩50倍得到慢病毒载体浓缩液. 在处方筛选与优化实验过程中, 由于处方设计组数较多, 故在得到病毒上清澄清过滤后, 采用超滤的方法进行浓缩, 将各组冻干保护剂置换原有的培养基得到浓缩液.
1.2.3 LV1819慢病毒载体冻干制剂制备
配制慢病毒载体冻干保护剂溶液, 将冻干保护剂处方中的各组分按照比例的含量称取后溶解在PBS缓冲溶液中, 用1 mol/L PB调节混合溶液的pH值至7.4. 将配制好的冻干保护剂溶液按照冻干保护剂: 慢病毒载体浓缩液为3∶2的体积比加入浓缩液中, 混合均匀后分装置于4 ℃保存. 采用传统的真空冷冻干燥方法, 先将制品放置于–80 ℃超低温保存冰箱预冻2 ~ 3 h, 使制品呈固状, 扩大表面积. 从冰箱中取出制品迅速置于真空冷冻干燥机的外挂瓶中, 等待真空度降至0.12 mbar以下, 冷阱温度低于–45 ℃为佳. 在此条件下冷冻干燥约48 h, 得到慢病毒载体冻干制剂.
1.2.4 慢病毒载体冻干制剂预处方可行性研究
考察对慢病毒载体冻干制剂预处方的研究, 探索慢病毒载体冻干制剂制备的可行性. 通过设置对照组为HBSS, 实验组为预处方, 具体的冻干保护剂预处方各组分及其配方比如下: 1.0%甘油、20 mg/mL蔗糖、25 mg/mL甘露醇、1 mg/mL L−精氨酸、2 mg/mL甘氨酸、2% PEG6000、1.5%明胶, 加入磷酸盐缓冲溶液(PBS)中, 待保护剂充分溶解后, 用1 mol/L PB调节冻干保护剂预处方溶液的pH值至7.4.
1.2.5 慢病毒载体冻干保护剂处方的筛选
通过对慢病毒载体冻干保护剂5组处方的筛选, 从菌种冻干、脂质体冻干、蛋白质冻干(包括减毒活疫苗类)、其他病毒类冻干(腺病毒等)选定了5组基本的冻干保护剂处方, Ⅰ、Ⅱ、Ⅲ、Ⅳ、Ⅴ组分别通过QPCR的方法检测得到生物滴度[15−21].
初选5组处方, 各组处方组成如表1所示, 其中I组为对照组, 不加任何冻干保护剂作为阴性对照. 按照上述各组冻干保护剂分组的配方比要求, 加入磷酸盐缓冲溶液(PBS)中, 待保护剂充分溶解后, 用孔径为0.22 µm的滤膜过滤除菌.
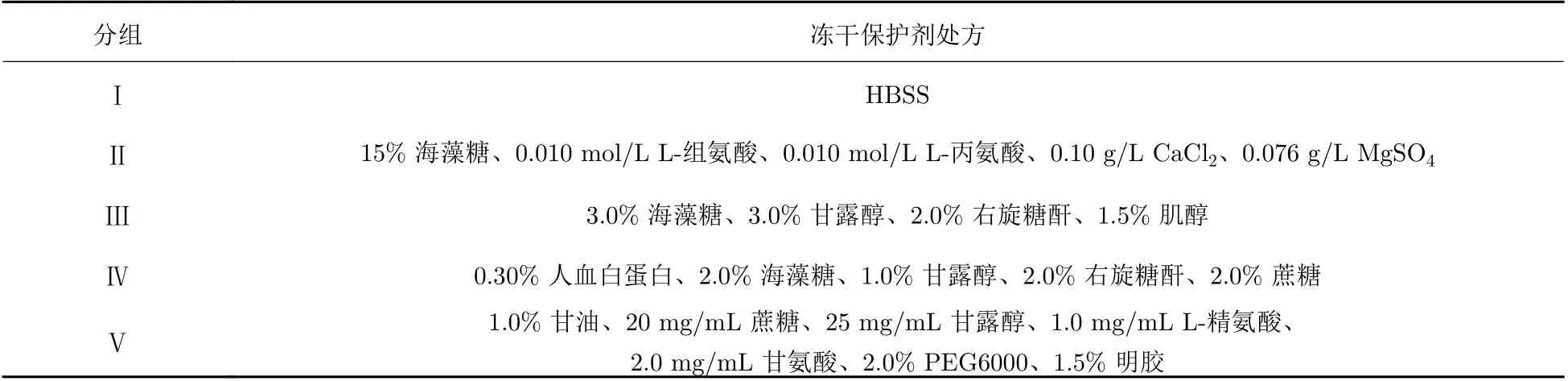
表 1 不同冻干保护剂的效果Tab. 1 Effects of different lyophilized protectants
1.2.6 慢病毒载体冻干保护剂处方的优化及用量的确定
以慢病毒载体的QPCR滴度回收率为考察指标, 以海藻糖用量及L−丙氨酸用量、L−组氨酸用量、CaCl2用量和MgSO4用量5个因素为考察因素, 用来确定冻干保护剂处方中有效成分的最佳用量, 采用正交实验(DOE)的方法对慢病毒载体冻干保护剂处方(Ⅱ组)进行优化, 实验因素如表2所示, 正交实验设计如表3所示(实验过程中用量为配制50 mL冻干保护剂溶液体系所需要的量).

表 2 正交实验因素水平Tab. 2 Factor level of orthogonal experiment
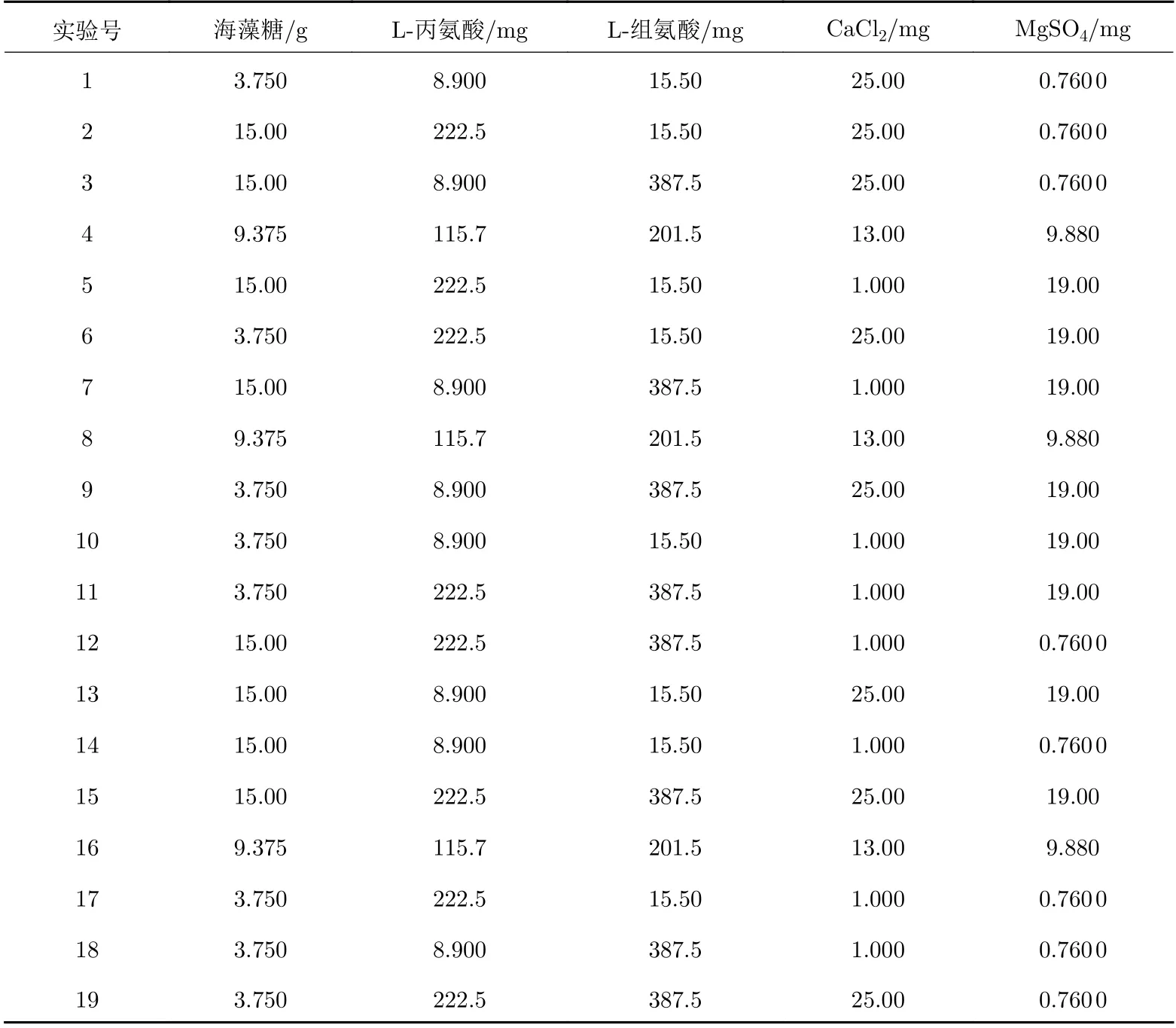
表 3 正交实验设计表Tab. 3 Orthogonal experimental design table
1.2.7 慢病毒载体生物滴度的检测方法
用实时荧光定量核酸扩增检测系统(QPCR)方法进行慢病毒生物滴度测定[13,22]: 在24孔板上每孔加入293 T细胞悬液400 µL, 细胞密度为1.0 × 105个/mL. 以慢病毒载体浓缩液的滴度值为参照,10倍稀释样品. 取慢病毒载体冻干制剂加入500 µL细菌内毒素检查用水复溶, 待溶解完全后加入完全培养基进行10倍稀释, 轻柔吹打均匀后分别取100 µL、50 µL、25 µL慢病毒载体稀释液至3个复孔中. 将孔板放置于37 ℃、5% CO2浓度的恒温培养箱内培养24 h. 取出感染后的细胞进行细胞换液,继续培养48 h后检测. 将24孔板每个孔中的培养上清弃去, 加入800 µL PBS吹打细胞, 将细胞从孔板中取下, 置于1.5 mL 离心管中, 3 000 r/min离心5 min后, 弃去上清收集沉淀. 使用试剂盒提取细胞基因组DNA. 配制实时定量QPCR反应体系, 设置QPCR扩增程序为两步法, 预变性95 ℃、15 s;然后进行变性95 ℃、15 s, 退火延伸60 ℃、36 s的40个循环.
用流式细胞术(FACS)方法进行慢病毒生物滴度测定: 细胞培养过程同上述方法, 但在加入慢病毒载体时, 轻柔吹打均匀后分别取100 µL、50 µL、25 µL、12.5 µL慢病毒载体稀释液至4个复孔中.将孔板放置培养箱内培养24 h. 第二天细胞补液, 继续培养24 h. 后续操作同QPCR方法, 至检测前弃去上清收集沉淀, 加入protein L抗体进行避光孵育45 min. 待孵育结束, 加入PBS洗涤两遍后, 使用流式细胞仪检测.
1.2.8 慢病毒载体冻干制剂残余水分含量测定
通过卡尔费休水分测定法, 检测慢病毒载体冻干制剂中的残余水分含量. 由于慢病毒载体冻干粉末吸湿性强, 按照《中国药品检验标准操作规范(2010年版)》卡尔费休水分测定法测定冻干慢病毒载体含水量[23].
1.2.9 慢病毒载体冻干制剂影响因素稳定性考察
考察了储存温度对慢病毒载体冻干制剂稳定性的影响. 分别取适量慢病毒载体冻干制剂, 置于–20 ℃、23 ℃、4 ℃的3个不同储存温度条件下, 于第1、3、5、7、14、21、30天考察慢病毒载体冻干制剂的外观、色泽、复溶性(再分散时间)和生物滴度.
1.2.10 慢病毒载体冻干制剂高温加速实验
为了研究慢病毒载体冻干制剂与现有工艺(液体制剂–80 ℃保存)的质量比较, 我们选择了高温加速实验, 根据《中国药典(2015年版)》“稳定性实验指导原则”, 选择了一个高温加速实验温度(42 ℃),另一个选择了上述指导原则规定的低温保存生物制品的加速实验温度(4 ℃), 具体稳定性研究方案如下[24].
分别将慢病毒载体冻干制剂置于42 ℃和4 ℃的温度条件下, 贮藏1 ~ 30 d, 比较其生物滴度的变化. 于第1、3、5、7、14、21、30天考察慢病毒载体冻干制剂的外观、色泽、复溶性(再分散时间)和生物滴度. 并以4 ℃温度条件下的慢病毒载体冻干制剂做对比.
1.2.11 慢病毒载体冻干制剂反复冻融实验
将慢病毒载体冻干制剂与现有的冻存制剂进行对比, 考察反复冻融对不同制剂的影响. 反复冻融即反复冷冻–解冻循环, 将慢病毒冻干制剂与慢病毒冻存制品均置于–80 ℃超低温冰箱保存, 每隔一段时间置于室温条件下融化考察慢病毒载体冻干制剂的外观、色泽、复溶性(再分散时间)和生物滴度. 共反复冻融6次.
1.2.12 数据分析方法
使用Minitab 19软件对正交实验数据进行统计学分析与处理, 通过方差分析考察各个因素的主效应及交互作用以及正态概率, 拟合回归模型, 对实验结果进行多响应预测.
使用GraphPad Prism软件以及Adobe Illustrator软件进行图表统计与分析.
2 结果与讨论
2.1 慢病毒载体冻干制剂制备可行性研究
2.1.1 理化性质评价
采用冻干保护剂预处方进行慢病毒载体冻干制剂可行性探究, 并制备得到外观良好的慢病毒载体冻干制剂, 外观、色泽度、复溶性(再分散时间)等理化性质指标如表4所示.

表 4 慢病毒冻干制剂的理化性质评价Tab. 4 Evaluation of physical and chemical properties of the freeze-drying preparation technique
2.1.2 生物滴度考察及回收率测定
使用流式细胞术(FACS)和实时荧光定量核酸扩增检测系统(QPCR)的方法考察慢病毒载体的生物滴度, 实验结果如图1所示.
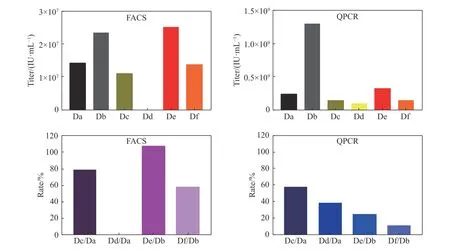
图 1 慢病毒载体冻干前后滴度值与回收率Fig. 1 Titer value and recovery rate of lentiviral vector before and after freeze−drying
比较冻干保护剂与HBSS对于慢病毒载体在–80 ℃保存以及在冻干的过程中的影响, 同时对比冻存前后以及冻干前后对慢病毒滴度的影响. 其中Dd组最后没有测到数据, 说明在冻干的过程中,HBSS没有起到对慢病毒的保护作用, 导致慢病毒全部损失. 在冻干的过程中, 冻干保护剂确实能够起到保护作用, 最终两种检测方法均测得滴度回收率. 通过这两种检测方法可以看出慢病毒载体冻干制剂制备的可行性, 即慢病毒载体可以通过真空冷冻干燥的方法进行制备得到慢病毒冻干粉.
2.2 慢病毒载体冻干保护剂处方的筛选
2.2.1 不同冻干保护剂对理化性质的影响
采用5组处方进行慢病毒载体冻干保护剂处方筛选, 以冻干产品的外观、色泽和复溶性为指标综合评价其理化性质, 考察了各种冻干保护剂对冻干产品的保护作用, 结果见表5.
2.2.2 不同冻干保护剂对滴度回收率的影响
筛选5组冻干保护剂处方的慢病毒载体滴度回收率结果如图2所示.
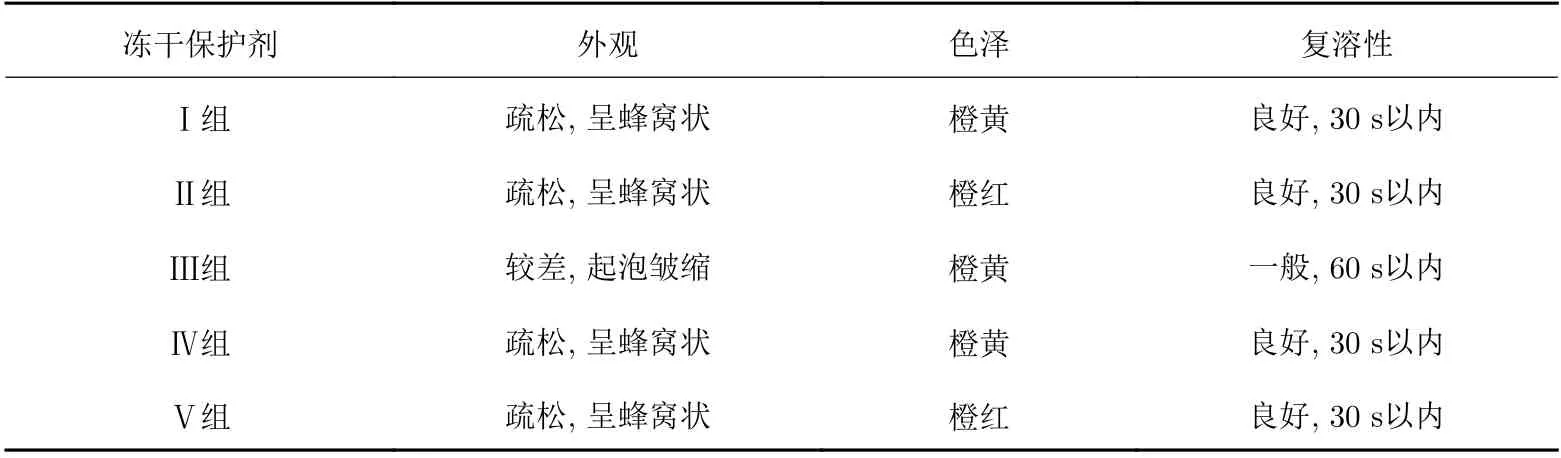
表 5 不同冻干保护剂的效果Tab. 5 Effects of different lyophilized protectants

图 2 慢病毒载体冻干制剂与冻存液滴度回收率Fig. 2 Recovery of the lyophilized lentiviral vector and cryopreservation titer
从图2(a)中可以看出, Ⅱ组的冻干保护剂处方保护效果最佳, 加入Ⅱ组的冻干保护剂处方后制备得到的慢病毒载体冻干制剂, 感染细胞后通过QPCR的方法检测得到的滴度值最高; 图2(b)显示,Ⅱ组慢病毒载体的滴度回收率最佳, 两图相符合, 无论在冷冻保存条件下还是在真空冷冻干燥后,Ⅱ组的冻干保护剂的效果均最好, 所以选择II组保护剂进行优化并确定用量.
2.2.3 冻干保护剂的选择
主要可分为以下几类: 一般为多羟基化合物、糖类、氨基酸、蛋白质、聚合物和无机盐等化合物[25−27].因为不但要具有保护生物制品活性的效果和结构不发生改变, 而且要具有冻干赋形作用. 糖是一种使用最广泛的冻干保护剂, 本研究中采用的海藻糖属于二糖, 比蔗糖具有更低的吸湿性和更高的玻璃态转化温度, 其羟基能替代水分子与蛋白质分子表面部分结合, 而且海藻糖分子较小, 能填充到蛋白质分子的空隙中, 有效地限制蛋白质分子内部的结构发生变化, 在冻干时可以对慢病毒的蛋白衣壳形成保护, 因此冻干制剂保护效果更好[28−29]. 氨基酸具有酸性羧基和碱性氨基, 能够调节制品溶剂环境的pH值, 不同类别的氨基酸具有不同的亲水性功能, 而亲水性强的氨基酸较易与蛋白质产生氢键, 这对蛋白质在冻干的过程中的稳定性和活性具有重要的保护作用, 如组氨酸、丙氨酸等, 可以增加慢病毒载体包膜蛋白和组氨酸磷酸盐缓冲液间的张力, 提高慢病毒载体包膜蛋白水化水平. 而加入二价阳离子类, 如CaCl2和MgSO4这两种无机盐, 可延迟海藻糖结晶, 通过和磷酸根阴离子存在下氢键网络以及分子迁移率的变化抑制结晶.
2.3 慢病毒载体冻干保护剂处方的优化并确定用量
2.3.1 正交实验结果表
将通过QPCR的方法检测生物滴度的结果作为正交实验的响应值, 正交实验结果表如表6所示.
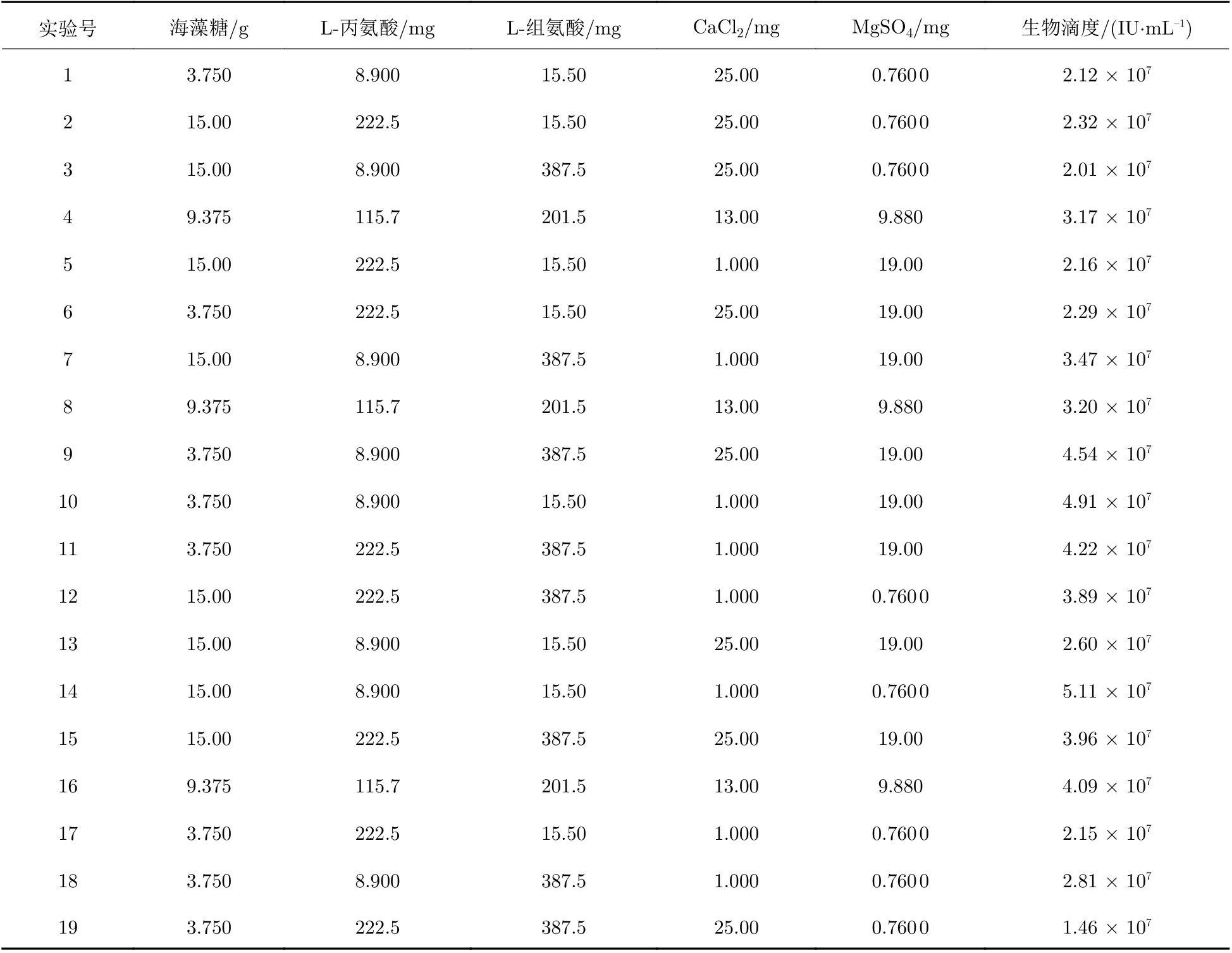
表 6 正交实验结果表Tab. 6 Results of orthogonal experiment
2.3.2 方差分析表
结果详见表7.
2.3.3 回归拟合模型
结果详见表8.
2.3.4 正交实验优化
结果详见图3.
由以上的方差分析结果及图3(a)–(c)图, 可以看出, 该组处方中所有的组分均具有显著效应(P<0.05), 从侧面印证了该组冻干保护剂处方的有效性. 从图3(a)中可以看出, 除L−丙氨酸和CaCl2以外, 其余组分因子均表现出正效应较强; 从图3(b)中可以发现生物滴度的结果正态概率分布良好, 观测值顺序与运行顺序无关; 从图3(c)中明显看出高于2.57标准线的因子项, 表现出显著效应;从图3(d)中可以看出处方中的相关组分之间均存在交互作用, 海藻糖与处方中其余组分间的交互作用较强. 图3(e)和图3(f)两图显示正态概率分布良好, 满足实验要求. 图3(g)显示冻干保护剂处方各组分含量的最优的范围; 图3(h)通过响应器优化, 得出冻干保护剂处方用量最优的一组解.
2.3.5 多响应预测结果
结果如表9所示.

表 7 正交实验方差分析表Tab. 7 Analysis of variance of orthogonal experiment

表 8 回归拟合模型汇总表Tab. 8 Summary table of regression fitting model
根据多响应预测结果, 确定最优的冻干保护剂处方为15 g海藻糖、8.9 mg L−丙氨酸、15.5 mg L−组氨酸、1.0 mg CaCl2、0.76 mg MgSO4. 并根据这一处方要求的用量进行了处方验证实验, 验证实验结果表明, 在这一组冻干保护剂处方的条件下, 慢病毒载体的生物滴度可高达9.37 × 107IU/mL, 滴度回收率为50.15%. 冻干效果良好.
2.4 慢病毒载体冻干制剂残余水分含量的测定
通过慢病毒载体冻干保护剂处方的筛选与优化, 确定了最优的一组冻干保护剂处方, 并通过3次验证确定了该处方对于慢病毒载体冻干的过程中保护效果. 使用验证过程中制备的慢病毒载体冻干制剂, 检测残余水分含量, 水分含量为(7 ± 0.05)%. 该结果满足要求, 表明在此含水量条件下慢病毒载体冻干制剂最为稳定. 冻干后水分含量直接影响了慢病毒载体的状态和稳定性, 维持较低的水分含量, 病毒才能维持休眠状态, 但水分含量低于0.5%时可能会引起冻干的过程中DNA链的断裂导致病毒的活性降低甚至死亡.
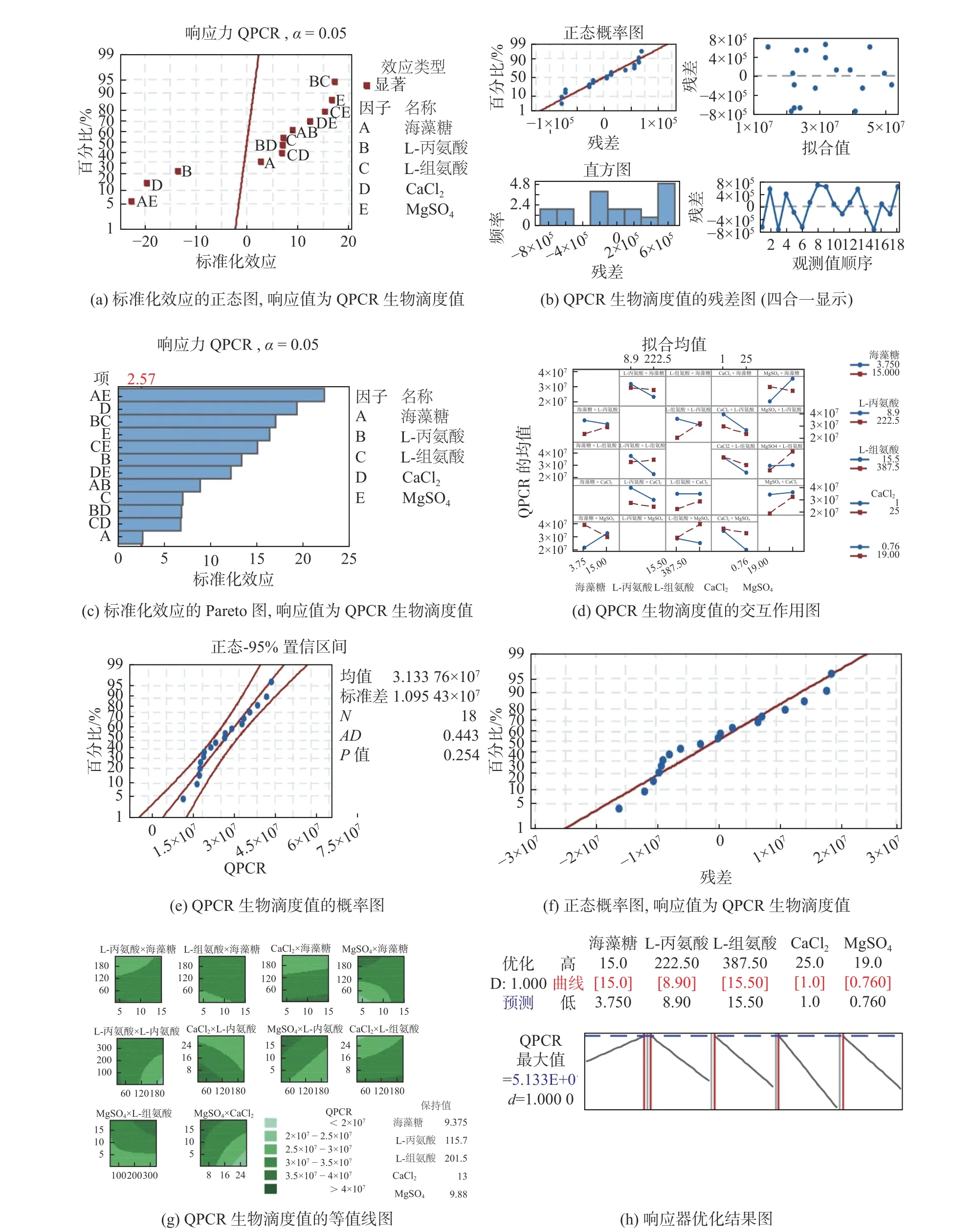
图 3 正交实验结果分析图Fig. 3 Analysis diagram of orthogonal experiment results
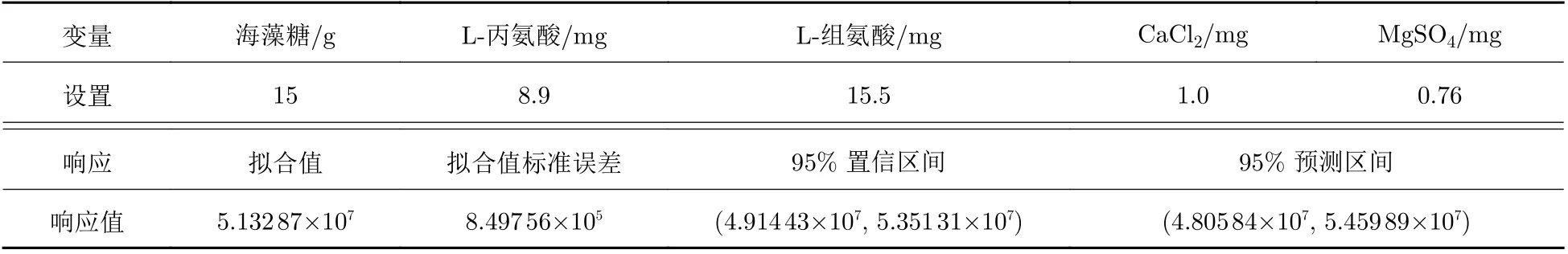
表 9 多响应预测结果Tab. 9 Results of multiple response prediction
主要考察慢病毒冻干制剂的外观、色泽、复溶性以及生物活性. 其中外观是冻干制品的重要质量属性之一, 合格的冻干制品外观应是疏松多孔、色泽均匀、质地细腻的粉末状固体. 同时考察冻干制剂的稳定性. 慢病毒载体的初步稳定性主要考察 –20 ℃(相对湿度75%)、23 ℃(相对湿度75%)、2 ~ 8 ℃长期保存条件以及42 ℃高温加速实验.
2.5.1 影响因素稳定性研究
2.5.1.1 高温加速实验对慢病毒冻干制剂稳定性的影响
采用最优的冻干保护剂处方制备得到外观良好的慢病毒载体冻干制剂, 进行冻干制剂稳定性研究, 考察外观、色泽度、复溶性(再分散时间)等理化性质指标. 不同温度对于慢病毒载体冻干制剂的储存影响不大, 观察4 ℃、–20 ℃以及23 ℃条件下的慢病毒载体冻干制剂, 可以看出随着保存时间的延长, 外观与色泽度均未发生明显改变, 疏松并呈蜂窝状, 橙红色, 加水复溶后状态良好, 考察再分散时间均在30 s以内. 但是高温保存慢病毒载体冻干制剂, 外观与色泽度较差, 结果如表10所示.
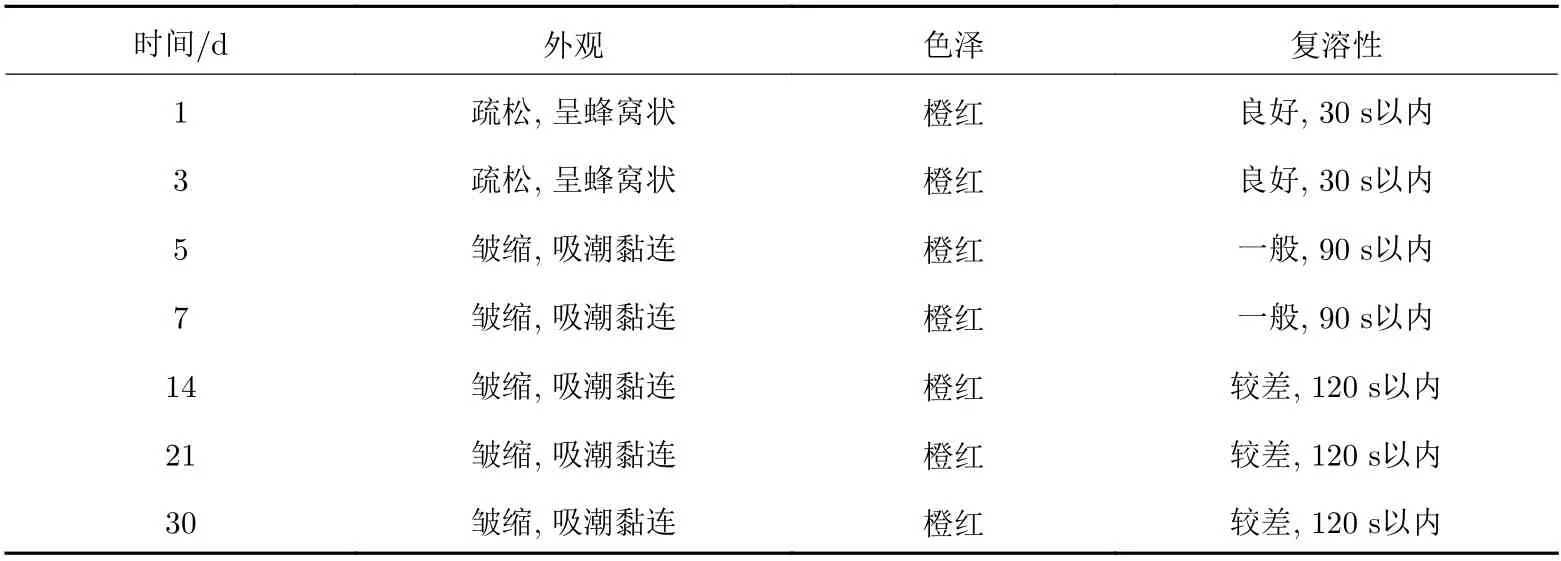
表 10 高温加速实验(42 ℃)条件下慢病毒冻干制剂的保存效果Tab. 10 Preservation effects of freeze-drying preparations at 42 ℃
2.5.1.2 不同温度对慢病毒冻干制剂稳定性的影响
使用QPCR检测慢病毒载体冻干制剂和冻存制品的生物滴度(IU/mL), 对生物滴度值取lg对数函数, 以lgT对时间t做图, 结果可参见图4.
由图4可以看出, 不同温度对于慢病毒载体冻干制剂和冻存样品均有显著的影响. 图4(a)为4 ℃冷藏保存后慢病毒载体滴度结果, 由图中的结果可以看出慢病毒载体冻干制剂有更好的保存效果, 随着时间的增加, 滴度虽有下降但比较稳定, 冷冻干燥前的样品置于4 ℃冷藏保存后滴度下降明显; 从图4(b)可以看出, 在–20 ℃条件下保存, 无论是慢病毒载体冻干还是冻存样品, 均比较稳定; 从图4(c)中发现, 室温条件对于慢病毒载体冻干制剂的保存效果更好; 图4(d)为高温加速稳定性的结果, 高温高湿的条件对于慢病毒冻干制剂和冻存制剂都产生了严重的不稳定的影响, 对于慢病毒本身产生了极大的负面效应.
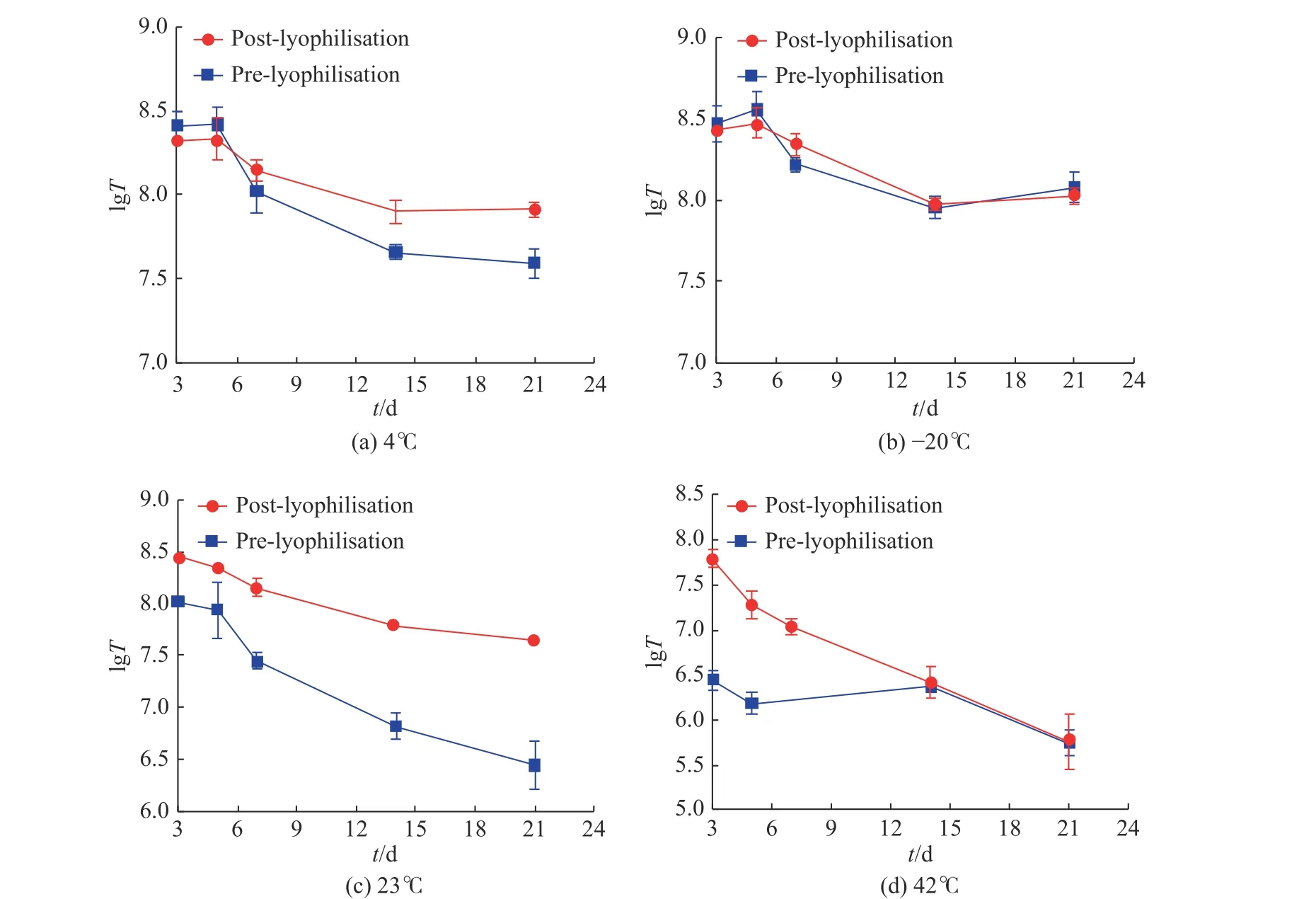
图 4 不同温度条件下滴度对数值结果Fig. 4 Titer log results at different temperatures
结果表明, 慢病毒载体在冷冻干燥以后可以实现较长时间的保存, 但是生物滴度值会下降, 说明在储存时也会缓慢失活, 不同温度下的降解速度大小为23 ℃ > 4 ℃ > –20 ℃. 但是在4 ℃保存的条件下慢病毒载体冻干制剂能更稳定, 凸显了其储存优势.
2.5.2 反复冻融稳定性研究
2.5.2.1 反复冻融对慢病毒冻干制剂理化性质的影响
采用最优的冻干保护剂处方制备得到外观良好的慢病毒载体冻干制剂, 进行冻干制剂稳定性研究, 考察外观、色泽度、复溶性(再分散时间)等理化性质指标如表11所示.
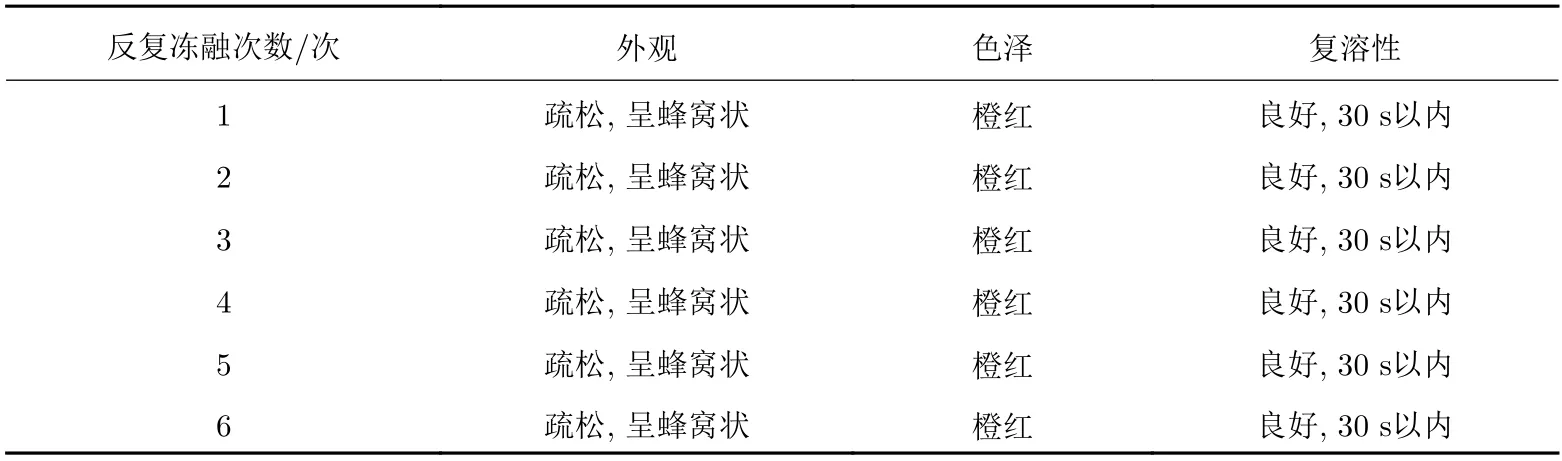
表 11 反复冻融对慢病毒冻干制剂保存效果的影响Tab. 11 Effects of repeated freeze-thaw cycles on the preservation of freeze-drying preparations
2.5.2.2 反复冻融对慢病毒冻干制剂生物滴度的影响
使用QPCR检测慢病毒载体冻干制剂和冻存制品的生物滴度(IU/mL), 结果可参见图5.
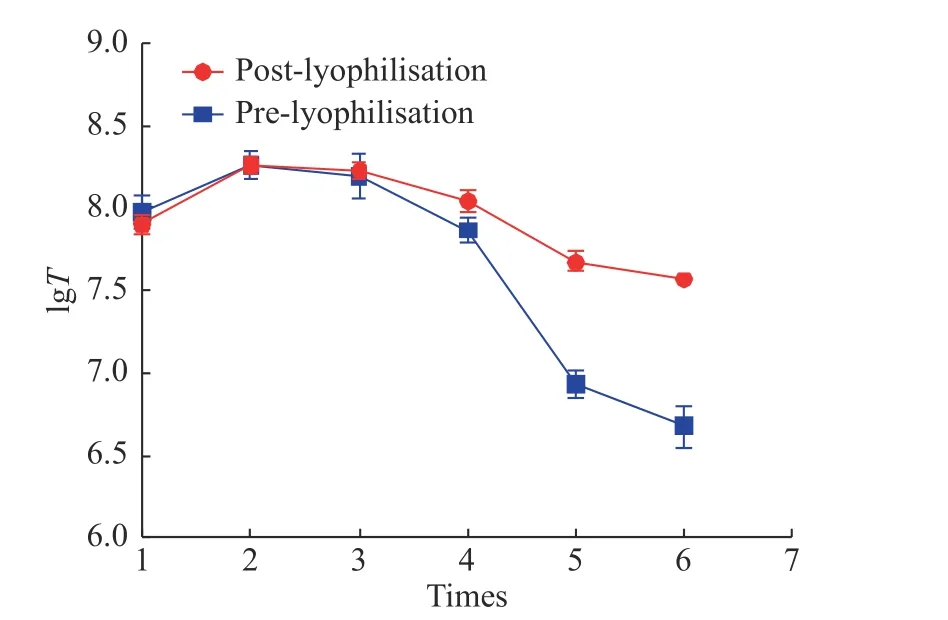
图 5 反复冻融对于慢病毒滴度的影响Fig. 5 Effects of repeated freezing−thawing cycles on the titer of lentiviral vectors
从图5可以看出反复冻融对于慢病毒载体冻干制剂的影响并不明显, 随着反复冻融次数的增加,慢病毒滴度能维持稳定, 然而对于慢病毒载体冻存制剂而言, 反复冻融的影响显著, 尤其在第5次反复冻融时, 慢病毒活性显著降低, 表明慢病毒冻干制剂在反复冻融的条件下更加稳定, 可以实现反复冻融5–6次, 克服了液体制剂反复冻融带来的损失等问题.
3 结 论
本文给出了一种新型的慢病毒载体冻干制剂的制备方法. 通过研究冻干保护剂的组分筛选与优化、冻干产品的制剂学研究和稳定性研究, 表明真空冷冻干燥的方法对于慢病毒载体的储存带来了新的突破. 在最优冻干保护剂处方的条件下, 慢病毒载体冻干制剂能够实现储存时间长、运输过程简便、稳定性提高的优点, 为CAR−T细胞的大批量制备夯实了基础, 为CAR−T细胞免疫治疗的进一步推广提供了技术基础.
