按压对大鼠肌筋膜激痛点软组织张力的影响及其作用机制研究*
2021-06-03蒋全睿匡小霞江玉婷李江山
蒋全睿 吴 琼 匡小霞 危 威 江玉婷 袁 媛 李 武△ 李江山△
(1 湖南中医药大学针灸推拿学院,长沙 410208;2 南华大学附属第二医院中医科,衡阳421000)
肌筋膜激痛点 (myofascial trigger point, MTrP) 可导致多个感觉、运动和自主神经症状,其临床体征和症状包括肌肉紧张带、压痛敏感点、牵涉痛、活动障碍、感觉异常和自主神经症状等,还可能伴有失眠、乏力、情绪障碍等症状[1]。在颈部或肩部疾病病人中,激痛点的检出率较高[2],临床病人中激痛点检出率可高达90%[3],病人生活质量差,疼痛程度、抑郁状态、睡眠质量均为影响其生活质量的重要因素,导致了大量医疗资源和社会资源的占用[4]。
物理治疗为解除激痛点的主要治疗方法,可有效灭活激痛点缓解疼痛。例如缺血性按压、推拿按法等手法刺激是临床缓解激痛点疼痛常用的方法[5],但是按压的效应机制尚不明确。目前认为激痛点的病理与运动终板功能异常、乙酰胆碱 (acetylcholine,Ach) 堆积、局部循环与能量代谢障碍、中枢敏化等多个环节有关[6,7],ACh 堆积和细胞内Ca2+浓度增高是导致肌节挛缩形成激痛点的重要因素,而二氢吡啶受体 (dihydropyridine receptor, DHPR) 和利若丁受体 (ryanodine receptor, RyR)可以调节胞内Ca2+浓度进而影响肌肉收缩和舒张过程[8]。那么,按压对激痛点的影响是否与调节DHPR、RyR、Ca2+和ACh 水平有关呢?本研究拟观察大鼠激痛点软组织张力、DHPR、RyR、乙酰胆碱酯酶 (acetylcholineesterase, AChE)、游离Ca2+、降钙素基因相关肽 (calcitonin gene-related peptide, CGRP) 和P 物质水平,并与阳性对照注射利多卡因组进行比较,探索按压对大鼠激痛点软组织张力的影响及其可能的机制。
方 法
1.动物与分组
健康成年雄性SD 大鼠,由湖南中医药大学动物实验中心提供,SPF 级,许可证号:scxk(湘)2019-0009,体重250~280 g,每笼3 只,饲养于湖南中医药大学动物中心实验室,饲养环境温度24~26℃,湿度50%~70%,12 h 光照交替明暗循环。实验过程中食物和饮用水按需提供。涉及动物及其管理的实验方案经湖南中医药大学动物管理与使用委员会批准和执行。采用随机数字表法将48 只SD大鼠随机分为4 组,空白组(不予任何处理,正常饲养)、模型组(造模处理,不进行任何干预治疗)、利多卡因组(造模处理 + 局部注射利多卡因治疗)和按压组(造模处理 + 局部按压治疗),每组12 只。
2. 造模方法
参考黄强民等[9]改良并证实的离心运动结合钝性打击造模方法,造模分为处理期8 周和恢复期4周。参与造模的大鼠在造模前需适应性饲养7 天以适应环境减少应激反应。在此期间,大鼠在实验跑台内进行实验前适应跑台训练:设置坡度0°,速度每分钟16 m,每次 15 min,2 天1 次,共3 次。
处理期每周第1 天进行钝性打击:采用异氟烷麻醉大鼠,然后将大鼠仰卧位固定于打击器底端,由一位有经验的临床医师对大鼠进行左侧股内侧肌肌腹位置触诊并标记。打击器的钝性木棒从约20 cm 高度处落下,打击标记位置。第2 天进行离心跑台运动:设置坡度-16°,速度每分钟16 m,每次90 min,每周1 次,共8 次。并通过机械和声音刺激驱赶大鼠,保证其完成90 min 的离心运动。其余时间正常喂养,不作任何干预。恢复期共计4 周,不进行任何干预,每天正常喂养。
造模评价标准:触诊和肌电图检查。大鼠异氟烷呼吸麻醉后仰卧位固定在操作台上。一位经验丰富的临床医师用拇指或示指的指腹在左侧股内侧肌上进行触摸,触及肌肉收缩结节或紧张带,用指甲刮弹可诱发局部抽搐,将其标记,并认定为激痛点区域。在激痛点区域(空白组在股内侧肌中部)插入记录电极,在右侧股内侧肌中部插入参考电极,记录肌电图1 min(MP150, BIOPAC Systems, Inc, 北京)。参与造模大鼠触诊和肌电图出现特征性变化(触诊可触及肌肉紧张带或收缩结节,指甲刮弹可诱发局部抽搐,肌电图可见低振幅、噪声样的自发电活动和间歇性高振幅棘波)视为造模成功[10],否则排除不纳入实验组。
3. 干预方法
(1)空白组:不造模且不进行干预,仅正常饲养;(2)模型组:造模后不进行干预;(3)利多卡因组:模型制备后对大腿激痛点局部注射利多卡因溶液(大腿内侧碘伏涂抹,用 1 ml 注射器向激痛点内注射 1%利多卡因0.5 ml ,6 天1 次,治疗3 次,治疗的时间点为造模后第1、7、13 天);(4)按压组:模型制备后对大腿激痛点局部进行按压治疗,异氟烷呼吸麻醉并维持麻醉,仰卧位固定,选用自制的按压刺激仪器(专利申请号 201720875963.5)对激痛点紧张带的区域进行按压操作,按压参数参考前期实验[11]:力量设置0.7 kg,方向垂直向下,每次按压持续时间6 s,按压隔天1 次,每次 7.5 min,治疗7 次,治疗的时间点为造模后第 1、3、5、7、9、11、13 天。
4. 指标评估
(1)软组织张力检查:所有大鼠在造模后和干预后进行软组织张力检查:大鼠异氟烷呼吸麻醉后仰卧位固定在操作台上,一位经验丰富的临床医师用拇指或示指指腹在左侧股内侧肌激痛点标记处进行触摸,触到肌肉收缩结节或诱发局部抽搐将其认定为可能的激痛点。以软组织张力测定仪(JZL-III型,天津明通世纪科技有限公司,天津)测定激痛点软组织张力:调试仪器,将检测头对准标记的激痛点区域,垂直均匀用力按压,按压需要约3 s,然后均匀撤力,需要约3 s。检测系统自动记录加载和卸载时的力量-位移曲线,进行数据分析。参照仪器说明书和本课题组前期研究,取曲线中0.2 kg对应位移D0.2kg作为观察指标可以较好地反应大鼠肌肉软组织张力情况。
(2)Western Blot 检测组织中DHPRα1、RyR和AChE 含量:最后一次软组织张力检查后,处死大鼠取激痛点局部样本。取组织样本充分剪碎,加入裂解液(20 mg:200 μl)均浆裂解。1 2000 r/min 离心15 min,取上清液,用BCA 进行蛋白定量。根据蛋白定量结果加入适量缓冲液,沸水浴10 min 后离心取上清上样,每孔加20 μg 上样液或10 μg 预染Marker。分离胶120 V,50 min,当染料到达胶底部时终止电泳,采用湿转转膜,三明治的排列为:滤纸/胶/膜/滤纸。膜的封闭及抗体孵育:5%脱脂奶粉封闭,4℃过夜;一抗:抗体加入封闭液中稀释到目标浓度,室温孵育1 h;二抗:按照1:1 0000比例稀释HRP 标记的二抗,室温孵育1 h。每次抗体孵育后用PBST 洗涤3 次,每次5 min。将膜放置在暗室中,取适量 ECL 发光液A 与B 等量混匀均匀滴加。然后置于自动化学发光分析仪检测,以TANON GIS 软件读取相关条带灰度值并利用目的蛋白/β-actin 求得蛋白相对表达量。
(3)免疫组化法检测P 物质和降钙素基因相关肽含量:样本常规固定包埋切片脱蜡至水。3%H2O2室温孵育10 min。水洗后加入0.01 M 柠檬酸盐缓冲液 (pH6.0),在微波炉中处理10 min,降至室温后用PBS 冲洗。滴加5%BSA 封固,37℃孵育30 min 倾去血清。载玻片滴加一抗,兔抗SP (1:500; abcam)或兔抗CGRP (1:200; abcam) 孵育过夜(4℃),PBS冲洗。然后滴加适量生物素标记二抗,37℃孵育30 min,PBS 冲洗3 次。滴加SABC,37℃反应30 min,PBS 冲洗。滴加DAB 试剂,室温下显色,显微镜下控制反应时间10 min,用水洗涤。苏木精复染,脱水、透明,封片。
光学显微镜下观察使用HALO 分析软件进行分析:设置好切片组织区域。应用Indica Labs-Multiplex IHC 模块设置Stain1 为蓝色阴性细胞,Stain2为以核为中心识别棕黄色阳性细胞。设置完成后自动识别组织切片上测量区域内所有的阴性细胞以及阳性细胞数,求出阳性细胞百分比(阳性细胞数/总细胞数×100%)即为阳性率(%)。以阳性率为组织表达水平的定量指标。
(4)比色法检测Ca2+含量:取样匀浆离心后提取上清液,保存于-80℃超低温冰箱中待测,用钙测试盒按说明书步骤,以甲基百里香酚蓝比色法检测Ca2+含量。
5. 统计学分析
本实验数据采用SPSS 21.0 for windows 软件进行统计学分析,计量资料以平均数±标准差 (±SD)表示,用单因素方差分析分析,方差齐时以LSD 法和SNK-q 法多重比较,方差不齐时用Dunnett T3 检验。以P < 0.05 为差异具有统计学意义。
结 果
1.激痛点造模情况
表1 所示为激痛点造模完成情况,在触诊以及肌电图检查期间,空白组大鼠因麻醉意外死亡4 只;模型组大鼠触诊和肌电图检查均为阳性(出现特征性变化);利多卡因组2 只大鼠触诊和肌电图均为阴性,排除;按压组1 只大鼠触诊和肌电图均为阴性,排除。最终纳入实验的大鼠为空白组8 只,模型组12 只,利多卡因组10 只,按压组11 只。
2. 大鼠激痛点软组织张力检查
表2 所示为:①干预前:与空白组相比,模型组、利多卡因组和按压组在0.2 kg 下位移D0.2kg均降低(P < 0.05),提示造模后大鼠激痛点软组织张力升高;②干预后:与干预前相比,利多卡因组和按压组D0.2kg升高(P < 0.05);与模型组相比,利多卡因组和按压组D0.2kg升高,提示经过利多卡因注射或按压干预,大鼠激痛点软组织张力降低;③干预前后差值比较:利多卡因组和按压组干预前后D0.2kg差值高于模型组(P < 0.05),但利多卡因组和按压组相比,差异无统计学意义,提示注射利多卡因和按压对改善大鼠激痛点软组织张力效果无明显差异。
表2 各组大鼠软组织张力D0.2kg 比较 (mm,±SD)Table 2 Comparison of soft tissue tension D0.2kg in each group (mm,±SD)
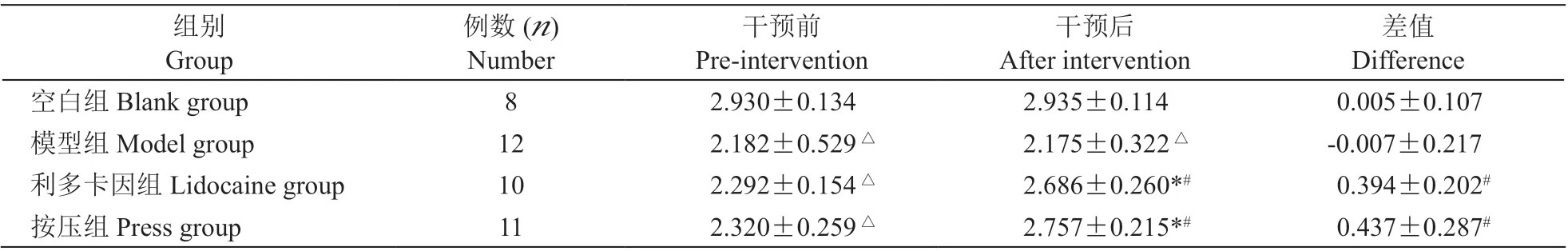
表2 各组大鼠软组织张力D0.2kg 比较 (mm,±SD)Table 2 Comparison of soft tissue tension D0.2kg in each group (mm,±SD)
△P < 0.05,与空白组相比;#P < 0.05,与模型组相比;*P < 0.05,与干预前相比;△P < 0.05, compared with the group blank; #P < 0.05,compared with the group model; *P < 0.05, compared with pre-intervention.
组别Group例数(n)Number干预前Pre-intervention干预后After intervention差值Difference空白组Blank group 8 2.930±0.134 2.935±0.114 0.005±0.107模型组Model group 12 2.182±0.529△ 2.175±0.322△ -0.007±0.217利多卡因组Lidocaine group 10 2.292±0.154△ 2.686±0.260*# 0.394±0.202#按压组Press group 11 2.320±0.259△ 2.757±0.215*# 0.437±0.287#
3.大鼠激痛点DHPRα1、RyR 和AChE 含量
与空白组相比,模型组DHPRα1、RyR 和AChE含量降低(P < 0.05);与模型组相比,利多卡因组和按压组DHPRα1、RyR 及AChE 含量升高(P < 0.05);利多卡因组和按压组相比,DHPRα1、RyR 及AChE含量差异无统计学意义。以上提示造模后大鼠激痛点DHPRα1 和RyR 含量降低,干预后升高(见图1)。
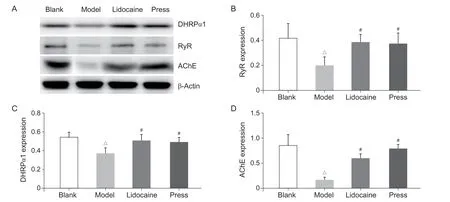
图1 各组大鼠激痛点组织RyR、DHPRα1 和AChE 相对表达值(A) WB蛋白印迹;(B)各组RyR表达量;(C)各组DHPRα1 表达量;(D) 各组AChE 表达量△P <0.05,与空白组相比;#P<0.05,与模型组相比Fig. 1 The expression of RyR, DHPRα1, and AChE in the MTrP tissues(A) Western blot bands; (B) RyR expression in each group; (C) DHPRα1 expression in each group; (D) AChE expression ineachgroup.△P <0.05,compared with the group blank; #P < 0.05, compared with the group model.
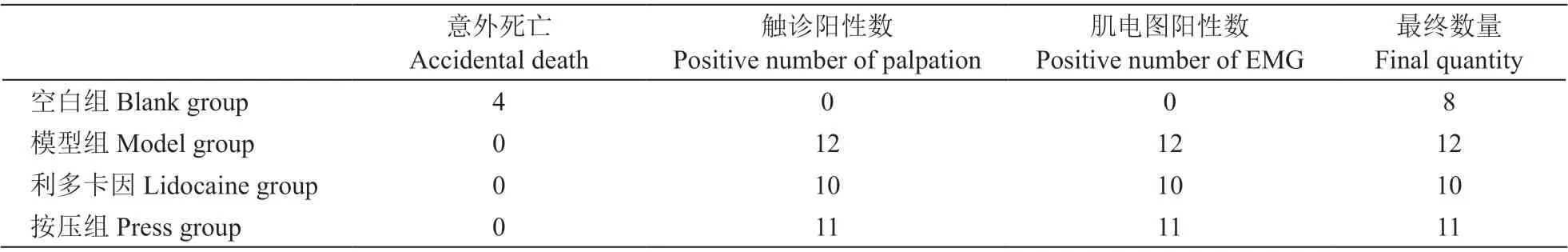
表1 各组大鼠造模阶段后触诊、肌电图情况比较(n = 12)Table 1 Comparison of palpation and electromyography in each group after modeling stage (n = 12)
4. 大鼠激痛点Ca2+含量
与空白组相比,模型组Ca2+含量增加(P < 0.05);与模型组相比,利多卡因组和按压组Ca2+含量减少(P < 0.05);利多卡因组和按压组相比,Ca2+含量无统计学差异。以上提示激痛点组织局部Ca2+含量上升,干预后下降(见图2)。
5. 大鼠激痛点P 物质和CGRP 表达情况
与空白组相比,模型组P 物质与CGRP 阳性细胞率增加(P < 0.05);与模型组相比,利多卡因组和按压组P 物质与CGRP 阳性细胞率减少(P < 0.05);利多卡因组和按压组相比,P 物质与CGRP 阳性细胞率无统计学差异。以上提示激痛点组织局部P 物质与CGRP 高表达,干预后下降(见图3、4)。
讨 论
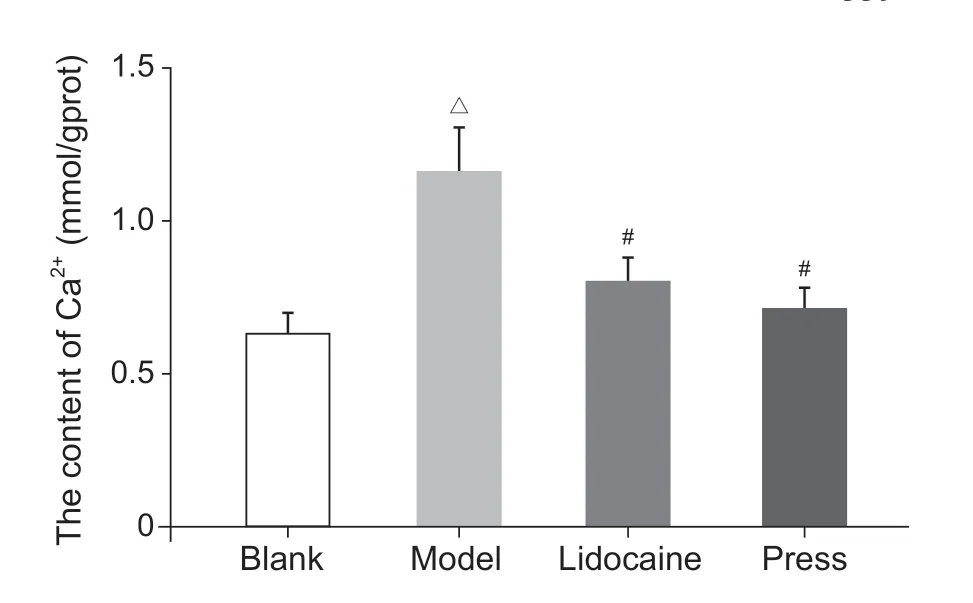
图2 各组大鼠激痛点组织Ca2+含量△P < 0.05,与空白组相比;#P < 0.05,与模型组相比Fig. 2 The content of Ca2+ in the MTrP tissue△P < 0.05, compared with the blank group; #P < 0.05,compared with the group model.
大量临床报道证实,激痛点注射可用于治疗多种以疼痛为特征的肌肉、骨骼和神经疾病[12]。研究表明,利多卡因能够改善骨骼肌的缺血-再灌注损伤,其机制与调控Ca2+通道降低胞内Ca2+浓度、减轻炎性反应和氧自由基等有关[13],因此本实验选择激痛点局部注射利多卡因作为阳性对照,实验中观察到大鼠慢性激痛点造模后,激痛点局部软组织张力增加,P 物质与CGRP 含量增高,AChE 含量降低,DHPRα1 与RyR 含量降低,游离Ca2+含量增加,提示激痛点局部肌节挛缩可能由AChE 降低,DHPRα1 与RyR 功能受损导致;注射利多卡因和按压均有改善这些病理状态的作用(P < 0.05),且两者无显著性差异(P > 0.05),表明本实验采用按压刺激器进行按压干预对激痛点的影响与阳性对照利多卡因注射相似。
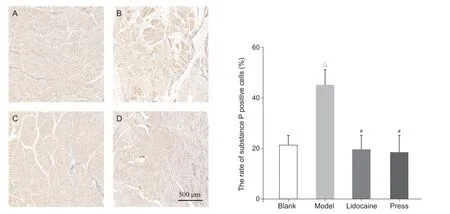
图3 各组大鼠激痛点组织P 物质免疫组化检测(A) 空白组;(B) 模型组;(C) 利多卡因组;(D) 按压组△P < 0.05,与空白组相比;#P < 0.05,与模型组相比Fig. 3 The percentage of substance P positive cells in the MTrP tissue(A) Blank group; (B) Model group; (C) Lidocaine group; (D) Press group△ P < 0.05, compared with the group blank; #P < 0.05, compared with the group model.
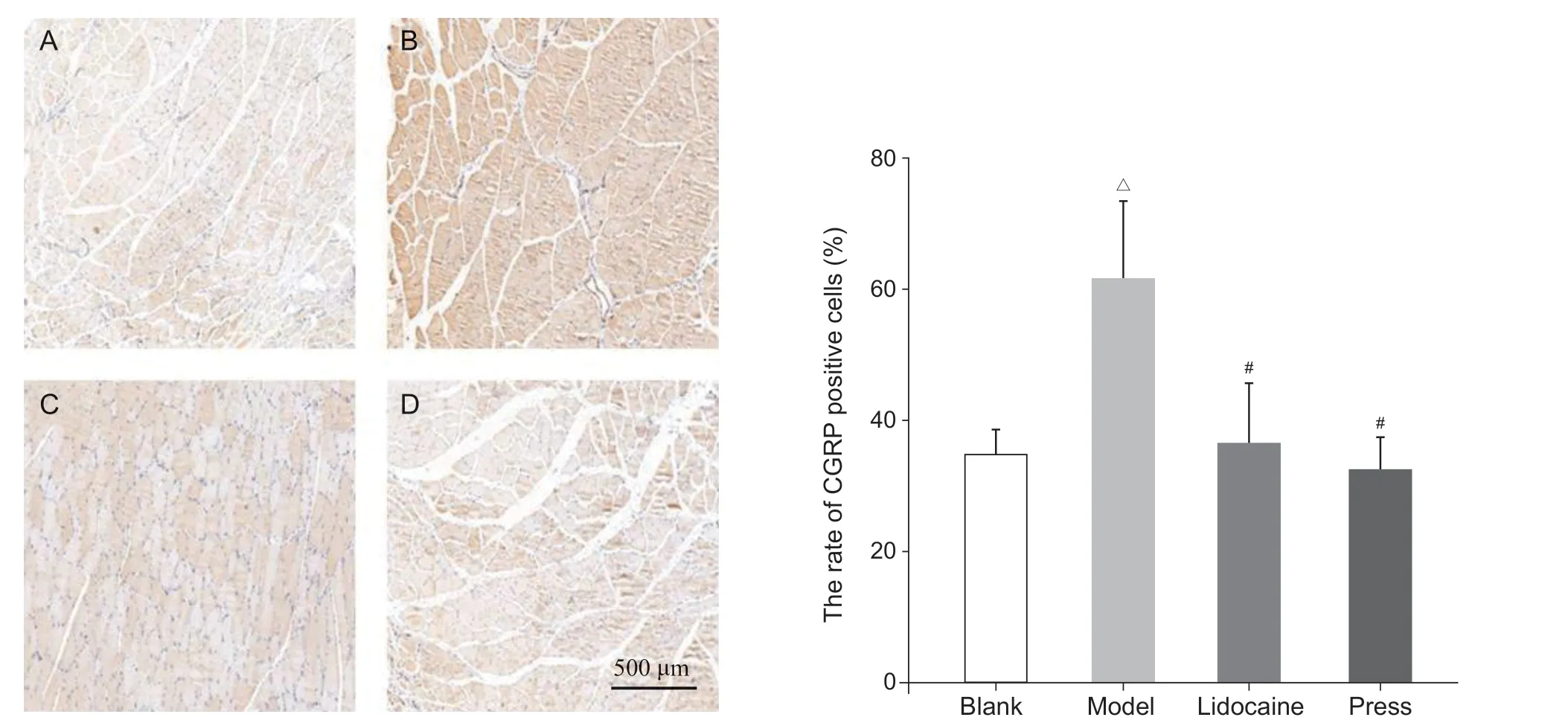
图4 各组大鼠激痛点组织CGRP 免疫组化检测(A) 空白组;(B) 模型组;(C) 利多卡因组;(D) 按压组△P < 0.05,与空白组相比;#P < 0.05,与模型组相比Fig. 4 The percentage of substance P and CGRP positive cells in the MTrP tissue(A) Blank group; (B) Model group; (C) Lidocaine group; (D) Press group△P < 0.05, compared with the group blank; #P < 0.05, compared with the group model.
根据激痛点形成机制的“综合学说”[14],急慢性损伤导致运动终板功能异常,ACh 过度释放,肌纤维膜去极化诱发肌质网Ca2+释放。胞浆内高水平的Ca2+导致肌节持续痉挛、压迫血管、局部微循环障碍、供血供氧减少,最终导致局部能量危机。肌浆网缺少ATP 重吸收Ca2+从而维持高水平Ca2+含量。大量致痛物质释放刺激神经末梢产生疼痛。此外,激痛点组织缺氧,细胞液pH 酸化,促使CGRP 释放,进而促使ACh 大量释放并且抑制AChE,使ACh 大量堆积[15]。因此,ACh 异常增加和胞内Ca2+增高是激痛点产生的关键环节之一。肌肉收缩时,神经肌肉接头负责将神经冲动传递给骨骼肌。当动作电位到达运动神经元的突触前末端时,ACh 从末梢释放到突触间隙并扩散到后膜,与其受体结合使肌肉纤维去极化[16]。AChE 能水解ACh,阻止对突触后膜的兴奋作用,因此可以间接体现ACh 含量。本研究中,模型组CGRP 水平升高,AChE 水平降低,P 物质水平升高,而按压组或注射利多卡因组CGRP 水平降低,AChE 水平提高,P 物质水平降低,这表明按压对激痛点的效应机制可能与调节CGRP、AChE 和P 物质水平进而影响ACh 异常释放有关。
激痛点形态学上表现的紧张肌带是由肌纤维收缩形成[17]。肌浆网的DHPR 与RyR 是兴奋收缩耦联的基础:DHPR 与RyR 耦联,在感受到膜表面或T 小管去极化时,DHPR 电压感受器激活RyR,Ca2+通道开放,导致肌浆网上的Ca2+从终池内大量释放,此过程称为去极化诱导钙释放 (depolariza-tion-induced-calcium-release, DICR)。 非 耦 联 的RyR 通道被胞内Ca2+信号激活通过钙诱导钙释放(calcium-induced-calcium-release, CICR) 途径放大DHPR 和RyR 作用产生的DICR。胞内Ca2+释放致肌肉肌纤维的持续性收缩。临床上对激痛点位置进行缺血性按压可以有效缓解疼痛[18]。细胞生物力学的研究表明[19,20],手法样刺激可以通过调节钙离子通道DHPR 与RyR 表达调节胞内Ca2+,再通过Ca2+信号转导发挥各种生物效应。本研究中,模型组DHPRα1 与RyR 水平下降,游离Ca2+水平上升,软组织张力提高,提示可能由于Ca2+释放通道DHPRα1/RyR 功能受损,游离Ca2+释放增加从而加剧肌纤维的收缩;在按压或注射利多卡因后,DHPRα1/RyR 水平上升,Ca2+水平下降,软组织张力降低,提示干预后可能DHPRα1/RyR 功能恢复,游离Ca2+减少,这表明按压对激痛点疗效的外周机制可能与调控DHPR/RyR 有关。
综上所述,本研究以慢性激痛点模型大鼠为研究对象,按压为干预手段,研究结果表明按压激痛点可以改善局部软组织张力,减少疼痛物质,其机制可能与调节P 物质、CGRP、AChE、DHPR与RyR、游离Ca2+水平等有关,但尚无法确定因果性,即按压通过DHPR/RyR 调控胞内Ca2+浓度从而促使激痛点挛缩节舒张,还是按压促使激痛点挛缩节舒张进而导致DHPR/RyR 恢复,未来还需要进一步的实验,加入DHPR/RyR 抑制剂和激动剂对照,以判断DHPR/RyR 是否为按压对激痛点作用的关键环节。
