鱼类肌间骨发育分子调控机制及遗传选育研究进展
2021-06-02王旭东聂春红高泽霞
王旭东 聂春红 高泽霞 ,
(1. 华中农业大学水产学院,农业农村部淡水生物繁育重点实验室/农业动物遗传育种与繁殖教育部重点实验室,武汉430070; 2. 长江经济带大宗水生生物产业绿色发展教育部工程研究中心,武汉 430070;3. 湖北省名优鱼育种与健康养殖工程技术研究中心,武汉 430070)
肌间骨, 俗称鱼刺, 是由肌膈中的肌腱骨化而来, 仅存在低等真骨鱼类中。我国是水产养殖大国,主要养殖大宗淡水鱼类, 即青鱼、草鱼、鲢、鳙、鲤、鲫和鲂[1], 都存在一定数量的肌间骨。肌间骨的存在不仅极大限制了其加工以及出口创汇, 而且也给食用这些鱼类的人们带来麻烦和一定的受伤风险。但因这些大宗淡水鱼类味道鲜美、养殖技术容易掌握及历史文化和传统消费习惯等因素, 使得大宗淡水鱼在我国水产养殖业中占据重要地位。据《2019中国渔业统计年鉴》统计, 2018年我国大宗淡水鱼产量占到了全国淡水养殖鱼类产量的66.45%[2]。因此, 对肌间骨的相关研究, 如肌间骨形成的分子机制的解析及培育无刺或少刺的大宗淡水鱼的育种技术也逐渐成为当前研究的热点。
长期以来, 人们对鱼类肌间骨的研究主要集中在形态和数目方面[3—8]。近期, 常永杰等[9]发现刀鲚(Coilia nasus)和短颌鲚(C. brachygnathus)背部上方和腹部下方有肌骨杆(Myorhabdoi)。国内对于肌骨杆的研究报道较少, 该发现对我国鱼类肌间骨类型研究做了进一步补充。Yang等[10]对12个亚科共592尾鲤科鱼类肌间骨的发生进行了系统进化研究,研究揭示了鲤科鱼类肌间骨的变异多样性, 且与其系统发育密切相关, 但又受到多种环境因素的影响,对肌间骨的发生演化做了进一步补充。
随着多学科的交叉融合, Fiedler等[11]研究了北大西洋鲱(Clupea harengus)肌间骨的微结构及相关属性, 采用机械拉伸试验、扫描电子显微镜法(Scanning electron microscopy, SEM)、宽角X射线散射法(Wide-angle X-ray scattering, WAXS)和micro-CT成像技术等方法评估了肌间骨组织矿物密度(Tissue Mineral Density, TMD)及肌间骨内部微观结构, 进而对北大西洋鲱大体形和小体形两个群体的肌间骨进行了比较分析。研究结果表明, 与其他类型的骨相比, 肌间骨具有十分特殊的刚度、强度和韧性。该研究为硬骨鱼类骨骼生物力学和微观结构特性提供了新的数据。
近年来, 随着生物技术的快速的发展, 研究人员开始关注肌间骨骨化模式[12—14]、肌间骨相关的分子调控机制和少/无刺鱼的培育等方面。何苹萍等[15]、Lü等[16]、Nie等[17,18]和Wan等[19,20]研究了肌间骨骨化过程的分子机制及一些关键基因的调控作用。在育种方面, Tang等[21]和Xiong等[22]分别评估了镜鲤(Cyprinus carpio var. specularis)和团头鲂(Megalobrama amblycephala)肌间骨的遗传力, 为开发无或少肌间骨的相关品种奠定了遗传学基础。徐晓峰等[23]和Perazza等[24]分别发现无肌间骨突变体草鱼(Ctenopharyngodon idella)和大盖巨脂鲤(Piaractus brachypomus), 为探索肌间骨发生的分子机制提供了重要的实验材料。因此, 本文综合整理了有关肌间骨的研究资料, 主要从肌间骨相关的分子机制及育种前景等方面进行了全面阐述。
1 肌间骨发育相关基因调控
1.1 BMP家族基因
骨形态发生蛋白(Bone Morphogenetic Protein,BMP)是1965年由Urist首次从成人骨组织中提取的一种活性蛋白质, 除了BMP-1外, 均属于转化生长因子-β(Transforming growth factor, TGF-β)超基因家族[25,26]。目前, BMP家族基因已经超过30种,Zhang等[27]据dCHIP分析将已发现的人类14种骨形态发生蛋白分为3种类型: BMP2、BMP4、BMP6、BMP7和BMP9属于成骨/成软骨/成脂类型, BMP5、BMP11、BMP12、BMP13、BMP14和BMP15属于肌腱发育类型, BMP3、BMP8和BMP10属于BMP3类型[27]。BMP具有诱导成骨的作用, 被认为是诱导骨形成及骨分化最早期的信号分子。BMP蛋白主要由单体形式通过二硫键结合形成二聚体[28]。BMP的同二聚体和异二聚体被报道能与有成骨潜能及未分化的间充质干细胞表面受体相互作用, 从而促进间充质干细胞分化[25,26]。BMP9被认为是诱导骨髓间充质干细胞成骨的最有效因子之一[29]。
Zhang等[30]运用qRT-PCR技术初步分析了9个bmp基因在团头鲂肌间骨4个发育关键时期中的表达, 结果表明: 在肌间骨形成的早期阶段,bmp3、bmp4、bmp5和bmp8a的表达量均上调。因此, 这些BMP家族基因可能参与刺激间充质细胞向肌间骨生长位点的迁移、聚集及成骨细胞的分化。在肌间骨快速发育时期, 只有bmp7b和bmp16表达急剧增加, 说明bmp7b和bmp16可能参与成骨细胞分化和肌间骨的发育成熟。在团头鲂肌间骨发育过程中, 表达量最高的bmp7bmRNA在肌间骨快速发育时期达到最高峰, 由此表明BMP-7b可能是肌间骨发育的强诱导因子, 用于诱导成骨细胞发育成熟。在肌间骨完全发育成熟的时期,bmp2a、bmp2b、bmp3、bmp4、bmp8a和bmp14相对于其他骨化时期的表达量显著增加, 推测这些基因对维持肌间骨结构等方面有重要作用。Yang等[31]对罗非鱼和团头鲂的bmp2a/b基因的研究表明,bmp2b主要在肌间骨、肋骨和鳍条等骨相关的组织表达, 而bmp2a主要在肌肉、脾和心脏等外周组织表达。由此说明,bmp2b可能与肌间骨的发生发育密切相关。Su和Dong[32]在转录和翻译水平比较分析了bmp4基因在鲤和罗非鱼的背部肌肉、腹部肌肉和尾部肌肉的表达情况, 结果表明bmp4基因在鲤背部和尾部肌肉这两处含有肌间骨的组织中高表达, 其他4个组织也有表达, 但表达量远远低于在鲤的背部和尾部肌肉中的表达量。通过对有无肌间骨鱼类和有无肌间骨组织的比较, 说明bmp4基因可能是调控肌间骨的重要基因。
1.2 肌腱发育相关基因
有研究认为肌间骨是由肌腱骨化而来的[33,34]。在肌腱发育过程中, Scleraxis(SCX)和Tenomodulin(TNMD)等作为肌腱发育的特异性转录因子受到广泛关注。SCX是一个含有碱性螺旋-环-螺旋(basic Helix-Loop-Helix, bHLH)的转录因子, 是肌腱祖细胞最早的标志, 在肌腱的发育成熟中起了重要的作用[35]。在哺乳动物中, Tomoya等[36]利用scx-GFP转基因小鼠研究了SCX在肌腱损伤后修复作用, 结果表明SCX是一个重要的加快修复损伤成熟肌腱的分子靶标。Shukunami等[37]应用TALEN介导基因编辑技术获得scx–/–小鼠表现出肌腱发育不良的表型。同时, Shukunami等[37]也发现SCX是tnmd基因的转录调控因子, 在scx–/–小鼠的肌腱和韧带中tnmd基因几乎不表达。TNMD是一种肌腱/韧带特异性标记物和抗血管生成分子, 属于II型跨膜糖蛋白, 含有高度保守的c-末端富含半胱氨酸的结构域[38,39]。Yin等[39]发现tnmd–/–小鼠的肌腱干细胞基因表达谱显著改变, 表现为细胞对I型胶原质黏附不足, 细胞外基质的收缩能力受损。
在硬骨鱼类的研究中, Nie等[40]通过Crispr/Cas9基因敲除技术分别获得了scxa–/–和scxb–/–斑马鱼突变体,scxa–/–斑马鱼与野生型斑马鱼相比背部肌间骨消失, 仅尾部含有少量肌间骨; 进一步通过转录组分析发现scxa–/–斑马鱼肌腱发育相关基因表达量均下调。而scxb–/–斑马鱼肌间骨表型与野生斑马鱼无异。该研究表明scxa基因可控制硬骨鱼类肌间骨的数量性状。陈宇龙等[41]研究了肌腱发育相关基因tnmd和xirp2a在团头鲂肌间骨不同发育时期的表达, 研究结果表明tnmd基因在团头鲂肌间骨快速发育时期表达量显著高于其他时期, 而xirp2a基因在肌间骨发育各个时期没有显著差异。该研究指出tnmd基因可能对肌间骨的发育具有一定的调控作用。
1.3 硬化蛋白基因
硬化蛋白(Sclerostin, SOST)是一种含有213个氨基酸的糖蛋白, 在骨细胞中特异性表达[42], 抑制成骨细胞的活动, 其主要作用是抑制Wnt/β-catenin通路, 从而抑制骨的形成。在sost基因敲降的小鼠中可以观察到高骨量的表型, 并且抗骨质流失[43]。硬化蛋白抗体能够刺激骨形成, 这为治疗骨质疏松提供了一种新的方法[44]。
硬化蛋白基因在硬骨鱼类肌间骨中的研究较少。杨敏璇等[45]利用分子生物技术体外克隆鲫(Carassius auratus)sost基因全长, 并构建原核表达载体, 体外表达硬化蛋白。结果表明, 随着时间的递增, 硬化蛋白表达量逐渐增大, 诱导时间为4h左右其表达量最高。该研究表明, 信号肽存在对sost基因的蛋白表达存在抑制影响。房连聪[46]对淇河鲫肌间骨发育时期的研究推测, SOST可能参与淇河鲫肌间骨骨化负调控, 对骨骼发育存在抑制作用。王良炎等[47]对淇河鲫成鱼不同肌间骨相邻肌组织的研究发现,sost在肌隔组织中大量表达且在淇河鲫背部肌肉中存在差异性表达。田雪等[48]以淇河鲫仔稚鱼为研究对象, 检测sost基因在肌间骨不同骨化阶段的mRNA和蛋白表达变化情况, 结果表明该基因在肌间骨完全成熟后表达量达到最高,推测sost基因与鲫的肌间骨生长有一定相关性。
1.4 其他基因
在脊椎动物中, 肌节同源盒(Muscle segment homeobox, MSX)在上皮-间充质的交互作用中发挥重要作用, 促进器官的形成[49]。Lü等[16]运用整胚原位杂交和qRT-PCR技术研究Msx-C在唇䱻(Hemibarbus labeo)肌间骨发生过程中的作用。Msx-C基因在唇䱻26—41 dph(Day post hatching)在肌膈中表达, 该基因与唇䱻肌间骨骨化过程(35—62 dph)一致, 表明Msx-C基因在唇䱻肌间骨形成过程中发挥重要作用。
TWIST是高度保守的碱性螺旋-环-螺旋(Basic helix-loop-helix, bHLH)家族中的转录因子, 参与中胚层衍生组织(包括骨骼)的发育[50]。脊椎动物有两种twist基因, 即twist1和twist2[51]。研究发现,twist1和twist2对小鼠骨骼的发育具有调控作用[52]。陈洁等[53]通过qPCR研究twist1和twist2在唇䱻肌间骨发育的4个关键时期的表达情况, 结果表明twist1表达量随肌间骨发育逐渐降低, 肌间骨快速发育和成熟时期twist1表达量与肌间骨未发育时期相比显著降低;twist2从肌间骨未发育时期到肌间骨快速发育时期表达量并未发生显著变化, 到肌间骨完全成熟时期其表达量才显著降低。这表明twist1/2基因的表达与肌间骨骨化存在一定的相关性。
当前, 对于鱼类骨骼发育的研究还比较缺乏,研究进展情况落后于在人类和哺乳动物的相关研究。同时, 鱼类相对于人类和哺乳动物的进化地位低, 相同基因在进化过程中其功能可能会发生相应的改变。而且在活体水平的基因编辑会或多或少的受到补偿效应的作用, 从而对表型观察等产生影响。综合来看, 鱼类肌间骨发育相关基因仍有待挖掘和探索。
2 肌间骨相关组学分析
目前, 大多数肌间骨的研究主要是集中在个体发生发育的形态学分析, 对肌间骨发育分子调控方面的研究相对较少。近些年, 随着高通量测序技术和分子技术的发展, 越来越多的研究人员开始运用组学技术和分子技术揭示肌间骨发生发育的分子机制(表 1)。
2.1 转录组
基于高通量测序技术, Wan等[19]首次比较分析了6月龄团头鲂肌间骨(IBs)和包含肌间骨的结缔组织(CT)的miRNA分子特征, 获得218个已知miRNA基因的序列和相应表达水平。结果表明MiR-206是成骨细胞分化的关键调控因子, 对成骨细胞分化起到抑制作用。通过stem-loop实时荧光定量对11个差异表达miRNA在9个组织上进行验证, 结果表明mam-miR-221、mam-miR-222a、mam-miR-92a和mam-miR-26a在肌间骨和含肌间骨的结缔组织中表达量相对较高, 说明其在肌间骨发育中发挥一定作用。
随后, Wan等[20]比较分析了团头鲂肌间骨发育关键时期(S1. 肌间骨未发生; S2. 肌间骨初步发生;S3. 肌间骨快速发育; S4. 肌间骨发育完全)mRNA和miRNA的分子特征, 并对二者进行整合分析。结果表明TGF-β信号通路与MAPK信号通路、ERK信号通路互作, 调节成骨细胞分化。在团头鲂肌间骨4个发育关键时期中, 有22个miRNA持续上调和18个miRNA持续下调。通过整合分析发现一定数量的与肌间骨形成有关的mRNA-miRNA互作对,在细胞水平验证了miR-133对靶基因Tgfbr1a的调控作用。
何苹萍等[15]对禾花鲤(C. carpio var. Quanzhounensis)和建鲤(C. carpio var.Jian)肌间骨进行miRNA的高通量测序, 据差异表达结果推测, 肌间骨的发育可能是通过下调促进成骨miRNA的表达量及上调抑制成骨miRNA的表达量来抑制成骨过程, 从而维持禾花鲤肌间骨细小及柔软的特性。Peng等[54]比较分析禾花鲤和建鲤肌间骨mRNA和microRNA转录组数据发现7个差异表达基因和12个差异表达miRNA参与禾花鲤骨矿化调控过程。随着团头鲂全基因组测序的完成, Liu等[55]对3种关键组织(肌间骨、肌间骨外周结缔组织和背部白肌)进行了基因差异表达分析, 进一步确认了所观察到的基因表达差异确实与肌间骨的形成和功能有关。
2.2 蛋白组
Nie等[17]通过iTRAQ LC-MS/MS蛋白组学定量分析技术构建了鱼类肌间骨和肋骨的第一张蛋白组图谱。经蛋白组学分析发现, 一龄团头鲂肌间骨和肋骨之间的93个差异表达蛋白造成一龄团头鲂肌间骨和肋骨的化学组成差异, 二龄团头鲂肌间骨和肋骨间存在154个差异表达蛋白造成上述2种骨间的化学组成差异; 与破骨细胞分化相关的玻连蛋白b前体和金属蛋白酶2在肋骨中显著上调表达; 在团头鲂的不同年龄阶段(一龄、二龄)发现13个肌间骨发育相关候选蛋白和11个肋骨发育相关候选蛋白。通过KEGG分析在235个通路中共定位了2023个蛋白, 其中在肌间骨发育相关信号通路, 如MAPK信号通路、钙离子信号通路、TGF-β信号通路、Wnt信号通路及破骨细胞分化途径分别鉴定出60、41、20、17和11种蛋白。通过GO注释分析,HCM信号通路为差异表达蛋白最多的通路。在肋骨和肌间骨中共同表达45个蛋白, 仅有LAMA2表达上调, 其余44种蛋白表达下调。基于蛋白组数据,Nie等[17]对ECM、MAPK、GnRH及钙离子通路中蛋白的表达模式进行分析。在ECM信号通路中链状胶原蛋白a1(V)等18个蛋白在一龄团头鲂肋骨组织中高表达; 肌腱蛋白样蛋白、层黏连蛋白亚基a-2和tnc蛋白在一龄团头鲂肌间骨中的表达量最高。
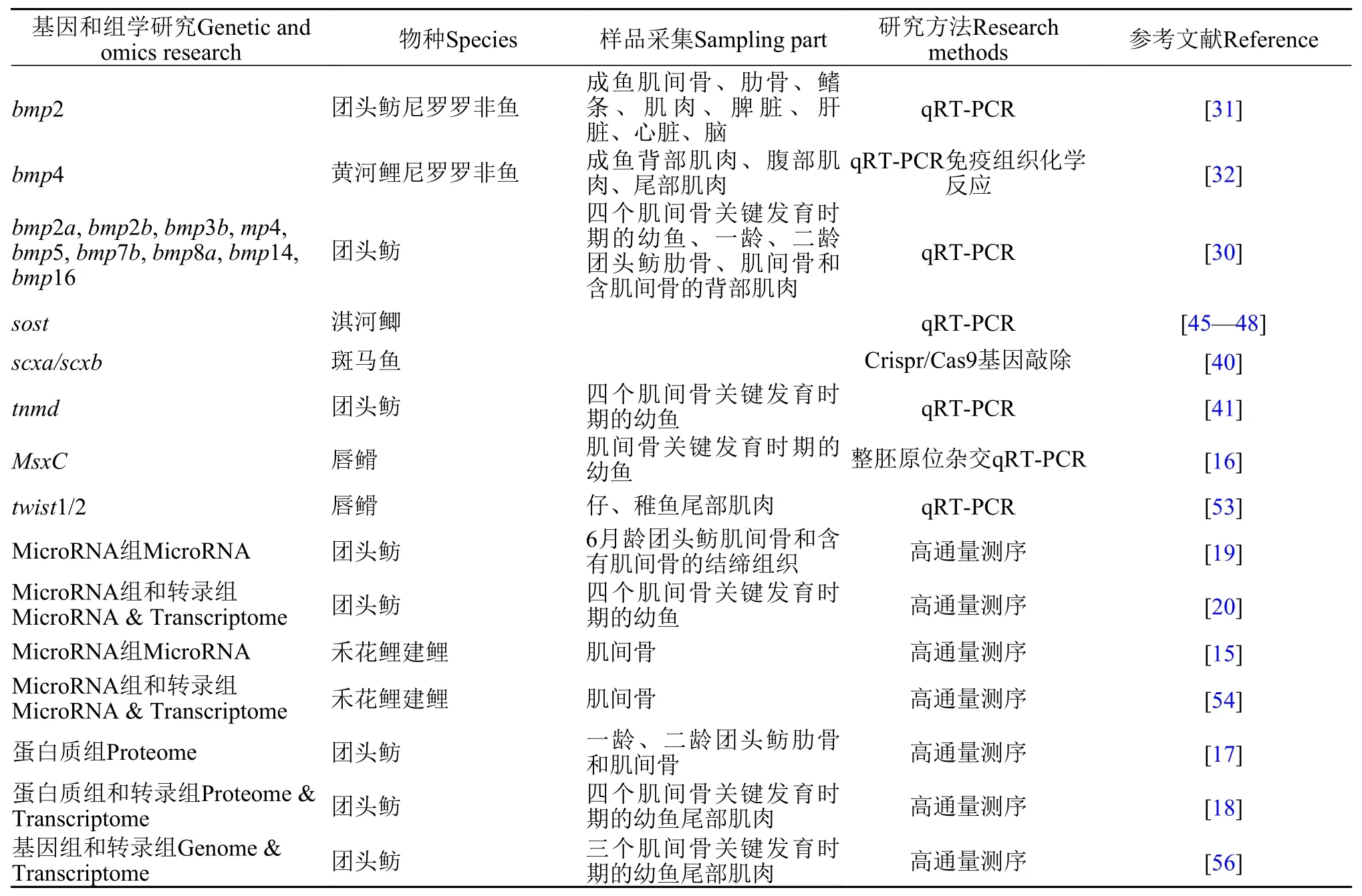
表 1 低等硬骨鱼类肌间骨相关基因和组学研究Tab. 1 Summary of studies on genes or omics related to intermuscular bone in lower teleosts
2.3 多组学整合分析
在肌间骨的组织结构和成分研究方面, Nie等[17]通过HE染色切片法比较分析了一龄和二龄团头鲂肌间骨和肋骨, 切片结果表明两种骨组织均含有三种典型的骨形成细胞, 即破骨细胞、成骨细胞和骨细胞, 但在一龄和二龄团头鲂肋骨中均发现一个富含破骨细胞的骨腔, 而肌间骨不存在类似骨腔。通过使用阿利新蓝染色(用于软骨细胞染色)和茜素红染色(用于组织钙盐反应)等不同的染色方法分析,Nie等[18]对团头鲂肌间骨发育关键时期的个体进行整体染色观察的研究, 结果表明肌间骨矿化从S2时期开始, S2到S4时期钙沉积量持续增加; 但在肌间骨发育过程中无软骨细胞形成, 表明肌间骨的骨化方式为膜内骨化。随后, Nie等[18]综合了组织学、转录组和蛋白组数据全面分析了肌间骨的骨化模式, 通过同位素标记相对和绝对定量(isobaric tags for relative and absolute quantification, iTRAQ)技术鉴定得到3368个蛋白, 功能注释表明MARK信号通路和钙离子信号通路是骨发生过程中的主要信号通路。经蛋白组学和定量表达分析发现, 软骨细胞相关蛋白(COLLAGEN9A1、STAT1和TNC)在肌间骨发育过程中的表达量无显著差异, 而与成骨细胞和骨形成相关蛋白(ENTPD5、CASQ1A、PVALB、ANXA2A和ANXA5)表达量在不同发育时期间具有显著的差异性, 从蛋白组学的角度进一步验证了肌间骨骨化不经历软骨阶段的观点。
Chen等[56]通过全基因组和转录组综合分析, 获得了MAPK信号通路、钙离子信号通路、ECM受体互作及Notch信号通路等团头鲂肌间骨发育相关信号通路, 尤其是ECM受体互作和Notch信号通路在全基因组和转录组两种分析中均得到富集。随后在转录水平验证了以上通路中的相关基因(itgal、itga6a、lamb1b、col6a3、dvl1a和oser1), 结果表明这些基因均在团头鲂肌间骨发育S3时期比S1时期显著高表达, 与转录组水平相同。
近期, 基于在大盖巨脂鲤养殖群体中发现了缺失肌间骨的个体[24], 研究团队对突变体进行了全基因组关联分析[57], 筛选到了13个与减少骨量、促进骨形成、抑制骨吸收和骨矿化等相关功能相关的基因, 包括actn3b、adamtsl2、atp6v0a1a、atp6v0ca、dchs1b、ebf3a、efnb1、nmu、ntn4、pde4d、plek、wisp1b和xpr1b。
基于鱼类肌间骨相关组学和基因表达信息, 总结出从肌腱源干细胞-成骨细胞前体细胞-成骨细胞-肌间骨形成过程中发挥一定作用的通路及相关基因(图 1), 为进一步探讨鱼类肌间骨发育的机制提供了分子基础信息。
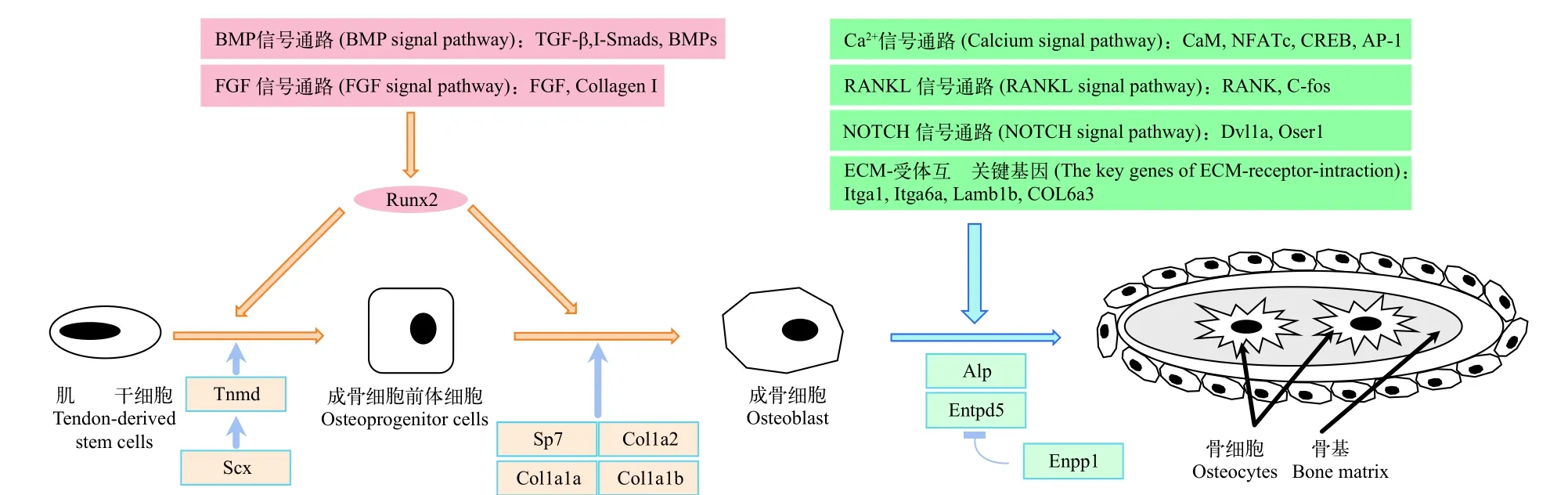
图 1 硬骨鱼类肌间骨发育相关分子机制Fig. 1 The molecular mechanism related to intermuscular bone in teleosts
3 肌间骨性状的遗传选育
目前, 国内大宗淡水鱼类及印度、巴西等国家主要养殖的鱼类品种均含有肌间骨, 对鱼类经济效益和食用安全产生了一定的影响。一些研究学者致力于运用育种手段来减少或去除鱼类肌间骨, 已取得一些明显的进展[58](表 2)。
3.1 选择育种
自20世纪70、80年代起, 以群体选育和家系选育为主的选择育种已广泛应用于水生生物的遗传改良工作中[59], 而研究人员对减少肌间骨数量方法探究开始于1967年[60]。虽然这些方法探究没有获得少肌间骨鱼类品种[58], 但许多研究发现在鲤科鱼类中肌间骨数量存在显著的遗传变异现象[60,61], 这种遗传变异现象表明选择育种可应用于减少肌间骨数量的相关研究[58]。
近些年, Cao等[62]对镜鲤、柏氏鲤(C. pellegrini)与黑龙江鲤(C. carpio)的杂交鲤、荷包鲤的耐寒品系等3种鱼的肌间骨数量和形态变异情况进行比较分析, 与其他两种鱼相比, 镜鲤肌间骨的数量最少, 变异系数也较高。结果表明镜鲤是一种可用于选择育种减少肌间骨的材料, 并且认为通过选择育种可以有效减少鱼体后部肌间骨数量。Tang等[21]首次对镜鲤肌间骨进行遗传力和数量性状位点(Quantitative Trait Loci, QTLs)分析, 结果表明镜鲤肌间骨数量为中等遗传力性状并发现8个肌间骨QTLs和29个肌间骨相关的候选基因。该研究为鲤肌间骨分子机制的深入研究提供了资料。Xiong等[22]研究表明团头鲂整体肌间骨数量变异系数为6.98%, 而脉弓小骨数量变异系数高达13.63%,显著高于髓弓小骨数量的变异系数(6.60%)。对83个全同胞家系团头鲂的肌间骨数量遗传力进行评估显示, 髓弓小骨数量为低遗传力(0.13), 脉弓小骨数量为中等遗传力(0.37)。Xiong等[22]认为可以通过家系选择育种来有效减少脉弓小骨数量。在20世纪90年代后期, DNA分子标记辅助育种的出现加快了育种进程[63]。马吉敏等[64]从200个微卫星位点中筛选出149个多态性位点, 经关联性分析获得8个与镜鲤肌间骨数量显著相关的微卫星位点。Wan等[65]利用混合分组分析(Bulked segregant analysis, BSA)方法检测团头鲂肌间骨极少(<100)和极多(>130)两个群体中的SNPs, 共确定了6074个SNPs且最终筛选出181个与团头鲂肌间骨数量相关的候选SNP位点。该研究首次探索了SNPs位点与肌间骨数量的关联性, 为肌间骨数量相关的分子标记辅助育种奠定了基础。

表 2 鱼类肌间骨性状相关的遗传改良研究Tab. 2 Summary of studies on genetic improvement of fishes related to intermuscular bone traits
3.2 杂交育种
除选择育种外, 杂交育种也是最基础且得到广泛应用的育种技术之一[59]。一些研究人员对不同鱼类进行杂交, 对获得的后代进行肌间骨相关分析研究。聂春红等[64]对团头鲂与其他3种鲂属鱼类[三角鲂(M. skolkovii)、广东鲂(M. terminalis)和厚颌鲂(M. pellegrini)]正反交及亲本自交后代共10 种杂交组合子代的肌间骨数目、形态、分布和长度进行了比较分析。研究结果表明, 鲂属鱼类近缘杂交子一代的肌间骨相关性状特征无显著改变。蒋文枰等[67]对鲌鲂F1代、鲌鲂F2代和母本翘嘴鲌(Culter alburnus)、父本团头鲂肌间骨的数目、形态和分布进行统计分析, 研究表明鲌鲂F1代、鲌鲂F2代在肌间骨数目和形态复杂性方面较母本有所减少, 并且F2代较F1代还呈现下降趋势。钟泽洲[68]对团头鲂、翘嘴红鲌、鲌鲂F1代及翘嘴鳊4种不同杂交鱼的肌间骨的数目、形态和分布进行研究, 结果说明翘嘴鳊等人工培育的杂交鱼比原始亲本翘嘴红鲌、团头鲂的肌间骨少。Guo等[69]研究广东鲂(♀)和翘嘴鲌(♂)属间杂交F1代的肌间骨数目形态特征, 发现鲌鲂F1代肌间骨的数目和形态复杂程度相对父本均有所下降, 而相对母本有所升高, 具有一定程度的杂种优势。Wu等[70]用远缘杂交技术培育的新型杂交鲌(团头鲂♀×翘嘴鲌♂)肌间骨数量相对于父本肌间骨量减少5.7%。李志等[71]比较分析了不同月龄异育银鲫A+品系和候选新品系F系的肌间骨形态数量差异, 研究结果表明, 候选新品系F系髓弓小骨表现出形态复杂程度低、数量减少的性状,相对于A+系有利于食用的优势。
3.3 多倍体和雌核发育育种
多倍体育种和人工雌核生殖属于细胞工程育种技术, 是在细胞或染色体组水平上进行遗传改良的育种技术[59]。黎玲等[72]比较了5种不同倍性鱼肌间骨的数目、形态和分布, 结果表明改良二倍体红鲫和改良三倍体鲫等人工培育的杂交鱼比野生鲫的肌间骨数量少, 为培育少或无肌间骨鱼类提供一种育种方法。关柠楠等[73]对86尾雌核发育团头鲂群体肌间骨的数目、形态、分布和长度进行了比较分析。结果表明, 与正常的团头鲂群体肌间骨的数目相比, 该群体的肌间骨的数目并没有明显减少。徐晓锋等[23]通过人工诱导雌核发育纯合二倍体草鱼(Ctenopharyngodon idellus)使突变基因的性状显现, 在5尾散鳞突变体草鱼中筛选出了1尾正常发育的无肌间骨的草鱼。
3.4 基因编辑育种
此外, 随着基因编辑技术的发展, Zhong等[74]使用CRISPR/Cas9基因编辑技术敲除鲤sp7a基因, 结果表明sp7a–/–突变体存在明显的肌间骨变短的现象, 但突变体同时存在骨缺损, 包括鳃盖、上颌骨功能不全和背部弯曲等问题。Nie等[40]通过基因编辑技术分别获得了scxa基因突变斑马鱼, 突变体与野生型斑马鱼相比背部无肌间骨, 仅尾部含有少量肌间骨, 总数较野生型减少约70%, 个别突变体虽然存在肋骨发育缺陷和肌膈发育缺陷, 但整体生命活动和繁殖能力与野生型没有明显差异。杨建等[75,76]同样通过基因编辑技术获得了无肌间骨的斑马鱼突变品系, 虽然作者没有指出具体的基因, 但通过qRT-PCR对比分析5个肌肉特异性基因(mef2、myf5、myod、myog和sox6)和6个骨骼发育相关基因(bmp2a、bmp4、smad1、smad4a、runx2a和sp7)在无肌间骨突变品系和野生斑马鱼中的表达情况, 结果表明肌间骨存在与否对斑马鱼胚胎发育以及肌肉发育无显著影响; 肌间骨缺失对斑马鱼骨骼发育无显著影响, 只在胚胎发育时期影响骨骼相关基因表达水平的变化, 结合组织学染色结果推测,肌间骨缺失对斑马鱼骨骼发育无显著影响。
4 研究展望
世界上对鱼类肌间骨的遗传育种研究最早始于1967年, 之后近50年, 这方面的研究进展比较慢。从图 2可以看出, 自2010年后, 越来越多的研究人员开始围绕鱼类肌间骨分子遗传机制和遗传育种开展研究。研究肌间骨的分子机制对揭示鱼类肌间骨的系统进化有着重要意义, 随着分子编辑技术和单细胞测序技术的快速发展, 通过开展有肌间骨和无肌间骨鱼类肌膈中肌腱组织细胞类型的确定和基因表达差异性研究, 筛选鉴定诱导有肌间骨鱼类肌腱源性干细胞向成骨细胞分化的关键基因;通过基因过表达和基因功能缺失等研究方法明确基因的调控功能, 阐明鱼类肌间骨发育的分子机制,进一步可通过CRISPR/Cas9基因编辑技术培育少或无肌间骨的鱼类。
此外, 肌间骨的遗传力为中等遗传力且一些与肌间骨数量相关的标记基因也被筛选鉴定, 这些标记基因可以被用来指导少肌间骨鱼类的选育, 尤其是鲤科鱼类。随着科学技术的快速发展和测序成本的降低, 二代/三代测序技术与全基因组关联研究(Genome wide association studies, GWAS)技术也可以用来确定与肌间骨数量相关的标记基因, 进一步提高少肌间骨鱼类选育的准确性。无肌间骨的草鱼或巴西大盖巨脂鲤可以用来与正常个体杂交,在获得F1代基础上进而形成F2家系, 用于QTL定位肌间骨有/无的关键基因, 为后续研究肌间骨的分子机制以及开展无肌间骨的鱼类选育奠定基础。中国的水产养殖已为世界做出重要贡献, 若能培育出无“小刺”的主养大宗鱼, 必将成为对世界水产的又一重大贡献。

图 2 硬骨鱼类肌间骨相关分子机制及遗传育种研究时间进程Fig. 2 The time course of molecular mechanism and genetic breeding related to intermuscular bone in teleosts
